水盐胁迫对超高产小麦幼苗生长及根系导水率的影响
2023-03-11付媛媛司转运王兴鹏高阳李倩丁小会杨娜赵书珍万素梅
付媛媛,司转运,王兴鹏,高阳,李倩,丁小会,杨娜,赵书珍,万素梅
水盐胁迫对超高产小麦幼苗生长及根系导水率的影响
付媛媛1,2,司转运2,王兴鹏3,高阳2,李倩3,丁小会2,杨娜2,赵书珍1*,万素梅1*
(1.塔里木大学 农学院,新疆 阿拉尔 843300;2.中国农业科学院 农田灌溉研究所/农业农村部作物需水与调控重点实验室,河南 新乡 453002;3.塔里木大学 水利与建筑工程学院,新疆 阿拉尔 843300)
【目的】揭示水盐胁迫对超高产小麦幼苗生长及根系导水率的影响机制。【方法】以超高产小麦品种“烟农1212”为研究对象,设置水分胁迫、盐分胁迫和水盐胁迫3种胁迫处理(2% PEG6000、0.1% NaCl和2% PEG6000+0.1% NaCl)和对照(Hoagland营养液,CK),测定不同处理下的小麦的生长指标、根系导水率及全氮、K+和Na+量,利用逐步回归分析方法,分析水盐胁迫下导致小麦幼苗根系导水率降低的因素。【结果】①与CK相比,水分胁迫、盐分胁迫和水盐双重胁迫分别使冬小麦幼苗的株高和叶面积显著降低。②水分及盐分胁迫处理的根冠比与CK相比分别增加了12%和14%,而在水盐双重胁迫条件下则显著降低了6%。③与CK相比,盐分胁迫和水盐双重胁迫显著增加了小麦叶片和根系的Na+/K+比,水分胁迫下的Na+/K+比虽然也有增加,但差异不显著。④水分胁迫、盐分胁迫及水盐双重胁迫显著降低了叶片的全氮量。⑤与CK相比,水分、盐分及水盐双重胁迫使小麦幼苗根系总导水率显著降低了58%、51%和93%,逐步回归分析表明,小麦幼苗的叶面积与根系导水率显著正相关(2=0.961 9)。【结论】水盐胁迫条件下,叶面积可作为表征根系导水率的关键指标。
水盐胁迫;超高产小麦;K+量;Na+量;根系导水率
0 引言
【研究意义】干旱和土壤盐渍化是农业生产面临的巨大挑战。水资源短缺及作物对干旱和盐分胁迫的反应不仅涉及水资源的高效利用,同时也与粮食安全生产紧密相关,因此提高逆境条件下的作物水分利用效率在农业生产中尤为重要[1-2]。小麦是我国主要的粮食作物,其种植范围多分布于干旱区与半干旱区。一方面,在干旱/半干旱地区存在近5亿亩的盐碱地[3];另一方面,近几年的干旱导致小麦总产量持续下降[4]。因此,如何稳定盐碱和干旱威胁下小麦的产量,关系到国家粮食安全及社会稳定[5-6]。
【研究进展】根系是作物直接接触土壤的器官,当土壤水分不足、盐分量较高时,根系的生长发育最先受到影响,进而影响作物地上部生长[7]。此时,植物根系吸收和传导水分和养分的能力对植物的生长状况起决定作用。根系导水率表征根系传导水分的能力,是根系感受土壤水分变化的最直接的生理指标[8]。盐分和干旱胁迫显著降低了作物的根系导水率。杨晓青等[9]、Munns等[10-11]和Knipfer等[12]研究表明,盐分或干旱胁迫使小麦[9]、大麦[10-12]根系导水率降低50%~60%。Caldeira等[13]指出,干旱胁迫下植物激素量与水通道蛋白基因的变化是导致玉米根系导水率降低的主要因素。Veselov等[14]也发现大麦根系导水率的增加与水通道蛋白基因的表达有关。Faran等[15]研究发现,水分胁迫改变了根系构型与抗氧化酶活性,从而降低根系吸水与叶片水势。Li等[16]研究指出,CO2浓度升高调节了植物激素量和水通道蛋白相关基因的表达,维持了细胞间水分运输的正常贡献率,提高了根系生物量和导水率,从而缓解了干旱胁迫对黄瓜幼苗的负面影响。Zhang等[17]研究发现,水分胁迫条件下适量的锌通过维持玉米根系结构的完整性,降低抗氧化酶活性,增加水通道蛋白基因的表达,提高了玉米根系的导水率,且叶面积的增加可以增加植物的蒸腾拉力,促进根系对水分的吸收,提高根系导水率,从而调节作物的水分平衡。【切入点】烟农1212是山东省烟台市农业科学院选育的超高产小麦品种,具有“一高五抗”的特点,即高产,抗寒,抗病,抗倒伏,抗干热风,抗早衰,产量可达1 200 kg/hm2[18],但其遭受盐分及干旱等非生物胁迫后减产风险较大。李源方等[19-20]研究发现,随着灌水量的减少,高产品种济麦22、烟农1212的产量显著降低。因此,选择合适的措施缓解环境胁迫产生的减产风险至关重要,其中通过改善根系导水率是一种重要的方式[17]。【拟解决的关键问题】因此,研究水盐胁迫对超高产小麦烟农1212的形态指标、根系活力、根系生长参数、全氮量和K+、Na+量的变化,分析水盐胁迫条件下影响根系导水率的关键因素,可为超高产小麦在干旱/半干旱区中低产农田的推广提供技术支撑。
1 材料与方法
1.1 试验设计
试验于2021年在中国农业科学院七里营综合试验基地的人工气候室内进行(35°54′N,113°29′E)。人工气候室面积13 m2,昼、夜温度控制为25、20 ℃,光照时间12 h,光强为600 μmol/(m2·s),相对湿度为40%~50%。试验设置3个处理,由Hoagland+0.1% NaCl(S)模拟盐分胁迫,由Hoagland+2% PEG6000(D)模拟水分胁迫,由Hoagland+(2%PEG6000+0.1% NaCl)(S+D)模拟水盐双重胁迫,另设无胁迫的Hoagland溶液为CK,Hoagland溶液是一种可以作为复合肥或无土栽培的营养液,为正常肥力水平。供试小麦品种为“烟农1212”。挑选大小均匀、籽粒饱满的种子,用0.5%的次氯酸钠消毒25 min,消毒后用去离子水清洗数遍,用吸水纸将种子表面水分吸干后,将种子均匀摆放于装有不同种类营养液的培养皿中。培养皿置入滤纸,试验开始前用75%的酒精对培养皿消毒,每个培养皿装入20粒种子,20 mL相应的培养液。每天更换发芽床和溶液,以保持培养皿内溶液水势保持恒定。前2天盖上盖子防止溶液蒸发。将培养皿置于人工气候室内,于25 ℃环境中培养,前2天黑暗下发芽,2 d后开灯。移栽前每天用75%的酒精对人工气候室进行消毒,7 d后挑选相同处理长势一致的小麦幼苗转移至PVC水培桶(直径12 cm,高30 cm)中,每桶4棵,每桶连接增氧泵,保持通气,每4天更换1次营养液,第7天用1/2 Hoagland营养液,第12天用Hoagland营养液。Hoagland营养液的4种大量元素采用Hoagland和微量元素通用配方:1 180 mg/L Ca(NO3)2·4H2O、506 mg/L KNO3、136 mg/L KH2PO4、693 mg/L MgSO4,营养液的微量元素通用配方参照韦三立等[21]提出的配方。每个处理设置15个重复,在胁迫处理后第17天进行各项指标的测定。
1.2 观测项目与方法
1.2.1株高和叶面积
用直尺从小麦基部量至小麦叶尖处获取株高;量取叶长,最大叶宽,叶面积=叶长×最大叶宽×0.85[22],每个处理测定3次重复。
1.2.2叶片和根系的相对含水率
每个处理随机选取4株[23]小麦,将叶和根分开,先用吸水纸擦干,利用1/10 000天平称得鲜质量;将样品在去离子水中浸泡24 h后称饱和鲜质量,而后放入105 ℃烘箱杀青30 min,75 ℃烘干至恒质量。利用式(1)计算叶片和根系的相对含水率[24]:
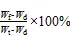
式中:为相对含水率;f为鲜质量(g);d为干质量(g);t为饱和质量(g)。
1.2.3 根系导水率与根系参数
在幼苗生长17 d后,每个处理选择4~5株生长一致的小麦苗,采用压力室法测定根系导水率,方法参照Gal等[24]的方法。具体方法如下:从水培桶中取1株植物转移到1张新的潮湿纸上,以避免根系在此过程中发生水分蒸发;在茎根接合处上方3cm处剪下小麦叶;将剪下的小麦叶片保存在信封中,并在75 ℃环境中干燥24 h;取一小块密封材料放在距根部3 cm的根系上。轻轻地把所有的根收集在一起,用密封材料包裹住根;将样品插入压力室的塞孔中,将密封材料粘在底座上,然后按压材料以形成紧密的密封;加压并用放大镜观察,至切口表面流出汁液(约0.40 MPa,用0表示),在此压力下让植物适应此压力2 min;2 min后,清除剩余渗出液并启动计时器4 min。使用移液器将渗出液转移至1.5 mL离心管(编号1);在0.40 Mpa压力下收集4 min后,将压力升高至0.54 MPa。重复以上步骤,每次加压0.14 MPa再收集4个离心管,测量30 min后,向右移动刻度盘(标记排气)以释放压力;将5个Eppendorf 管中的液体离心(1 000 r/min),然后使用移液器测量每个管的体积,并计算水流通量=/120 s,根系总导水率即为水流通量()与压力差关系曲线的斜率,即根系总导水率(p)=/Δ;测量结束后,从腔室中取出样品;切下剩余的根用纸将根部稍微擦干,用Epson V800根系扫描仪对根系进行扫描,应用WinRHIZO软件分析根长、根直径、根表面积和根体积等形态参数,然后得出根系参数,用于计算下列参数:
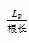
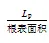
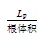
式中:r为单位根长导水率(m/(mL·h·MPa));pr为单位根面积导水率(cm2/(mL·h·MPa));pv为单位根体积导水率(cm3/(mL·h·MPa));p为根系总导水率(mL/(h·MPa))。
扫描后的根系样品在105 ℃条件下杀青,75 ℃条件下烘干,利用1/10 000天平称的质量,获得根干质量,并计算根冠比,计算式为:
根冠比=根系干质量/地上部干质量。 (5)
1.2.4 根系活力
每个处理取5株小麦,将根系剪成1 cm左右的小段,称取0.3 g放入离心管中,然后加入0.4%的氯化三苯基四氮唑(TTC)和0.1 mol/L磷酸缓冲液(pH=7.0)各5 mL,充分混合使根系完全浸入上述溶液中,置于37 ℃温箱内保温培养3 h,使根尖切断显色(红色)。保温显色后,立即加入1 mol/L H2SO4溶液终止反应,取出染色根系用20 mL甲醇提取4 h,取上清液485 nm比色,根系活力用四氮唑还原量表示[26]。
1.2.5叶片和根系的全氮、K+、Na+量
每个处理随机取3个重复,每个重复取10株小麦,将地上部与地下部分别置于烘箱中于105 ℃杀青30 min后,75 ℃烘干至恒质量。将烘干样品研磨成粉末,每个重复称量0.150 0 g样品,采用H2SO4-H2O2消煮。利用AA3流动分析仪(Seal,德国)测定小麦植株的全氮量,使用火焰光度计(FP650,中国)测定小麦植株的Na+、K+量。
1.3 数据处理
试验数据使用Excel 2020软件进行分析,采用Origin 2018作图;采用DPS v13.5数据处理软件进行统计分析,采用最小显著性差异法(least significant difference,LSD)检验<0.05水平上的显著性;为分析各指标与根系总导水率之间的关系,筛选出影响根系导水率的关键指标,以4个处理的株高(1),叶面积(2),根系活力(3),根长(4),根直径(5),根相对含水率(6),叶相对含水率(7),全N-叶(8),全N-根(9),K+-叶(10),K+-根(11),Na+-叶(12),Na+-根(13)为自变量,以根系总导水率为因变量,进行逐步回归分析。回归方程中的所有解释变量对因变量值联合的影响程度用决定系数2表示。
2 结果与分析
2.1 水盐胁迫对小麦生长发育及离子量的影响
图1为水盐胁迫对小麦幼苗株高和叶面积的影响。与CK相比,水分胁迫、盐分胁迫以及水盐双重胁迫均显著降低了小麦幼苗的株高和叶面积。株高分别降低15%、25%和46%,叶面积分别降低了47%、50%和79%;且水分胁迫、盐分胁迫和水盐双重胁迫间株高差异显著。

图1 水盐胁迫对小麦幼苗株高和叶面积的影响
图2为水盐胁迫对小麦幼苗叶片和根系相对含水率的影响。与CK相比,水分胁迫与水盐双重胁迫分别使小麦幼苗的叶片相对含水率降低了5%和8%(<0.05);盐分胁迫虽然也降低了小麦幼苗叶片的相对含水率,但与CK的差异不显著(>0.05)。与CK相比,水分胁迫使小麦根系相对含水率显著降低了18%,盐分及水盐双重胁迫使小麦根系相对含水率分别降低2%和8%,但差异不显著。
由图3可知,小麦幼苗叶片全氮量均高于小麦幼苗根系全氮量,这主要与根系吸收的养分运输至地上部供植物进行光合作用有关。与CK相比,水分胁迫、盐分胁迫和水盐双重胁迫使小麦幼苗叶片的全氮量分别降低了8%、4%和42%,且处理间差异显著;与CK相比,小麦幼苗根系中的全氮量在水分胁迫及水盐双重胁迫条件下分别显著降低了8%和34%,但盐分胁迫使小麦幼苗根系中全氮量增加了0.7%。水分胁迫、盐分胁迫和水盐胁迫使小麦幼苗叶片的K+量分别降低4%、9%和52%,根系的K+量分别降低12%、13%和75%,叶片的Na+/K+升高3%、128%、352%,根系的Na+/K+升高38%、140%和486%。

图2 水盐胁迫对小麦幼苗叶片和根系相对含水率的影响
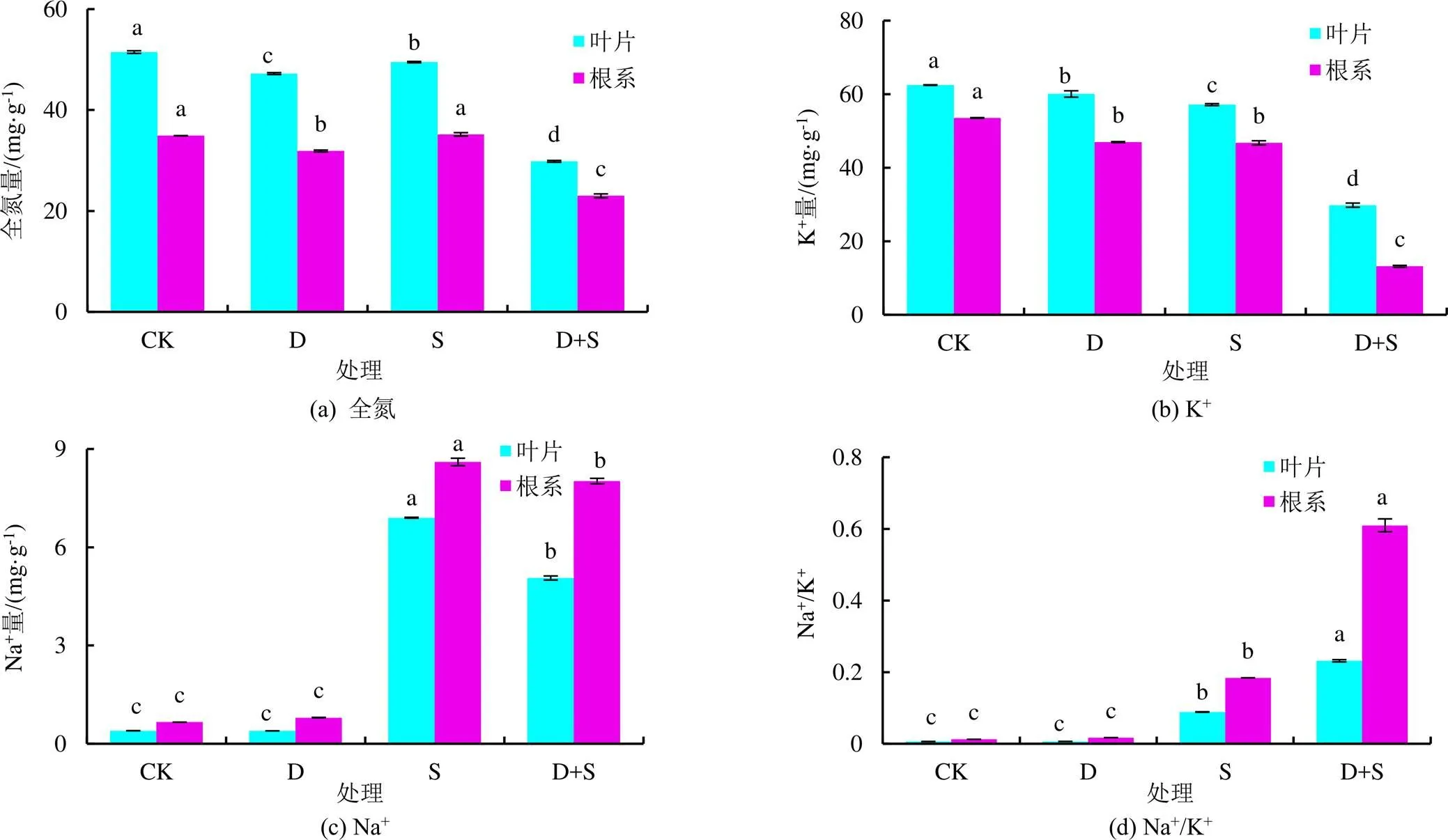
图3 水盐胁迫对小麦幼苗离子量的影响
2.2 水盐胁迫对小麦幼苗根系参数、根系活力及根冠比的影响
图4为水盐胁迫对小麦幼苗根系参数的影响。小麦幼苗的根长表现为D处理>CK>S处理>D+S处理,而小麦幼苗平均根直径表现为D+S处理>D处理>S处理>CK。水分胁迫条件下小麦幼苗的根长相比CK略有增加(4%),而根系平均直径显著增加(27%);盐分胁迫抑制了小麦幼苗的根长(>0.05),但增加了根系平均直径;而水盐胁迫不仅显著抑制了小麦幼苗的根长,且显著增加根系平均直径,表明单一胁迫和水盐双重胁迫对根系生长的影响不同。
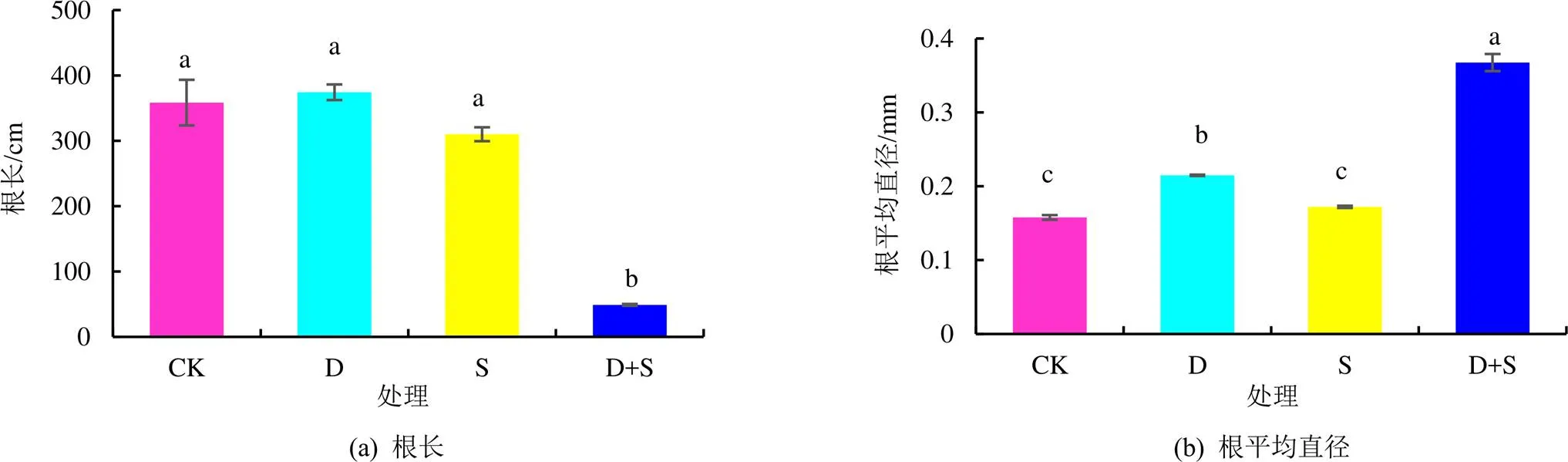
图4 水盐胁迫对小麦幼苗根系参数的影响
图5为水盐胁迫对小麦幼苗根系活力及根冠比的影响。水分和水盐双重胁迫显著增加了小麦幼苗的根系活力,与CK相比分别提高了82%和89%;盐分胁迫虽然增加了根系活力但不显著,说明此处理的盐分胁迫对植物根系活力的影响较小。与CK相比,水分和盐分胁迫均提高了小麦幼苗的根冠比,分别提高了11%和12%,而水盐双重胁迫使小麦幼苗的根冠比降低6%。

图5 水盐胁迫对小麦幼苗根系活力及根冠比的影响
2.3 水盐胁迫对小麦幼苗根系导水率的影响
由图6可知,水分和盐分胁迫均抑制了小麦幼苗的根系导水率。水分和盐分胁迫对根系总导水率,单位根面积导水率及单位根体积导水率的抑制表现出高度相似的趋势,均表现为CK>S处理>D处理>D+S处理。与CK相比,水分胁迫,盐分胁迫及水盐胁迫使根系总导水率显著降低了58%、51%和93%。在所有处理下,单位根长导水率表现为CK>S处理>D+SD处理>D处理。与CK相比,水分胁迫,盐分胁迫及水盐胁迫使其降低60%、43%和47%。
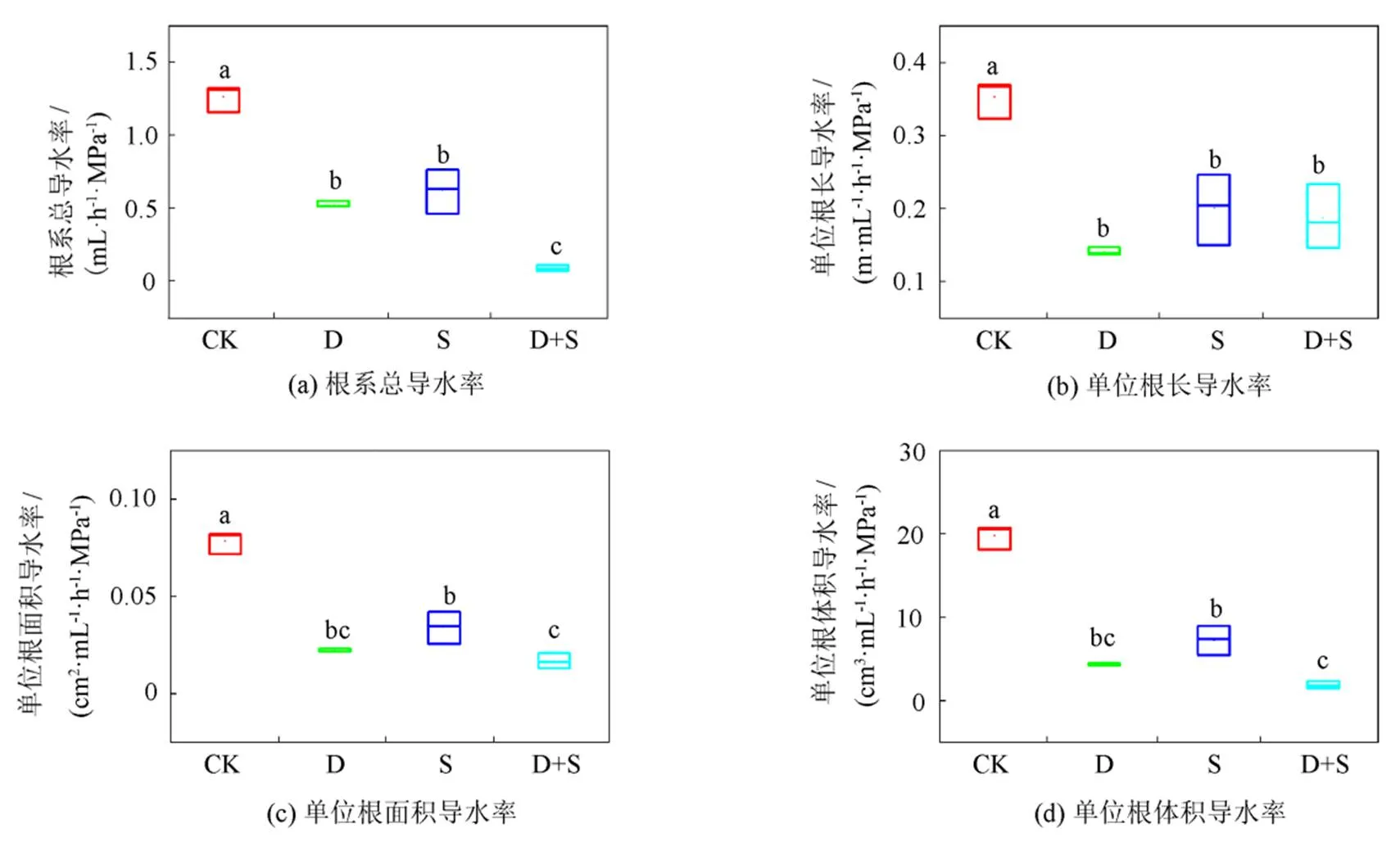
图6 水盐胁迫对小麦幼苗根系导水率的影响
以根系总导水率为因变量,株高(1),叶面积(2),根系活力(3),根长(4),根直径(5),根相对含水率(6),叶相对含水率(7),全N-叶(8),全N-根(9),K+-叶(10),K+-根(11),Na+-叶(12),Na+-根(13)为自变量,共12组数据进行多元逐步回归分析,得到最优模型,=-0.17+0.112(=123.7,2=0.961 9,<0.01)。由此可知,在水盐胁迫条件下,表征小麦幼苗根系导水率因素中,关键的指标为叶面积。叶面积降低,光合固碳能力减弱,蒸腾量降低,蒸腾拉力减少,故小麦幼苗的根系导水率减少;反之,根系导水率降低,向地上部运输养分及水分减少,导致叶面积降低。
3 讨论
根系导水率是表征植物根系吸水能力的一个重要指标,表示单位时间单位压力梯度下流经单位根表面积的水流通量[27]。本研究表明,与CK相比,水分、盐分胁迫及水盐双重胁迫显著降低了小麦幼苗的根系总导水率,分别降低了58%、51%和93%,且水分、盐分胁迫下的根系总导水率与水盐双重胁迫下的根系总导水率差异显著。已有研究发现,水盐胁迫下根内皮层上的凯氏带形成速度加快、木栓质和木质素量增大,同时使根木质部导管中栓塞形成,增大了根系导水的径向和轴向阻力,从而导致根系导水率减小[28]。Meng等[29]和Nedjimi等[30]的研究表明,盐分胁迫降低植物根系导水率与通道蛋白活性下降有关。王生毅等[31]利用水通道蛋白抑制剂HgCl2证明,在干旱胁迫下番茄水通道蛋白活性下降导致根系导水率降低。本研究表明,盐分胁迫条件下小麦幼苗的根系总导水率、单位面积导水率以及单位体积导水率均高于水分胁迫及水盐双重胁迫下的值。主要原因可能为盐分胁迫条件下小麦幼苗的根系平均直径均低于水分、水盐双重胁迫下小麦幼苗的根系平均直径。孙文泰等[32]研究表明,细根更有利于作物的导水效率。相比水分胁迫,盐分胁迫及水盐双重胁迫条件下的作物具有更高单位根长导水率的主要原因有:①2% PEG6000促进小麦幼苗根系的生长,根系接触土壤的面积增大,增加其总导水率,但单位根长导水率却不高;②盐分及水盐双重胁迫条件下,作物通过增加单位根长导水率,以维持植物的存活。
根系是植物吸收水分和养分的主要器官,根长、根表面积、根体积和根平均直径是衡量抗旱耐盐的重要指标[33-34]。与CK相比,水分胁迫条件下小麦幼苗的根长和平均根直径分别增加了4%和36%(图4),说明烟农1212表现出作为中等抗旱品种的形态之一[35]。盐分胁迫及水盐双重胁迫使小麦幼苗的根长降低了13%和83%,但其平均根直径增加了9%和133%,这与葛建坤等[34]和王树凤等[36]研究结果一致。这主要是由于在盐分条件下,植物通过降低根系表面积,发展通气组织等来减少植物对盐离子的吸收以及减缓盐分对植物造成的伤害[35],但这种机制增加了植物吸收水分和养分的径向阻力。由于在逆境条件下,保证植物的存活是关键,所以这种机制在逆境条件下是可取的。在受到干旱胁迫时,根冠比呈增长趋势,是为了保证自身能够吸收足够的水和养分[5]。本研究结果表明,与CK相比,水分及盐分胁迫使小麦幼苗的根冠比增加了12%和14%,有利于植物吸收水分和养分,以维持小麦幼苗的正常生长,这与龚璞等[5]研究结果相似。与CK相比,水盐双重胁迫使小麦幼苗根冠比降低6%,水盐胁迫极显著地抑制了幼苗的生长。本研究结果表明,水盐胁迫抑制了小麦幼苗叶片和根系中的全氮和K+量,增加了小麦幼苗的Na+量,这与马洪波等[37]研究结果一致。究其原因,可能是因为Na+与K+和氮存在竞争拮抗作用,导致氮及K+吸收受阻[37-38]。盐分胁迫增加了根系中全氮量,但差异不显著,说明此浓度下盐分胁迫对小麦全氮量影响较小。
植物表观形态学常用来衡量植物在逆境条件下生长情况[39]。植物遭受非生物胁迫后,细胞分裂、伸长减慢,叶片及茎秆扩张受阻,最直观的表现为植物株高和叶面积降低[40];同时,光合产物与向地下部分配的产物也相应减少[41],最终导致植株生物量降低。这也与水盐胁迫降低根系导水率有关。水分胁迫,盐分胁迫和水盐双重胁迫等非生物胁迫分别使小麦幼苗的株高降低15%、25%、46%,叶面积分别降低 47%、50%和79%。叶片相对含水率是衡量植物叶片持水能力的指标[42],不仅反映了代谢强弱,也反映植物在非生物胁迫下的吸水能力以及抵抗脱水的能力[42-44],更能直接反映作物生长发育的实际状况。与CK相比,水分胁迫、盐分胁迫和水盐双重胁迫显著降低了叶片的相对含水率。与逆境胁迫降低根系导水率水分向上运输有关。胁迫能在一定程度上提高根系活力,主要原因是经过胁迫后,能将根系生长量保持较高水平补偿吸收面积降低带来的损失,以便地上部叶片可进行高效的光合作用抵御胁迫带来的危害,这可能是作物的一种适应胁迫的生存机制[45-46]。本研究也得到了类似结论,即与CK相比,水分胁迫、盐分胁迫及水盐混合胁迫使根系活力增加了82%、18%和89%,这与孟灵军等[47]和石庆华等[48]的研究结果一致。
Zhang等[17]研究表明,叶面积增加提高了植物合成干物质的能力,间接增加其蒸腾拉力,促进根系对水分的吸收,提高根系导水率。叶面积与根系导水率呈显著正相关,且在水盐胁迫条件下,叶面积是表征小麦幼苗根系导水率的关键指标。
4 结论
1)水分胁迫、盐分胁迫及水盐双重胁迫降低了小麦幼苗的株高、叶面积,增加了平均根直径,降低了叶片及根系的全氮及K+量,增加了叶片及根系中Na+量及Na+/K+比。
2)单一水分胁迫促进小麦幼苗根长生长,而盐分及水盐双重胁迫抑制小麦幼苗的根长生长,使根系导水率降低,其中盐分胁迫的根系导水率高于水分胁迫及水盐双重胁迫,从而使盐分胁迫的叶片相对含水率高于干旱胁迫及水盐复合胁迫。
3)干旱及水盐双重合胁迫激发小麦幼苗的根系活力,保证其在逆境条件下的存活。单一水分、盐分胁迫增加了小麦幼苗的根冠比,而水盐双重胁迫处理相反。
4)通过逐步回归分析,在上述影响根系导水率的指标中,本试验条件下可用叶面积表征冬小麦幼苗的根系导水率。
[1] 谢娟娜, 路杨, 房琴, 等. 种子引发对小麦抗盐及抗旱特性影响综述[J]. 中国生态农业学报, 2016, 24(8): 1 025-1 034.
XIE Juanna, LU Yang, FANG Qin, et al. Effect of seed priming on drought and salinity tolerance of wheat: An overview[J]. Chinese Journal of Eco-Agriculture, 2016, 24(8): 1 025-1 034.
[2] 周雪英. 不同倍性小麦对旱后复水的生理生态响应[D]. 杨凌: 西北农林科技大学, 2007.
ZHOU Xueying. Physiological effects of post-drought and rewatering on wheat with different pliody[D]. Yangling: Northwest A&F University, 2007.
[3] 孙洁. 国家农业高新技术产业示范区:带动中国农业走创新驱动发展道路[J]. 中国农村科技, 2021(12): 30-33.
SUN Jie. National Agricultural High-tech Industry Demonstration Zone: driving China’s agriculture to take the path of innovation driven development [J]. China Rural Science & Technology, 2021(12): 30-33.
[4] 封富. 冬小麦品种幼苗抗旱性差异的代谢组学分析[D]. 北京: 中国农业科学院, 2020.
FENG Fu. Metabonomics Analysis on the difference of drought resistance in seedling of winter sheat variety[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[5] 龚璞. 冬小麦抗旱萌发的代谢组学分析及其初步验证[D]. 郑州: 河南农业大学, 2018.
GONG Pu. Metabolomic analysis and preliminary verification of drought-resistance of winter wheat in germination[D]. Zhengzhou: Henan Agricultural University, 2018.
[6] 楼睿焘. 冬小麦对连续干旱的响应规律研究[D]. 郑州: 华北水利水电大学, 2021.
LOU Ruitao. Study on the response of winter wheat to continuous drought[D]. Zhengzhou: North China University of Water Resources and Electric Power, 2021.
[7] 朱广龙, 陈许兵, 郭小倩, 等. 酸枣根系结构可塑性对自然梯度干旱生境的适应机制[J]. 生态学报, 2018, 38(16): 5 810-5 818.
ZHU Guanglong, CHEN Xubing, GUO Xiaoqian, et al. Plasticity of root morphology of Ziziphus jujuba var. spinosa in response to natural drought gradient ecotopes[J]. Acta Ecologica Sinica, 2018, 38(16): 5 810-5 818.
[8] CANALES F J, RISPAIL N, GARCÍA-TEJERA O, et al. Drought resistance in oat involves ABA-mediated modulation of transpiration and root hydraulic conductivity[J]. Environmental and Experimental Botany, 2021, 182: 104 333.
[9] 杨晓青, 张岁岐, 刘小芳, 等. 不同抗旱型冬小麦品种根系水力导度与解剖结构的关系[J]. 西北农林科技大学学报(自然科学版), 2007, 35(8): 160-164.
YANG Xiaoqing, ZHANG Suiqi, LIU Xiaofang, et al. Relationship between roots hydraulic conductivity and root anatomy of winter wheat (T. aestivum)[J]. Journal of Northwest A & F University (Natural Science Edition), 2007, 35(8): 160-164.
[10] MUNNS R, PASSIOURA J B. Effect of prolonged exposure to NaCl on the osmotic pressure of leaf xylem sap from intact, transpiring barley plants[J]. Functional Plant Biology, 1984, 11(6): 497.
[11] MUNNS R, PASSIOURA J B. Hydraulic resistance of plants. III. effects of NaCl in barley and lupin[J]. Functional Plant Biology, 1984, 11(5): 351.
[12] KNIPFER T, DANJOU M, VIONNE C, et al. Salt stress reduces root water uptake in barley (L.) through modification of the transcellular transport path[J]. Plant, Cell & Environment, 2021, 44(2): 458-475.
[13] CALDEIRA C F, BOSIO M, PARENT B, et al. A hydraulic model is compatible with rapid changes in leaf elongation under fluctuating evaporative demand and soil water status[J]. Plant Physiol, 2014, 164: 1 718-1 730.
[14] VESELOV D S, SHARIPOVA G V, VESELOV S Y, et al. Rapid changes in root HvPIP2; 2 aquaporins abundance and ABA concentration are required to enhance root hydraulic conductivity and maintain leaf water potential in response to increased evaporative demand[J]. Functional Plant Biology, 2018, 45(2): 143-149.
[15] FARAN M, FAROOQ M, REHMAN A, et al. High intrinsic seed Zn concentration improves abiotic stress tolerance in wheat[J]. Plant and Soil, 2019, 437: 195-213.
[16] LI Y M, LI S H, HE X R, et al. CO2enrichment enhanced drought resistance by regulating growth, hydraulic conductivity and phytohormone contents in the root of cucumber seedlings[J]. Plant Physiology and Biochemistry, 2020, 152: 62-71.
[17] ZHANG L, YAN M F, REN Y Y, et al. Zinc regulates the hydraulic response of maize root under water stress conditions[J]. Plant Physiology and Biochemistry, 2021, 159: 123-134.
[18] 王竟绍, 盛玉凤, 刘红胜, 等. 小麦新品种烟农1212高产栽培技术[J]. 安徽农学通报, 2020, 26(15): 84, 153.
WANG Jingshao, SHENG, Yufeng, LIU Hongsheng, et al. New wheat variety yannong 1212 cultivation techniques for high yield[J]. Anhui Agricultural Science Bulletin, 2020, 26(15): 84, 153.
[19] 李源方, 李宗新, 张慧, 等. 优化品种匹配和灌水量提高冬小麦-夏玉米产量及水分利用效率研究[J]. 山东农业科学, 2020, 52(10): 18-24.
LI Yuanfang, LI Zongxin, ZHANG Hui, et al. Study on improving yield and water use efficiency of winter wheat and summer maize by optimizing variety matching and irrigation amount[J]. Shandong Agricultural Sciences, 2020, 52(10): 18-24.
[20] 李源方. 灌水量与品种匹配对小麦-玉米周年产量和水分利用效率的影响[D]. 泰安: 山东农业大学, 2020.
LI Yuanfang. Effects of irrigation amount and variety matching on annual yield and water use efficiency of wheat and maize[D]. Taian: Shandong Agricultural University, 2020.
[21] 韦三立. 花卉无土栽培[M]. 北京: 中国林业出版社, 2001.
WEI Sanli. Soilless Cultivation of Flowers[M]. Beijing: China Forestry Publishing House, 2001.
[22] 司转运. 水氮对冬小麦-夏棉花产量和水氮利用的影响[D]. 北京: 中国农业科学院, 2017.
SI Zhuanyun. Effects of water and nitrogen application on yield, water and nitrogen utilization of winter wheat and summer cotton[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[23] LI G X, WANG Y, LIU H E, et al. A comparison study of physiological response and TaZIPs expression in seedlings of two wheat (L.) cultivars with contrasting grain zinc accumulation[J]. Plant Science, 2022, 318: 111 237.
[24] COÊLHO M R V, RIVAS R, FERREIRA-NETO J R C, et al. Salt tolerance of Calotropis procera begins with immediate regulation of aquaporin activity in the root system[J]. Physiology and Molecular Biology of Plants: an International Journal of Functional Plant Biology, 2021, 27(3): 457-468.
[25] GAL A, HENDEL E, PELEG Z, et al. Measuring the hydraulic conductivity of grass root systems[J]. Current Protocols in Plant Biology, 2020, 5(2): 110-113.
[26] 白宝璋,金锦子,白崧,等. 玉米根系活力TTC测定法的改良[J]. 玉米科学, 1994, 2(4): 44-47.
BAI Baozhang, JIN Jinzhi, BAI Song, et al. Improvement of TTC method determining root activity in corn[J]. Maize Science, 1994, 2(4): 44-47.
[27] GALLARDO M, EASTHAM J, GREGORY P J, et al. A comparison of plant hydraulic conductances in wheat and lupins[J]. Journal of Experimental Botany, 1996, 47(2): 233-239.
[28] 李瑞, 胡田田, 牛晓丽, 等. 局部水分胁迫对玉米根系导水率的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 42(2): 61-64.
LI Rui, HU Tiantian, NIU Xiaoli, et al. Effects of partial water stress on root hydraulic conductivity of maize[J]. Journal of Northwest A & F University (Natural Science Edition), 2014, 42(2): 61-64.
[29] MENG D L, FRICKE W. Changes in root hydraulic conductivity facilitate the overall hydraulic response of rice (L.) cultivars to salt and osmotic stress[J]. Plant Physiology and Biochemistry, 2017, 113: 64-77.
[30] NEDJIMI B. Effects of salinity on growth, membrane permeability and root hydraulic conductivity in three saltbush species[J]. Biochemical Systematics and Ecology, 2014, 52: 4-13.
[31] 王生毅, 邓西平, 薛崧, 等. 干旱胁迫对西红柿根系水导的影响研究[J]. 西北农林科技大学学报(自然科学版), 2003, 31(2): 105-108.
WANG Shengyi, DENG Xiping, XUE Song, et al. Comparison research on water transportation of non-drought and drought-stressed tomato root systems[J]. Journal of Northwest A & F University (Natural Science Edition), 2003, 31(2): 105-108.
[32] 孙文泰, 马明, 董铁, 等. 西北旱地苹果细根分布及水力特征对长期覆膜的响应[J]. 生态环境学报, 2021, 30(7): 1 375-1 385.
SUN Wentai, MA Ming, DONG Tie, et al. Response of fine root distribution and hydraulic characteristics of apple to long-term plastic mulching in dryland of northwest China[J]. Ecology and Environmental Sciences, 2021, 30(7): 1 375-1 385.
[33] 陈晓晶, 徐忠山, 赵宝平, 等. 盐胁迫对燕麦根系呼吸代谢、抗氧化酶活性及产量的影响[J]. 生态学杂志, 2021, 40(9): 2 773-2 782.
CHEN Xiaojing, XU Zhongshan, ZHAO Baoping, et al. Effects of salt stress on root respiratory metabolism, antioxidant enzyme activities, and yield of oats[J]. Chinese Journal of Ecology, 2021, 40(9): 2 773-2 782.
[34] 葛建坤, 平盈璐, 龚雪文, 等. 水分亏缺对温室覆膜滴灌番茄根系生长及吸水量的影响[J]. 灌溉排水学报, 2022, 41(3): 1-9.
GE Jiankun, PING Yinglu, GONG Xuewen, et al. The effects of water deficit on root growth and water uptake of mulched greenhouse tomato under drip irrigation[J]. Journal of Irrigation and Drainage, 2022, 41(3): 1-9.
[35] 尹启琳, 郭丁预, 姜倩倩, 等. 干旱胁迫对不同小麦品种苗期抗旱生理指标的影响[J]. 烟台大学学报(自然科学与工程版), 2020, 33(3): 289-297.
YIN Qilin, GUO Dingyu, JIANG Qianqian, et al. Effects of drought stress on drought tolerant physiological indexes of different wheat varieties at seedling stage[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2020, 33(3): 289-297.
[36] 王树凤, 胡韵雪, 孙海菁, 等. 盐胁迫对2种栎树苗期生长和根系生长发育的影响[J]. 生态学报, 2014, 34(4): 1 021-1 029.
WANG Shufeng, HU Yunxue, SUN Haijing, et al. Effects of salt stress on growth and root development of two oak seedlings[J]. Acta Ecologica Sinica, 2014, 34(4): 1 021-1 029.
[37] 马洪波, 曹月阳, 陈杰, 等. 土壤盐胁迫对小麦养分和渗透调节物质的影响[J]. 江苏农业学报, 2012, 28(6): 1 300-1 305.
MA Hongbo, CAO Yueyang, CHEN Jie, et al. Effects of soil salt stress on wheat nutrient and osmotic regulator[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(6): 1 300-1 305.
[38] 付媛媛, 江晓慧, 申孝军, 等. 盐胁迫下棉花幼苗叶片K+、Na+含量与光合参数的关系[J]. 生态学杂志, 2021, 40(6): 1 716-1 722.
FU Yuanyuan, JIANG Xiaohui, SHEN Xiaojun, et al. The relationship between foliar K+and Na+concentrations and photosynthetic parameters of cotton seedlings under salt stress[J]. Chinese Journal of Ecology, 2021, 40(6): 1 716-1 722.
[39] HESAMM E. Effect of Allelopathic weeds on Characteristics seed Growth in maize (L. cv. KSC 704)[J]. Advances in Environmental Biology, 2012, 6(1): 297-301.
[40] 王冰, 程宪国. 干旱、高盐及低温胁迫下植物生理及转录因子的应答调控[J]. 植物营养与肥料学报, 2017, 23(6): 1 565-1 574.
WANG Bing, CHENG Xianguo. Physiological responses and regulatory pathways of transcription factors in plants under drought, high-salt, and low temperature stresses[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(6): 1 565-1 574.
[41] 杨贝贝, 赵丹丹, 任永哲, 等. 不同小麦品种对干旱胁迫的形态生理响应及抗旱性分析[J]. 河南农业大学学报, 2017, 51(2): 131-139.
YANG Beibei, ZHAO Dandan, REN Yongzhe, et al. Drought resistance of different wheat cultivars and physiological response to drought stress[J]. Journal of Henan Agricultural University, 2017, 51(2): 131-139.
[42] 于正阳. 小麦干旱响应蛋白WZY2与WZY3-1的功能研究[D]. 杨凌: 西北农林科技大学, 2020.
YU Zhengyang. The functional study of drought-responsive protein WZY2 and WZY3-1[D]. Yangling: Northwest A&F University, 2020.
[43] 曹丹. 不同抗性玉米品种苗期干旱及复水过程中的生理响应[D]. 北京: 中国科学院研究生院(教育部水土保持与生态环境研究中心), 2015.
CAO Dan. Physiological response of maize varieties with different drought resistance during seedling stage in the process of drought and rehydration[D]. Beijing: Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, 2015.
[44] 谢小玉, 张霞, 张兵. 油菜苗期抗旱性评价及抗旱相关指标变化分析[J]. 中国农业科学, 2013, 46(3): 476-485.
XIE Xiaoyu, ZHANG Xia, ZHANG Bing. Evaluation of drought resistance and analysis of variation of relevant parameters at seedling stage of rapeseed (L.)[J]. Scientia Agricultura Sinica, 2013, 46(3): 476-485.
[45] MA S C, DUAN A W, WANG R, et al. Root-sourced signal and photosynthetic traits, dry matter accumulation and remobilization, and yield stability in winter wheat as affected by regulated deficit irrigation[J]. Agricultural Water Management, 2015, 148: 123-129.
[46] 姚宁, 宋利兵, 刘健, 等. 不同生长阶段水分胁迫对旱区冬小麦生长发育和产量的影响[J]. 中国农业科学, 2015, 48(12): 2 379-2 389.
YAO Ning, SONG Libing, LIU Jian, et al. Effects of water stress at different growth stages on the development and yields of winter wheat in arid region[J]. Scientia Agricultura Sinica, 2015, 48(12): 2 379-2 389.
[47] 孟灵军, 周晓琳, 杨蕊, 等. NaCl胁迫对小麦种子萌发及幼苗生长的影响[J]. 科技创新与应用, 2014(10): 262.
MENG Lingjun, ZHOU Xiaolin, YANG Rui, et al. Effects of NaCl stress on seed germination and seedling growth of wheat[J]. Technology Innovation and Application, 2014(10): 262.
[48] 石庆华, 林嘉鹏, 姚正培, 等. NaCl胁迫对小麦生理生化特征的影响[J]. 新疆农业科学, 2010, 47(7): 1 479-1 484.
SHI Qinghua, LIN Jiapeng, YAO Zhengpei, et al. Effects of NaCl stress on physiological and biochemistry characteristics of wheat[J]. Xinjiang Agricultural Sciences, 2010, 47(7): 1 479-1 484.
Combined Effect of Water and Salt Stress on Growth and Root Hydraulic Conductivity of Ultra-high Yield Wheat Seedling
FU Yuanyuan1,2, SI Zhuanyun2, WANG Xingpeng3, GAO Yang2, LI Qian3,DING Xiaohui2, YANG Na2, ZHAO Shuzhen1*, WAN Sumei1*
(1. College of Agriculture, Tarim University, Alar 843300, China; 2. Key Laboratory of Crop Water Requirement and Regulation, Ministry of Agriculture and Rural Affairs/Institute of Farmland Irrigation, Chinese Academy of Agricultural Sciences, Xinxiang 453002, China; 3. College of Water Resource and Architecture Engineering, Tarim University, Alar 843300, China)
【Background and objective】Drought and soil salinization are two common abiotic stresses facing agricultural production worldwide. Plants develop various strategies to grow under these stresses, and the purpose of this paper is to investigate how winter wheat at seedling stage adjusts the hydraulic conductance of its roots as a response to change in water and salt stresses.【Method】The experiment was conducted in hydroponic culture, using the ultra-high variety Yannong 1212 as the model plant. Water stress was created by polyethylene glycol (PEG) and NaCL was used as a proxy for soil salinization. There were three treatments: 2% of PEG6000, 0.1% of NaCl, and 2% of PEG6000+0.1% NaCl. Wheat grown in Hoagland nutrient solution without abiotic stresses was taken as the control. For each treatment, we measured the root hydraulic conductivity and analyzed its relationship with environmental factors using stepwise regression method. 【Result】① Water stress and salt stress, working alone or in combination, reduced plant height and leaf area significantly, though the level of the significance varied with treatment. ② Compared with the control, water stress and salt stress working alone increased root-shoot ratio by 12% and 14% respectively, while their combination reduced this ratio by 6%; ③ Salt stress and water stress, working separately or in combination, increased Na+/K+ratio in both leaves and roots, despite that the effect of water stress was not significant.④ Water stress and salt stress and their combination significantly reduced total nitrogen content in the leaves, and reduced the root hydraulic conductivity by 58%, 51% and 93%, respectively, compared with the control.【Conclusion】Water and salt stresses reduced root hydraulic conductivity of the wheat at seedling stage, and the leaf area was positively correlated with the root hydraulic conductivity.
water and salt stress; super high yield wheat;K+content; Na+content; root hydraulic conductivity
1672 - 3317(2023)02 - 0016 - 09
S3
A
10.13522/j.cnki.ggps.2022259
付媛媛, 司转运, 王兴鹏, 等. 水盐胁迫对超高产小麦幼苗生长及根系导水率的影响[J]. 灌溉排水学报, 2023, 42(2): 16-23, 31.
FU Yuanyuan, SI Zhuanyun, WANG Xingpeng, et al.Combined Effect of Water and Salt Stress on Growth and Root Hydraulic Conductivity of Ultra-high Yield Wheat Seedling[J]. Journal of Irrigation and Drainage, 2023, 42(2): 16-23, 31.
2022-05-10
财政部和农业农村部国家现代农业产业技术体系项目(CARS-03-19);国家自然科学基金项目(51879267);兵团重大科技计划资助项目(2021AA003)
付媛媛(1993-),女。硕士研究生,主要研究方向为作物栽培与耕作。E-mail: fuyuanyuanfiri@qq.com
万素梅(1968-),女。教授,博士,主要从事作物高产栽培理论与技术、旱区农业资源管理。E-mail: wansumei510@163.com
赵书珍(1970-),女。高级实验师,本科,主要从事作物高产栽培技术、农学专业实践教改。E-mail: 408413108@qq.com
责任编辑:韩 洋
