抗尖孢镰刀菌贝莱斯芽孢杆菌P9培养基及发酵条件优化
2023-03-09张朝正
刘 瑾,张朝正,赵 华
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457)
镰刀菌属(Fusarium),世界十大植物病原真菌之一[2],其中,尖孢镰刀菌(Fusarium oxysporum)是引起150多种植物枯萎病和根腐病的一种土传性病害病原菌,属于半知菌类镰刀菌属真菌[1]。基于尖孢镰刀菌对作物有严重的破坏性,防控尖孢镰刀菌,对植物枯萎病和根腐病的防治具有非常重要的意义[3]。微生物菌剂以安全绿色、抗病抗逆、改善土壤微生态、提高品质和产量的优势成为主要的防治手段[4-7]。目前,应用于生物防治的菌株主要为生防真菌、生防细菌、生防放线菌三大类,例如假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、淡紫拟青霉属(Paecilomyceslilacinus(Thom.)Samson)、丛枝根菌(Arbuscular mycorrhiza)、木霉属(Trichodermaspp.)等。
贝莱斯芽孢杆菌(Bacillus velezensis)是由GARCIA R等新命名的一种生防菌[8-9],其产生的次级代谢产物可以促进植物生长,抑制病原菌,在饲料、医药、食品、植物保护、污水处理和生物防控等领域被广泛研究和应用[10-13]。作为生物防治菌株,贝莱斯芽孢杆菌分泌的某些胶原蛋白类物质与生物膜形成有密切关系,使菌株的拮抗效果更好,植物根际定殖是生防菌株能力的体现[14-17]。目前,已有关于芽孢杆菌发酵条件优化的研究报道,但不同菌株最佳发酵条件存在较大差异。黎燕珊等[18]优化贝莱斯芽孢杆菌(Bacillus velezensis)HC-8的发酵培养基及发酵条件,提高了该菌株的发酵产量,增强对尖孢镰刀菌、烟草疫霉和轮状镰刀菌的拮抗效果。杨可等[19]利用响应面法优化贝莱斯芽孢杆菌TSC001的发酵培养基及发酵条件,提高了发酵液的抑菌活性,增强了对黄瓜灰霉病的拮抗效果。贝莱斯芽孢杆菌的发酵液中除了含有少量的发酵代谢物质外,还含有大量培养杂质,其抑菌活性受到培养基中化合物的种类、比例及发酵培养条件参数的影响。因此,对贝莱斯芽孢杆菌的发酵培养基以及发酵条件的优化决定抑菌活性物质含量的多少,可为其鉴定活性物质及分离提纯提供研究基础。
本研究以对尖孢镰刀菌具有拮抗作用的贝莱斯芽孢杆菌P9为研究对象,以其发酵液的抑菌效果为考察指标,采用单因素试验及响应面法对其培养基配方和发酵条件进行优化,以期为尖孢镰刀菌的绿色防控提供理论依据,为微生物农药的开发提供微生物资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
尖孢镰刀菌(Fusarium oxysporum):天津科技大学菌种保藏中心;贝莱斯芽孢杆菌(Bacillus velezensis)P9:由本实验室提供。
1.1.2 试剂
酵母浸粉、牛肉膏、胰蛋白胨、蛋白胨、氯化钠、葡萄糖、磷酸氢二钾、磷酸二氢钾、硫酸镁、氯化锰、氯化钙、氯化钙、可溶性淀粉、果糖、蔗糖、麦芽糖、大豆蛋白胨、琼脂粉、硫酸铵、硫酸铜、硫酸锌:青岛高科技工业园海博生物技术有限公司。试验所用试剂均为国产分析纯或生化试剂。
1.1.3 培养基
LB液体培养基:酵母浸粉5.0 g/L、蛋白胨10.0 g/L、氯化钠10.0 g/L,pH7.0。LB固体培养基:在LB液体培养基中添加琼脂20.0 g/L,121 ℃灭菌20 min。
基础发酵培养基:葡萄糖5.0 g/L、酵母浸粉5.0 g/L、K2HPO41.4 g/L、KH2PO40.6 g/L、MgSO4·7H2O 0.5 g/L、FeCl20.5 g/L,pH 7.0,115 ℃灭菌30 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
H1815高速离心机:湘仪离心仪器有限公司;HPX-9162MBE电热恒温恒湿培养箱:上海博讯实业有限公司医疗设备厂;SY.45-NJB牛津杯(6 mm×8 mm×10 mm):北京先驱威锋技术开发公司;ME204电子天平:瑞士METTLER TOLEDO公司;DELTA320 pH计:多利斯科学仪器(北京)有限公司;HNY-200B控温摇床:上海智能分析仪器制造有限公司;YS-40A干热灭菌箱:天津天宇机电有限公司。
1.3 方法
1.3.1 贝莱斯芽孢杆菌P9生长曲线的测定
取保藏的贝莱斯芽孢杆菌P9于LB液体培养基中,30 ℃、160 r/min条件下培养36 h得到种子液。将贝莱斯芽孢杆菌P9种子液以3%的接种量接种于LB液体培养基,在30 ℃,160 r/min条件下培养36 h,每隔3 h取样,测定其OD600nm值,绘制贝莱斯芽孢杆菌P9的生长曲线。
1.3.2 贝莱斯芽孢杆菌P9抑菌发酵液及无菌滤液的制备
将贝莱斯芽孢杆菌P9种子液以3%的接种量接种于LB液体培养基,在30 ℃,160 r/min条件下培养72 h后,5 000 r/min离心10 min去除菌体,取上清液过一次性使用无菌滤膜0.22 μm,得无菌发酵滤液。
1.3.3 贝莱斯芽孢杆菌P9抑菌活性的测定
采用牛津杯法测定贝莱斯芽孢杆菌P9发酵液的抑菌活性,在PDA平板活化培养尖孢镰刀菌,30 ℃条件下培养5 d,使其铺满平板,然后将灭菌牛津杯均匀摆放于平板上,吸取200 μL贝莱斯芽孢杆菌P9无菌发酵滤液加入到牛津杯内,30 ℃条件下培养72 h,通过十字交叉法[20]测量抑菌圈直径。
1.3.4 发酵培养基优化单因素试验
固定发酵条件为种子液接种量3%(V/V),30 ℃、160 r/min培养72 h。在基础发酵培养基的基础上,分别对培养基配方的碳源种类(葡萄糖、蔗糖、果糖、可溶性淀粉、麦芽糖)及最佳碳源添加量(0、5 g/L、10 g/L、15 g/L、20 g/L)、氮源种类(牛肉膏、蛋白胨、酵母浸粉、胰蛋白胨、硫酸铵)及最佳氮源添加量(0、5 g/L、10 g/L、15 g/L、20 g/L)、无机盐种类(NaCl、KCl、CaCl2、MnCl2)及无机盐添加量(0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L)[21]进行优化,并测量优化后抑菌圈直径。
1.3.5 发酵培养基优化响应面试验
在单因素试验的基础上,以抑菌圈直径(Y)为响应值,选取3个影响最大的因素可溶性淀粉含量(A)、酵母浸粉含量(B)、氯化锰含量(C),采用Design-Expert10.0.8软件进行Box-Behnken试验设计,确定最佳发酵培养基组成[22-25]。响应面试验设计因素与水平见表1。

表1 发酵培养基优化Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken tests design for fermentation medium optimization
1.3.6 发酵条件的优化
固定基本发酵条件为:初始pH值为7、接种量3%、发酵温度30 ℃、转速160 r/min、发酵时间72 h,以抑菌圈直径为考察指标,分别考察初始pH值(5、6、7、8、9)、接种量(1.5%、3.0%、4.5%、6.0%)、发酵时间(24 h、48 h、72 h、84 h)、转速(80 r/min、160 r/min、240 r/min、320 r/min)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃)对抑菌效果的影响。
2 结果与分析
2.1 贝莱斯芽孢杆菌P9生长曲线的测定
贝莱斯芽孢杆菌P9的生长曲线见图1。由图1可知,Bacillus velezensisP9在培养6 h后进入对数生长期,在培养15 h时,进入稳定期,菌体的OD600nm值达到最大,并基本保持稳定,培养26 h后菌体进入衰亡期,OD600nm值迅速下降。因此,确定贝莱斯芽孢杆菌P9最佳转接时间为9 h。

图1 贝莱斯芽孢杆菌P9的生长曲线Fig.1 Growth curve of Bacillus velezensis P9
2.2 培养基成分优化单因素试验结果
2.2.1 碳源及最佳碳源添加量的确定
碳源对于Bacillus velezensisP9发酵液抑菌性能的影响见图2。

图2 碳源种类(a)及可溶性淀粉添加量(b)对菌株P9发酵液抑菌性能的影响Fig.2 Effect of carbon source types(a)and soluble starch addition(b)on bacteriostatic performance of strain P9 fermentation broth
由图2a可知,不同的碳源对贝莱斯芽孢杆菌P9所产的拮抗物质均有影响,当以蔗糖或果糖作为碳源时,分泌的拮抗物质较少,对尖孢镰刀菌的抑制能力较低;葡萄糖、麦芽糖作为碳源时,抑菌圈直径略有提高;而以可溶性淀粉作为碳源时,抑菌圈直径可达到9.0 mm,究其原因可能是,可溶性淀粉作为迟效碳源,避免了葡萄糖、果糖等单糖作为碳源时所产生的分解代谢阻遏效应[26-28]。因此,确定最佳碳源为可溶性淀粉。由图2b可知,随着可溶性淀粉添加量在0~5 g/L范围内的增加,抑菌圈直径逐渐增加;当可溶性淀粉添加量达到5 g/L时,抑菌圈直径达到最大值,为10 mm;当可溶性淀粉添加量>5 g/L时,抑菌圈直径开始下降。因此,确定最适可溶性淀粉添加量为5 g/L。
2.2.2 氮源及最佳氮源添加量的确定
氮源对于贝莱斯芽孢杆菌P9发酵液抑菌性能的影响见图3。

图3 氮源种类(a)及酵母浸粉添加量(b)对菌株P9发酵液抑菌性能的影响Fig.3 Effect of nitrogen source types(a)and yeast extract addition(b)on bacteriostatic performance of strain P9 fermentation broth
由图3a可知,以硫酸铵为氮源时,菌株P9的OD600nm值较低,所产的拮抗物质极少,抑菌圈直径最小;当以胰蛋白胨、牛肉膏、蛋白胨为氮源时,抑菌圈直径有所增加;酵母浸粉作为氮源时,抑菌圈直径可达最大值,为9.4 mm。因此,确定最适氮源为酵母浸粉。由图3b可知,当酵母浸粉添加量在0~5 g/L范围内增加时,几乎无抑菌圈产生;当酵母浸粉添加量>5 g/L,抑菌圈的直径逐渐增加;当酵母浸粉添加量为15 g/L时,抑菌圈直径达到最大值,为9.3 mm;当酵母浸粉添加量>15 g/L时,抑菌圈直径逐渐减小。因此,确定最适酵母浸粉添加量为15 g/L。
2.2.3 无机盐种类及最佳无机盐添加量的确定
无机盐对于贝莱斯芽孢杆菌P9发酵液抑菌性能的影响见图4。
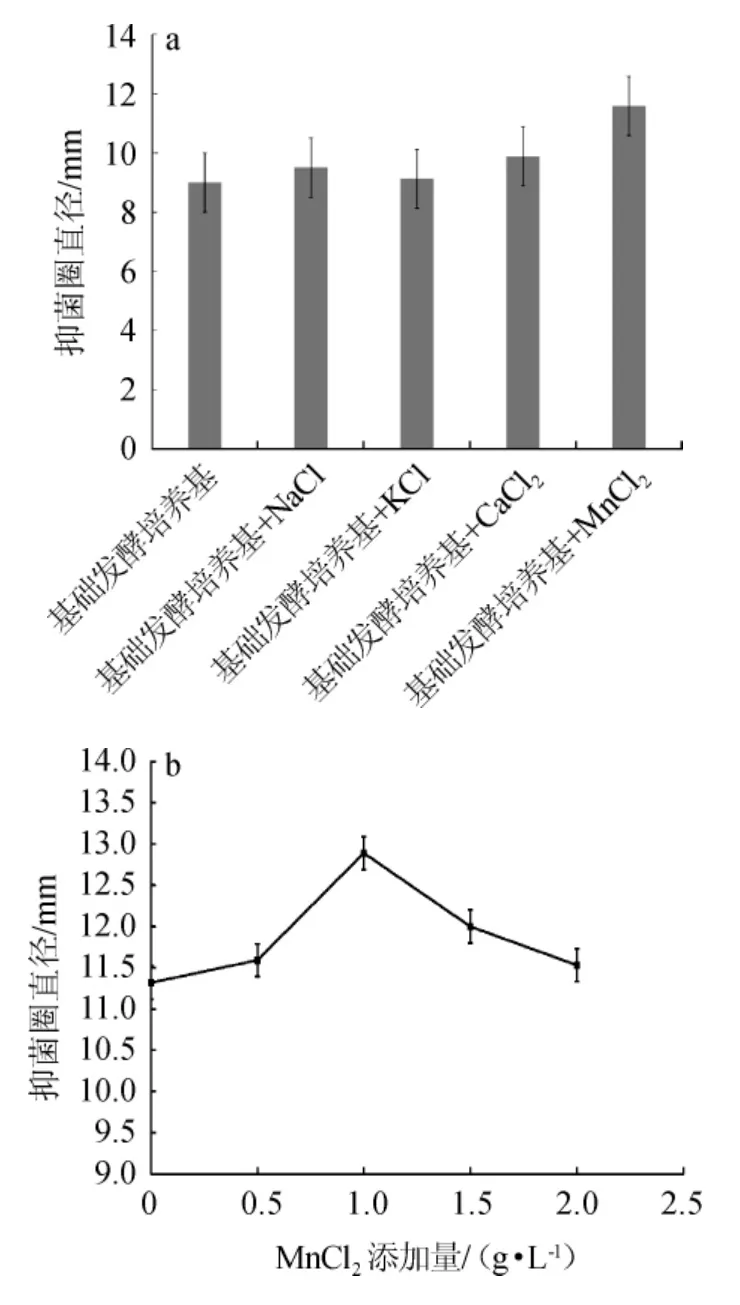
图4 无机盐种类(a)及MnCl2添加量(b)对菌株P9发酵液抑菌性能的影响Fig.4 Effect of inorganic salts types(a) and MnCl2 addition (b) on bacteriostasis of strain P9 fermentation broth
由图4a可知,与基础发酵培养基相比,添加NaCl、KCl、CaCl2、MnCl2均有抑菌效果,但MnCl2在4种无机盐中效果最明显,此时抑菌圈直径达到11.59 mm。由图4b可知,当MnCl2添加量在1.0 g/L范围内增加时,抑菌圈直径逐渐增加,表明MnCl2对菌株分泌拮抗物质具有一定的促进作用;当MnCl2添加量为1.0 g/L时,抑菌圈直径达到最大值,为15.5 mm;当MnCl2添加量>1.0 g/L时,抑菌圈直径逐渐减小,这表明菌株产生的拮抗物质有所抑制。可能是由于低浓度的MnCl2刺激了Bacillus velezensisP9对碳源的利用,使得Bacillus velezensisP9分泌更多的拮抗物质,但是氯化锰添加量过高导致拮抗物质与MnCl2产生反应,拮抗效果逐渐降低[29]。因此,发酵培养基中最佳MnCl2添加量为1.0 g/L。
2.3 发酵培养基成分优化响应面试验
根据单因素试验结果,以抑菌圈直径(Y)为响应值,选取3个对贝莱斯芽孢杆菌P9产拮抗物质影响较大的因素可溶性淀粉含量(A)、酵母浸粉含量(B)、氯化锰(MnCl2)含量(C)进行响应面试验,Box-Behnken试验设计结果见表2,方差分析结果见表3。
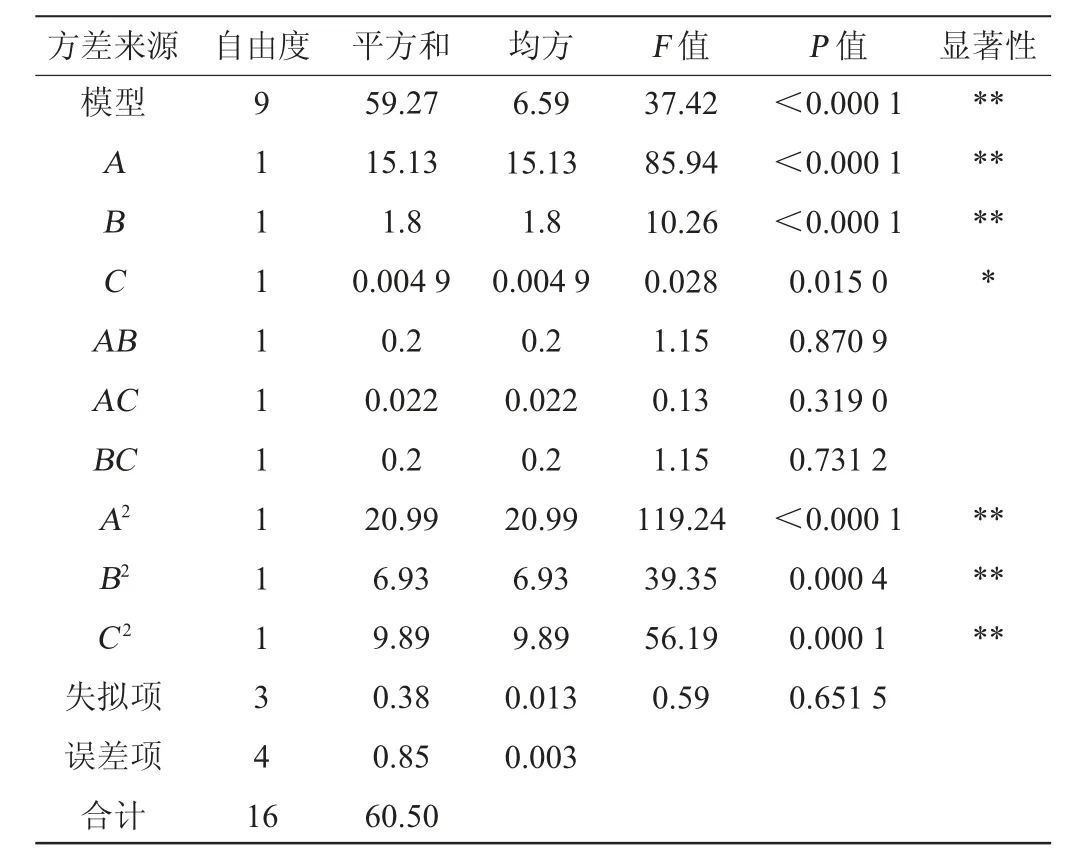
表3 回归模型方差分析Table 3 Variance analysis of regression model
利用Design Expert 10.0.8软件对表2的数据进行多元回归分析,拟合得到的模型二次多项式方程为:

表2 发酵培养基优化Box-Behnken试验设计结果及分析Table 2 Results and analysis of Box-Behnken tests design for fermentation medium optimization
由表3可知,该二次回归模型极显著(P值<0.01),失拟项不显著(P值=0.651 5>0.05),说明所建立的模型拟合度较好,模型的决定系数R2=0.979 6,调整决定系数R2adj=0.953 5,表明95.35%的响应值变化能由该模型解释,变异系数(coefficient of variation,CV)为0.77%,说明试验与模型建立的方程拟合度良好,能用于分析和预测发酵培养基成分优化。由P值可知,一次项A、B、二次项A2、B2、C2对抑菌圈直径影响极显著(P<0.01),一次项C对抑菌圈直径影响显著(P<0.05),其他项影响均不显著(P>0.05)。由F值可知,各因素对抑菌圈直径影响程度为A>B>C。
综合以上试验结果,获得发酵培养基为:可溶性淀粉6.769 g/L,酵母浸粉18.088 g/L,氯化锰0.888 g/L。在此最佳发酵培养基条件下,抑菌圈直径的预测值为12.79 mm。为便于实验操作,修正发酵培养基为:可溶性淀粉6.8 g/L,酵母浸粉18.1 g/L,氯化锰0.89 g/L。在此优化条件下进行验证试验,测得抑菌圈直径实际值为12.43 mm,基本符合模型预测值,说明该模型准确度良好。
2.4 培养条件的优化
不同培养条件对菌株贝莱斯芽孢杆菌P9发酵液抑菌性能的影响见图5。

图5 不同培养条件对菌株P9发酵上清液抑菌活性的影响Fig.5 Effect of different culture conditions on antibacterial performance of strain P9 fermentation supernatant
由图5a可知,随着初始pH值在5~7范围内的升高,抑菌圈直径逐渐增加;当初始pH值为7时,抑菌圈直径达到最大值,为11.9 mm;当初始pH值>7时,抑菌圈直径下降。究其原因可能是,过高或过低的初始pH值均对菌株产拮抗物质有抑制作用,可能是由于过酸或者过碱的环境影响了菌体的生长及其生命活动。因此,确定最佳的初始pH值为7。
由图5b可知,随着接种量在1.5%~4.5%范围内的增加,抑菌圈逐渐增加;当接种量为4.5%时,抑菌圈直径为12.6 mm;当接种量>4.5%时,抑菌圈直径趋于平缓。因此,确定最佳接种量为4.5%。
由图5c可知,随着发酵时间在24~48 h范围内的增加,发酵液中并未产生抑菌圈,可能是因为菌体处于富集阶段,并未产生拮抗物质;随着发酵时间的延长,抑菌圈直径逐渐增加,表明发酵液中的拮抗物质正在逐渐积累;发酵72 h后,抑菌圈直径达到最大值,为14.7 mm,当发酵时间>72 h,抑菌圈直径趋于平稳。因此,确定最佳发酵时间为72 h。
由图5d可知,当转速在80~240 r/min范围内的增加,抑菌圈直径逐渐增加,这是因为转速提高了发酵培养基中的溶氧量,为菌体生命活动提供了充足的氧气;当转速为240 r/min时,抑菌圈直径达到最大值,为14.9 mm;当转速>240 r/min,抑菌圈直径迅速减小,其原因可能是,过高的转速影响了菌体的正常生长及生命活动,从而导致发酵液中拮抗物质逐渐减少。因此,确定最佳转速为240 r/min。
由图5e可知,随着发酵温度在25~30 ℃范围内的增加,抑菌圈直径逐渐增加;当发酵温度为30 ℃时,抑菌圈直径达到最大值,为15.0 mm;当发酵温度>30 ℃,抑菌圈直径逐渐降低。因此,确定最佳发酵温度为30 ℃。
3 结论
本研究以抗尖孢镰刀菌贝莱斯芽孢杆菌P9为试验菌株,其发酵液对尖孢镰刀菌的抑菌效果为考察指标,对菌株P9的培养基及发酵条件进行优化。确定其产拮抗物质最适的发酵培养基为:可溶性淀粉6.8 g/L、酵母浸粉18.1 g/L、MnCl20.89 g/L、FeCl20.5g/L、MgSO4·7H2O 0.5 g/L,K2HPO41.4 g/L,KH2PO40.6 g/L,pH 7.0;最佳发酵条件如下:接种量为4.5%,发酵温度30 ℃,转速240 r/min,发酵时间72 h。在此优化条件下,抑菌圈直径可达到15.0 mm左右,比初始抑菌圈直径(9.0 mm)扩大了1.7倍,为尖孢镰刀菌的生物防治提供理论基础。
