肌红蛋白在加工贮藏过程中结构与功能特性的变化及其对肉制品色泽的影响研究进展
2023-03-09王甜甜朱逸宸廖鲜艳黄俊逸徐宝才
王甜甜,朱逸宸,谢 勇,周 凯,廖鲜艳,黄俊逸,徐宝才,*
(1.上海大学生命科学学院,上海 200444;2.合肥工业大学食品与生物工程学院,安徽 合肥 230601)
我国是世界上最大的肉类生产国,肉品总产量占世界总产量的1/3。国家统计局数据显示,2020年我国肉类产量为7 748万 t[1]。随着生活水平的提高,人们越来越重视肉及肉制品的品质。肉的品质指鲜肉或肉制品的外观及适口性,评价指标主要包括色泽、pH值、系水力、嫩度、多汁性和风味等[2]。其中,肉及肉制品的色泽是消费者在购买产品时判断其品质的主要因素之一,其在一定程度上反映了肉品的安全性和商业价值。有研究报告指出,2019年美国因肉类颜色发暗、失去光泽等问题而造成的损失达30亿美元,全球损失达142亿美元[3]。
畜禽肌肉中蛋白质含量约为18%~20%,是肉中除水分外含量最高的组分,其主要分为盐溶性的肌原纤维蛋白、水溶性的肌浆蛋白以及不溶的基质蛋白[4]。肌红蛋白属于肌浆蛋白,其对肉及肉制品的颜色起着决定性作用。肉色变化的本质是肌红蛋白状态的改变,包括脱氧肌红蛋白(deoxymyoglobin,DeoxyMb)与氧结合形成氧合肌红蛋白(oxymyoglobin,OxyMb),氧合肌红蛋白在空气中氧化成高铁肌红蛋白(metmyoglobin,MetMb)。在肉及肉制品加工贮藏过程中,一些理化因素的改变可能会影响肌红蛋白的结构,肌红蛋白内血红素辅基与珠蛋白结合能力的改变可能会影响血红素辅基中心卟啉铁的价位,从而影响肌红蛋白的氧化还原,继而影响肉及肉制品颜色[5]。研究在加工和贮藏过程中不同处理方式对肌红蛋白结构和功能特性的影响,不仅可以尽量避免肌红蛋白功能特性的破坏,而且还能有目的地对肌红蛋白进行修饰以产生或增强一些特性从而提升肉及肉制品的品质[6]。
本文将介绍肌红蛋白的结构和功能特性,并综述在肉及肉制品加工贮藏过程中影响肌红蛋白结构稳定性和功能特性的物理、化学以及微生物等因素,以及这些因素对肉及肉制品色泽的影响,以期为肉制品的品质控制提供理论和技术支持。
1 肌红蛋白的结构
肌红蛋白是一种由珠蛋白和血红素辅基组成的结合蛋白(图1),主要存在于心肌和骨骼肌中。珠蛋白的分子质量约为17 kDa,包含150 个氨基酸残基,其主链由8 段长短不一的α-螺旋组成。总体呈中空球状结构,极性氨基酸残基几乎全部分布在球状结构表面,使肌红蛋白具有良好的水溶性,而非极性氨基酸残基分布在球状结构内部,形成疏水空穴[7]。在空穴中包埋着1 个由卟啉环和1 个二价铁离子组成的血红素辅基,铁原子位于卟啉环中央。卟啉环平面上的氮原子与铁原子形成4 个配位键,珠蛋白93位组氨酸残基的咪唑环上的N原子与铁原子形成第5个配位键。而铁原子的第6个配位键处于“开放”状态,可与氧气结合,两个保守氨基酸残基(64位的组氨酸与68位的缬氨酸)位于铁原子第6个配位键附近,中间的空隙恰好可容纳一个氧气分子。珠蛋白为血红素提供了一个疏水空穴,避免二价铁被氧化,以保证血红素的氧合能力[8]。
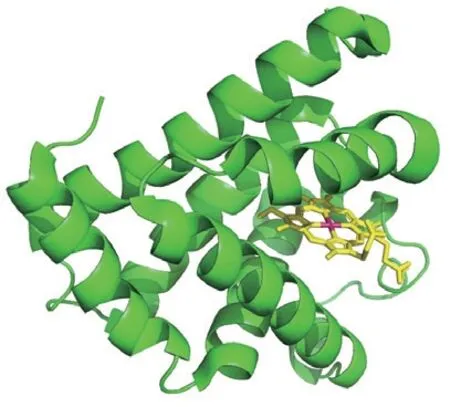
图1 肌红蛋白结构示意图Fig.1 Schematic diagram of the structure of myoglobin
2 肌红蛋白与肉及肉制品色泽的关系
肉及肉制品色泽是衡量肉制品品质的重要指标,也是消费者判断肉制品是否新鲜的重要依据[9]。食用动物在屠宰充分放血后,其肌肉颜色主要受肌红蛋白含量以及其氧化还原的状态相对含量及分布的影响。天然肌红蛋白的氧化还原状态主要有3 种形式:DeoxyMb(紫红色)、OxyMb(鲜红色)、MetMb(棕褐色)[10],且这3 种形式之间可以互相转化。在刚屠宰的肉中,DeoxyMb中心铁离子为二价,血红素辅基第6位配体空缺(图2A),此时肉呈现出紫红色;在空气中暴露一段时间后,铁离子第6 配位与氧气结合(图2B),DeoxyMb逐渐被氧化为OxyMb,此时肉呈现出消费者喜爱的樱桃红色,如图3 中反应1 所示;随着在空气中暴露时间延长或在温度等因素影响下,血红素辅基中的二价铁被氧化成三价铁,此时第6 配位与水分子结合(图2C),OxyMb 被氧化成MetMb,肉色逐渐劣变,形成令人难以接受的灰褐色[11],如图3 中反应2 所示。然而,肌肉中存在还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)-细胞色素B5还原酶系统,其主要机制是NADH-细胞色素B5还原酶在辅因子NADH 和细胞色素B5的参与下将三价铁还原为二价铁,即MetMb 被还原为DeoxyMb[12],如图3 中反应3 所示。一般来说,NADH-细胞色素B5还原酶的还原能力越强,肉色越稳定。有研究表明,存在足量NADH 的条件下,NADH-细胞色素B5还原酶活性得到维持,然而随着底物和辅因子的消耗、宰后肌肉pH 值的下降以及线粒体结构完整性和功能特性的丧失,NADH 含量迅速下降[13]。为了增加宰后肌肉中有限的NADH含量,有学者向肌肉中添加各种三羧酸循环中间产物如丙酮酸盐[14]、苹果酸盐[15]、乳酸盐等[16],这些中间产物能被线粒体和酶体系利用以补充消耗的NADH,用于参与MetMb 的还原[17]。此外,乳酸脱氢酶可以在乳酸和丙酮酸相互转化过程中将NAD+还原为NADH,因此可以通过增加乳酸脱氢酶的活力稳定肉色[18]。DeoxyMb空缺的第6配位还能与CO结合形成亮红色的碳氧肌红蛋白[19],或与NO结合形成亚硝基肌红蛋白,分别如图3中反应4、5所示。
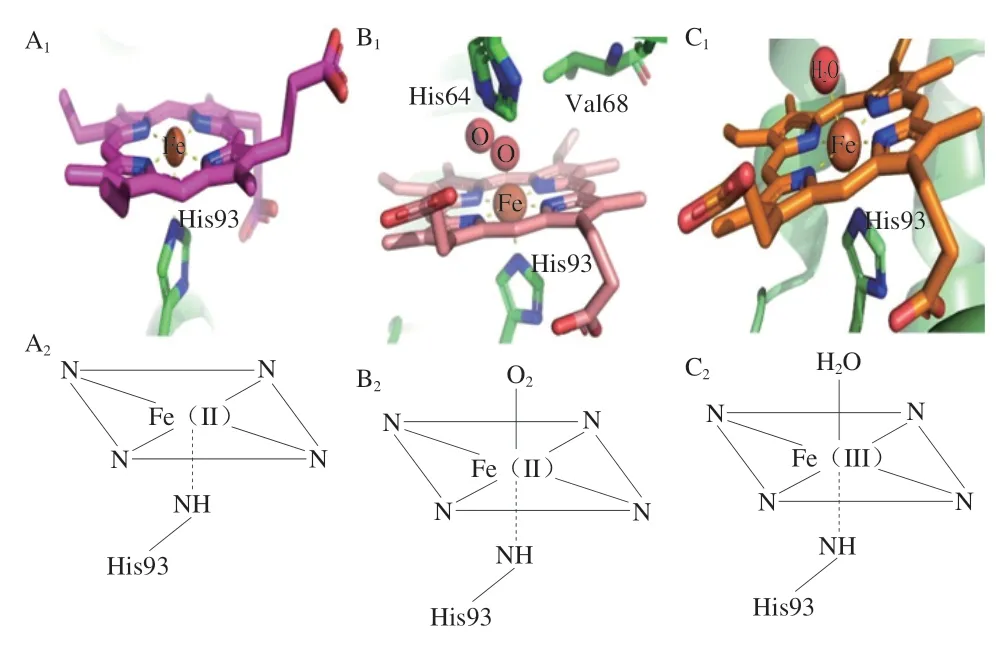
图2 不同状态的肌红蛋白结构示意图及卟啉环平面结构图Fig.2 Schematic diagrams of the structures and planar porphyrin rings of three forms of myoglobin
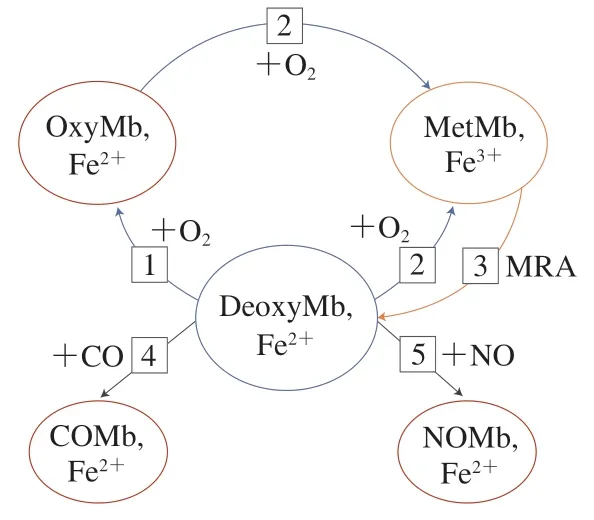
图3 肌红蛋白不同氧化还原状态之间的转化Fig.3 Interconversion of different redox states of myoglobin
肌红蛋白结构十分保守,但是不同物种、同一物种不同品种以及同一动物不同部位的肉色差异较大,这是由于肌红蛋白含量的不同[20]。Ragucci等[21]通过比较麝牛、水牛和黄牛的肌红蛋白结构发现,三者肌红蛋白氨基酸序列具有高度同一性,仅存在部分氨基酸残基的置换,其二级结构具有高度保守性。王丽莎等[22]研究杂交猪种群中猪肉肌红蛋白含量与肉色的相关性,发现肌红蛋白含量较高的猪肉具有更好的肉色,这是由于肌红蛋白含量高的肉类具有较多的I型和IA型纤维,该类型肌纤维比例较高的肌肉具有更好的肉色以及肉色稳定性。
在肉及肉制品加工贮藏过程中,温度、时间、光照、加工手段等因素均会降低肌红蛋白结构稳定性,导致珠蛋白与血红素的结合能力变差,血红素铁被氧化,MetMb逐渐积累,肉色最终变成令人不悦的灰褐色[23]。因此,在肉及肉制品加工贮藏过程中通常会采用物理、化学以及微生物措施以维持肌红蛋白结构稳定性,从而改善肉色劣变的问题。
3 物理因素引起的肌红蛋白结构变化及其对肉制品色泽的影响
3.1 氧分压
从鲜肉切面可以看到与空气接触的肉表层呈现OxyMb的鲜红色,其内部由于氧分压低(<1.4 mmHg)呈现出DeoxyMb的紫红色,表层和下层的中间呈棕褐色[24]。这是由于将鲜肉置于空气中,肉表面与氧气大量接触生成鲜红色的OxyMb,氧气由肉表面逐渐向内部扩散,由于肌肉内部氧气分压较低,肌红蛋白与氧气的结合急剧下降,新合成的OxyMb也会逆向转化为DeoxyMb。随着贮藏时间进一步延长,肉表层和内部的氧分压逐渐提高,肌红蛋白中的Fe2+被氧化成Fe3+,形成MetMb,且氧分压在5~7 mmHg时氧化速率最快,肉色呈现令人不悦的棕褐色[25]。
3.2 温度
大部分肉及肉制品都要经过加热后才能食用,加热会改变肌红蛋白的结构和理化性质,从而影响肉及肉制品的品质。未经腌制的肉在加热后,肌红蛋白中的珠蛋白发生部分变性,珠蛋白与血红素辅基的结合能力降低,此时血红素辅基有可能从疏水空穴中暴露,血红素铁迅速被氧化,生成黄褐色至灰色的MetMb,称为高铁血色原[26-27]。朱姝冉等[28]利用光谱技术分析加热对肌红蛋白结构的影响,结果表明随着加热温度的升高,肌红蛋白的二级结构和三级结构被严重破坏,血红素逐渐解离,且该过程不可逆。王琳可[29]发现,加热初期MetMb比例显著升高,OxyMb比例逐渐减少,随后3 种形式的肌红蛋白比例逐渐达到平衡,其中80 ℃为肌红蛋白状态发生转变的关键温度,95 ℃则为其转化完全达到平衡状态的温度。当肉中添加亚硝酸盐腌制时,肌红蛋白与NO结合生成难以解离且颜色鲜艳的一氧化氮肌红蛋白。当加热时,虽然珠蛋白仍会发生部分变性,但由于NO与血红素难解离,生成一氧化氮肌红蛋白,使肉及肉制品呈现出相对稳定的粉红色。然而在贮存过程中由于光照、温度、pH值等环境因素的作用会导致NO从一氧化氮肌红蛋白上脱离,后者再被氧化为MetMb,导致产品色泽变差,影响其商业价值[30]。
低温贮藏是目前肉及肉制品生产流通销售过程中最常用的保鲜方法。根据贮藏温度不同,低温贮藏可分为冷藏(0~8 ℃)、冰温贮藏(0 ℃至冰点)、超冰温贮藏(冰点至过冷点)和冻藏(≤-18 ℃)[31]。Wang Zhaoming等[32]研究在冷藏((4±1)℃)和超冰温贮藏((-3.5±0.5)℃)条件下兔肉中亚铁肌红蛋白的氧化速率,结果表明,与冷藏相比,超冰温贮藏可以一定程度降低肌红蛋白的氧化速率,这是由于肌红蛋白的自氧化是一级反应,其氧化速率随着贮藏温度的降低而降低。Li Xin等[33]研究不同贮藏温度对羊肉颜色稳定性影响,发现与4 ℃贮藏羊肉相比,在受控冰点(-0.8 ℃)下贮藏10 d羊肉的MetMb还原酶活力以及NADH含量更高,因此表现出更好的颜色稳定性。在实际生产过程中,由于冷链技术不完善,由温度波动引起的肉及肉制品反复冻融的现象时有发生。研究表明,冻融循环会导致肉色劣变,一方面,由于冻融期间肉中冰晶的反复形成破坏了肌细胞结构的完整性,破碎的细胞器释放大量的内源酶(脂肪酶、蛋白酶等)以及促氧化剂等,从而诱导肌红蛋白的氧化,导致MetMb不断生成,加速肉色劣变[34];另一方面,温度波动造成肌肉细胞的机械损伤,导致线粒体通过电子传递链介导MetMb的还原以及通过消耗氧气维持肉色稳定性的途径受阻,因此对MetMb的还原能力下降,导致MetMb的积累,最终影响肉及肉制品的品质[35]。
3.3 光照
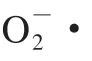
3.4 物理加工
辐照保鲜是一种冷杀菌技术,高能电子束作用于食品原料及包装食品产生的射线和自由基可以杀死微生物和灭活引起食品变质的酶,从而有效延长肉及肉制品的货架期[37]。Nam等[38]使用不同剂量的电子束辐照真空包装火鸡鸡胸肉,发现辐照会产生CO,CO与肌红蛋白空缺的第6位配体结合形成亮红色的COMb,从而赋予火鸡鸡胸肉令人喜爱的颜色。然而也有研究发现,高剂量辐照会促进自由基的产生,将OxyMb氧化为MetMb,还会破坏肌肉中线粒体结构的完整性,进而影响MetMb的还原,从而造成MetMb的积累,导致肉色变差[39]。此外,高剂量辐照会导致肌红蛋白二级结构发生变化,使α-螺旋转化为β-折叠或无规卷曲,导致肌红蛋白结构稳定性下降和血红素辅基的暴露[40]。
超高压技术又称高静水压技术,通过高压影响食品分子的非共价键,破坏微生物的细胞膜,抑制酶活力,达到延长食品货架期的作用[41]。已有研究表明,适当的压力处理有利于肉色的维持,而压力过高时会使肉品颜色变差。Hendrickx等[42]将此现象解释为适当的压力使酶活性中心凝聚,酶与基质接触更充分,MetMb还原酶的活性增强;随着压力升高,酶的结构遭到破坏,MetMb还原酶活性逐渐降低。Carlez等[43]认为,高压导致肉品变色的机制可能有两点:高压导致肌红蛋白变性,铁原子被释放;以及高压使OxyMb氧化为MetMb。马汉军等[44]通过研究不同压力对碎牛肉颜色及肌红蛋白的影响证实了上述结论,发现随着压力的增大,牛肉亮度值逐渐增加,红度值逐渐下降,黄度值基本保持不变;当压力达到400 MPa以上时,MetMb含量急剧上升。此外,加压会破坏肌红蛋白分子内氢键,导致肌红蛋白部分展开,形成一种介于天然蛋白和完全展开状态之间的中间形态,称为熔融小球形态,使肌红蛋白结构稳定性降低[45]。
干燥是肉干生产的关键工艺。谢小雷等[46]从肌红蛋白含量和参与其构成的血红素铁含量两方面研究不同干燥方式对牛肉干色泽的影响,发现与热风干燥相比,中红外-热风组合干燥能够减缓肌红蛋白的氧化,增加OxyMb和血红素铁的含量,降低MetMb含量,使牛肉干具有更好的色泽。
3.5 包装方式
目前常用的肉及肉制品包装方式有气调包装、托盘包装、真空包装和活性包装[47]。气调包装通过改变气体成分与比例对肉及肉制品进行保鲜与护色,常见的填充气体包括O2、CO2、CO、N2。高体积分数的氧气可以将肌红蛋白氧化成OxyMb,赋予肉及肉制品鲜艳的颜色[48]。然而,高氧气调包装可能会导致脂质与蛋白质发生过度氧化,从而对肌红蛋白产生负面影响[49]。因此,目前多采用O2和CO2或N2结合的混合气体填充方式,在保证肉色的同时发挥抑菌效果。CO通过与肌红蛋白结合形成鲜红色的碳氧肌红蛋白从而赋予肉及肉制品鲜艳的颜色[50],但由于CO存在潜在毒性,因此仅有少数国家允许使用。托盘包装操作简单、成本低廉,是目前肉及肉制品销售终端最常见的一种包装方式,但由于肉制品在该包装条件下易发生脂肪和蛋白质氧化,导致肉色稳定性较差,因此货架期较短[51]。真空包装能有效抑制好氧微生物的生长,降低脂肪和蛋白质氧化速率,但抽真空会挤压肉制品,造成严重的汁液流失,且因未接触氧气,肉品多以DeoxyMb的紫红色呈现,导致消费者接受程度较低[52]。活性包装能够将包材内的抗氧化剂、抑菌剂等活性成份释放到肉及肉制品表面,从而达到抑制肌红蛋白氧化、维持肉色、延长保质期的目的,但由于成本高且活性材料的毒性评估难等因素限制了其广泛应用[53]。
4 化学因素引起的肌红蛋白结构变化及其对肉制品色泽的影响
4.1 pH值
在动物死后24~36 h内,肌肉组织中的主要代谢活动是糖酵解,乳酸的不断积累导致pH值下降。研究表明,较低的pH值环境会加速肌红蛋白氧化,这是由于pH值会影响珠蛋白三级结构,特别是血红素周围的局部区域。低pH值时珠蛋白三级结构打开,血红素暴露于环境中导致其稳定性下降,且较低的pH值会加速结合氧的质子化,有利于超氧阴离子的释放[54-55]。Qian Yidan等[56]利用电化学方法研究溶液中pH值诱导肌红蛋白的血红素结构改变,结果表明,在中性条件下血红素基团位于血红蛋白中心,被疏水性氨基酸(如Val 68、Phe 46和Leu 29)和极性组氨酸基团(His 93、His 64和His 97)包围,在酸性(pH 3)或碱性溶液(pH 11)中,由于Fe-His 93的配位键断裂,血红素基团从疏水口袋中解离,使该基团暴露于溶液中,更易受到环境因素的影响。
4.2 硝基化
亚硝酸盐是肉及肉制品加工过程中常用的发色剂。根据GB 2760—2011《食品安全国家标准 食品添加剂使用标准》的规定,肉制品中亚硝酸盐的最高添加量为150 mg/kg。过量添加亚硝酸盐存在致癌风险[57]。亚硝酸盐在肉中的呈色机理分为3 步:首先,亚硝酸盐在酸性条件下形成亚硝酸;然后,亚硝酸不稳定,在腌制过程中与还原物质作用生成NO;最后,NO再与还原性肌红蛋白结合形成亚硝基肌红蛋白(NOMb),从而赋予肉制品鲜艳的红色。具体反应方程如下[58]:NaNO3→NaNO2+2H2O、NaNO2+CH3CHOHCOOH→HNO2+CH3CHOHCOONa、2HNO2→2NO+H2O、NO+Mb→NOMb。
Ma Guoyuan等[59]研究发现低剂量的亚硝酸钠能够减缓氧化导致的肌红蛋白血红素卟啉环的扩张,维持其结构稳定。臧容宇等[60]研究亚硝酸钠在抑制牛肌红蛋白介导的脂质氧化中的作用证实了上述发现,结果表明亚硝酸钠的添加减少了肌红蛋白中非血红素铁的释放和卟啉的降解。然而,肉及肉制品中亚硝酸钠残留的危害作用使研究者寻找其他物质代替亚硝酸盐发色。目前已开发出着色稳定、安全性高,具有抗氧化、抗菌活性的亚硝基血红蛋白替代亚硝酸盐发色,在降低肉及肉制品中亚硝酸钠残留的同时,有效利用禽畜血液资源,减少环境污染[61]。亚硝基血红蛋白是血红蛋白在一定条件下与亚硝酸钠或NO反应的产物,亚硝基血红蛋白分解释放出NO-,肌红蛋白继续与NO-结合生成稳定的亚硝基肌红蛋白,使肉及肉制品呈现良好的色泽[62]。Hammad等[63]通过将亚硝基血红蛋白添加到碎牛肉中,发现与亚硝基血红蛋白混合的牛肉样品比与亚硝酸盐和乳酸菌混合的样品颜色更红,这可能是由于形成了更多的亚硝基肌红蛋白。
4.3 抗氧化剂
外源抗氧化剂不仅可以清除能与肌红蛋白Fe2+发生芬顿反应的过氧化氢,抑制肌红蛋白氧化成MetMb;还可以通过抑制脂质过氧化,降低脂肪酸氧化产生的不饱和醛含量,从而间接维持肌红蛋白中铁离子处于还原状态,减少肉色劣变[64]。多酚可作为自由基清除剂、铁离子螯合剂以及MetMb还原剂用于肉制品护色[65]。Wei Peiyu等[66]将多酚处理后的罗非鱼在-4 ℃条件下冷冻49 d,发现多酚处理减弱了珠蛋白的氢键断裂并延迟了二硫键的形成,维持了冷冻期间珠蛋白结构的稳定,减少了血红素辅基的暴露,抑制二价铁离子的氧化。L-抗坏血酸作为肉制品加工过程中常用的护色剂和助色剂,可以有效抑制肉中脂肪氧化,降低自由基的产生。此外,还可以通过促进MetMb的还原稳定肉色[67]。研究发现,L-抗坏血酸会阻碍亚硝基与仲胺的结合,防止NO转化为NO2,促使肉中粉红色的亚硝基肌红蛋白的产生,从而赋予肉制品鲜艳的颜色[68]。
5 微生物引起的肌红蛋白结构变化及其对肉制品色泽的影响
微生物的繁殖是肉及肉制品在加工贮藏过程中肉色发生变化的又一重要因素。贮藏期间,需氧微生物的繁殖降低了肉表面的氧气分压,促进MetMb的形成[69]。此外,有些细菌会产生硫化氢,与肌红蛋白结合生成硫代肌红蛋白,使肉色发绿[70]。利用有益微生物发酵不仅可以获得风味独特、营养丰富、保质期长的发酵肉制品,而且部分含有亚硝酸盐还原酶的微生物如乳酸菌、葡萄球菌、酵母菌等,在发酵过程中还可以将NO3-转化为NO,NO与肉中的肌红蛋白结合生成亚硝基肌红蛋白,从而达到维持肉色的目的[71-72]。此外,Huang Pan等通过在干香肠中接种凝固酶阴性葡萄球菌,发现该菌种具有一氧化氮合酶活力,可以催化L-精氨酸羟基化生成L-瓜氨酸和NO,NO可与肌红蛋白结合形成颜色鲜红的亚硝基肌红蛋白,从而显著提高干香肠的红度值[73]。
6 结语
肉品经屠宰后充分放血,其肉色主要由肌红蛋白血红素辅基中心的卟啉铁价位和血红素辅基与珠蛋白的结合能力决定。在肉及肉制品加工贮藏过程中,很多因素均可能导致肌红蛋白结构变化,从而影响肉色。随着科技发展,新的加工贮藏技术层出不穷,探究肉中肌红蛋白的结构性质以及功能特性对肉类行业意义重大,可以为保证肉制品的品质提供理论和技术支撑。
