麦麸品种与提取方式对阿拉伯木聚糖结构及抗氧化性的影响
2023-03-09张秀敏周增超乔晋丽王昌禄王玉玲欧行奇郭庆彬
张秀敏,周增超,乔晋丽,王昌禄,王玉玲,欧行奇,*,郭庆彬,*
(1.天津科技大学食品科学与工程学院,天津 300457;2.河南科技学院生命科技学院,河南 新乡 453003)
小麦是我国的主要农作物之一,麦麸是小麦加工的重要副产物,含有蛋白质、碳水化合物、维生素和矿物质等多种营养成分。碳水化合物包括非淀粉多糖和淀粉多糖两种形式,非淀粉多糖约占46%,其中含有约70%的阿拉伯木聚糖(arabinoxylan,AX)[1]。AX作为一种重要的膳食纤维,具有良好的抗氧化性能,这可能是因为氧自由基会进攻生物膜脂质、酶、蛋白质等重要生物大分子,加速机体衰老,造成机体的损伤和病变,而AX能够清除活性氧自由基,从而提高机体的免疫功能;且具有不同分子质量、分支结构及单糖比例的AX对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)的清除作用、还原力等抗氧化效果不同[2-3]。
目前,AX主要通过碱提法获取,但碱提取易破坏阿魏酸等官能团[4],阿魏酸等多酚可提高AX的抗氧化性[5],此外,碱提法对环境污染大。酶法提取技术具有条件温和、绿色无污染、有效保留多酚等优点,因此,可用酶制剂替代碱液制备具有较高多酚含量的AX。木聚糖酶作为细胞壁物质的分解酶,可破坏小麦细胞壁结构,使其降解,从而释放AX;此外,木聚糖酶可以任意攻击AX主链,能够将水不可提取的AX变得可溶和可提取[4];纤维素酶能够消化细胞壁β-葡聚糖并打破AX与β-葡聚糖之间的非共价键从而释放AX[6]。但酶提法存在酶解产物复杂、分离纯化困难等问题。超声作为一种辅助提取方法,与酶法提取联用可以提高AX的得率和纯度。
前人研究发现,不同品种原料来源的多糖结构特征存在差异,例如,甜型和酸型两种不同品种的罗望子果肉多糖的单糖比例不同[7],不同品种苹果原料中果胶的单糖比例及中性糖比率(鼠李糖(rhamnose,Rha)与半乳糖醛酸(galacturonic acid,GalA)含量的比值)存在一定的差异[8]。研究表明,不同小麦品种中AX的结构特征不同,制作的面包品质也参差不齐[9-10]。此外,不同的提取方法会影响AX的得率、纯度、取代度以及分子质量[1]。据报道,不同提取方法能够显著影响血红铆钉菇多糖的单糖组成、分子质量、三螺旋构象及形貌[11]。另外,多糖的提取方法不同会导致其抗氧化性存在差异。例如,热水浸提法、酶解提取法及超声波复合酶法等不同提取方法会对玉木耳多糖[12]、百合多糖[13]、大球盖菇粗多糖[14]、手掌参多糖[15]的抗氧化活性产生不同影响,这可能是不同提取方式造成多糖分子的单糖组成及糖苷键型等结构特征不同[13],也可能与多糖结合多酚含量的不同有关[6]。
总之,虽然目前有关多糖抗氧化性的研究较多,但是多糖具有良好抗氧化性的原因是基于多糖本身还是与多糖相连的酚类化合物尚不明确;且有关不同品种麦麸中AX分子结构的比较以及不同提取方式对AX分子结构和抗氧化性的影响也鲜有报道。基于此,本实验利用碱提、超声辅助木聚糖酶提和超声辅助纤维素酶提3 种方法提取得到AX,对比分析不同提取方法所得AX的抗氧化性能,此外,为了建立AX功能及应用的分子基础,本实验进一步研究麦麸品种与提取方式对AX结构的影响,旨在为麦麸的高值化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
小麦麸皮(品种分别为‘百农207’‘百旱207’‘冠麦1号’‘华育198’和‘华育166’)购于河南中普麦业有限公司。
木聚糖酶(≥2 500 U/g)、Rha、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、甘露糖(mannose,Man)、葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)工作液(均为优级纯) 美国西格玛奥德里齐公司;纤维素酶(10 000 U/g) 北京罗恩试剂有限公司;热稳定α-淀粉酶(800 U/g)、淀粉转葡萄糖苷酶(100 U/mL) 上海源叶生物科技有限公司;BCA蛋白浓度测定试剂盒、透析袋 北京索莱宝科技有限公司;重水(D2O) 萨恩化学技术(上海)有限公司;福林-酚 天津市江天化工试剂公司;过氧化氢为国产色谱纯;其他化学试剂均为国产分析纯。
1.2 仪器与设备
示差高效液相色谱仪 日本岛津公司;IS50傅里叶变换红外光谱仪 美国尼高利公司;6890N气相色谱-质谱联用仪 美国安捷伦科技有限公司;AVANCE NEO核磁共振(nuclear magnetic resonance,NMR)光谱仪布鲁克(北京)科技有限公司;BioSpinQ50热重分析仪 美国TA公司;Infinite 200 PRO酶标仪瑞士Tecan公司;VS-12W氮吹仪 无锡沃信仪器制造有限公司;SB-2512-DTD超声清洗机 宁波新芝生物科技股份有限公司;PB-10型pH计 德国赛多利斯公司;FD-10型真空冷冻干燥机 北京德天佑科技发展有限公司;RE-2000型旋转蒸发仪 上海亚荣生化仪器厂;PIVC2-25plus真空浓缩仪 德国Christ公司;磁力搅拌器美国赛默飞有限公司;LDP-200型高速多功能粉碎机浙江永康市红太阳机电有限公司;DH-104BS型电热恒温鼓风干燥箱 天津市中环实验电炉有限公司;LD-10高速大容量冷冻离心机 长沙湘仪离心机仪器有限公司;Quintix1250-1CN精密天平 美国奥豪斯仪器有限公司。
1.3 方法
1.3.1 AX提取工艺
采用碱提、超声辅助木聚糖酶提和超声辅助纤维素酶提3 种方法从小麦麸皮中提取AX[16-17]。所得样品分别命名为AX-碱、AX-木及AX-纤。
小麦麸皮的预处理:小麦麸皮粉碎后过60 目筛,以料液比1∶10加入去离子水溶解,加入2%(以体系体积计,后同)的耐高温α-淀粉酶(800 U/g),90 ℃持续搅拌3 h,冷却至室温后加入1%的淀粉转葡萄糖苷酶(100 U/mL),55 ℃持续搅拌24 h,煮沸灭酶。离心后沉淀用去离子水冲洗两次,60 ℃过夜烘干。
AX的两种提取方式:碱提法:以料液比1∶10加入0.5 mol/L NaOH溶液,室温搅拌提取24 h;酶提法:在酶添加量(木聚糖酶(≥2 500 U/g)、纤维素酶(10 000 U/g)为5 g/L、温度为40 ℃的条件下超声处理90 min,随后煮沸灭酶。
提取完成后,离心去沉淀,用4 mol/L盐酸溶液调节pH值为4.0,离心去蛋白,以2 倍(碱提)/4 倍(酶提)体积乙醇醇沉,离心得到粗多糖。用去离子水复溶,离心,透析(碱提样品透析袋截留分子质量:8 000~14 000 Da;酶提样品透析袋截留分子质量:3 500 Da)72 h,每8 h换一次水,离心,浓缩冻干。
AX提取得率按式(1)计算。
1.3.2 AX化学组成分析
以Glc为标准品,采用苯酚硫酸法测定中性糖质量分数[18]。以GalA为标准品,采用间羟基联苯法测定糖醛酸质量分数[19]。采用BCA蛋白浓度测定试剂盒测定蛋白质量分数。以没食子酸为标准品,采用福林-酚法测定总酚质量分数[20]。
1.3.3 AX结构表征
1.3.3.1 分子质量的测定
采用高效凝胶排阻色谱法测定AX分子质量[21]。以不同分子质量的葡聚糖为标准品,采用配备有超水凝胶线性柱(7.8 mm×300 mm,10 μm)和折射率检测器的高效液相色谱仪测定AX的分子质量。实验条件:流动相为0.1 mol/L NaNO3溶液,检测温度为40 ℃,流速为0.6 mL/min,采用ASTRA软件采集和分析数据。
1.3.3.2 傅里叶变换红外光谱分析
采用KBr压片法处理样品,利用IS50傅里叶变换红外光谱仪检测其红外吸收光谱[22]。准确称取1.0 mg AX和干燥的150.0 mg KBr粉末混合、研磨均匀、压片,在4 000~400 cm-1范围内记录红外光谱。
1.3.3.3 单糖组成分析
采用部分降解结合气相色谱仪进行单糖组成分析[23]。
酸水解AX样品的制备:将2 mg AX溶于0.5 mL 2 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液中,在120 ℃下水解2 h,用真空冷冻浓缩仪蒸发水解产物至干。加入0.5 mL甲醇,再次蒸干,重复3 次除去多余的酸。
糖腈乙酸酯衍生物的制备:向酸水解、蒸干后的AX样品中加入0.3 mg肌醇(内标)、0.5 mL吡啶和5 mg盐酸羟胺,封口,90 ℃水浴30 min,冷却至室温,加入0.5 mL乙酸酐,90 ℃水浴30 min,冷却后过0.22 μm滤膜,用于气相色谱分析。
糖腈乙酸酯衍生物的检测:采用配备有19091S-433色谱柱(30.0 m×0.25 mm,0.25 μm)的气相色谱仪进行分析。气相色谱条件:流速为1.0 mL/min,进样口温度为250 ℃,检测器温度为280 ℃,进样体积为1.0 μL,氦气、氢气和空气流速分别为25、30、400 mL/min。
取等量各标准单糖(Rha、Ara、Xyl、Man、Glc、Gal),经糖腈乙酸酯衍生化后以同样条件进行气相色谱分析。
1.3.3.4 糖苷键连接方式分析
采用部分降解结合气相色谱-质谱联用仪进行甲基化分析[24]。将3.0 mg AX 80 ℃烘干后溶于0.5 mL二甲基亚砜,加入干燥后的20.0 mg NaOH粉末搅拌2 h,加入0.5 mL碘甲烷搅拌5 h,直至甲基化完全。用二氯甲烷重复萃取3 次,过无水硫酸钠柱,N2吹干,得到甲基化样品。在完全甲基化的样品中加入0.5 mL 4 mol/L TFA溶液,100 ℃水解6 h。冷却、N2吹干。之后加入0.3 mL去离子水、1 滴体积分数5%氨水和3.0 mg硼氘化钠,室温搅拌12 h。反应完全后N2吹干,加入0.5 mL含体积分数5%醋酸的甲醇混合液,N2吹干,重复3 次,加入乙酸酐水浴2 h,N2吹干,最后用二氯甲烷复溶,过0.22 μm滤膜备用。使用6890N气相色谱-质谱联用仪分析样品糖苷键连接方式。
1.3.3.5 AX1H NMR分析
AX在D2O中60 ℃溶解,随后冻干,重复3 次。再将多糖溶于D2O(30 mg/mL)中,利用600 MHz NMR光谱仪对样品进行检测,获得一维核磁共振氢谱图(1H NMR)[25]。1H NMR的数据采集参数为:脉冲程序zg30、时间10.14 min、扫描次数8、循环延迟1 s。
1.3.4 AX热稳定性分析
AX的热稳定性使用热重分析仪进行分析[16]。在热重分析中,根据时间和温度的函数,分析经过加热的AX剩余固体质量。其中氮气(99.99%)为载气,流速为30 mL/min;检测温度从25 ℃升到600 ℃,升温速率为10 ℃/min(采用的麸皮品种为‘百农207’)。
1.3.5 AX抗氧化性分析
参照Ye Zipeng等[26]的方法并作修改。将通过‘百农207’提取的AX配成0.25、0.5、1.0、2.0、3.0、4.0 mg/mL和5.0 mg/mL的水溶液,以VC作为阳性对照,蒸馏水作为空白对照,采用以下指标评价AX的抗氧化性。
总抗氧化能力:采用ABTS阳离子自由基清除法测定AX的总抗氧化能力。将20 μL AX溶液和200 μL ABTS工作液混合均匀,于25 ℃黑暗条件下反应1 h,在734 nm波长处测定吸光度。按式(2)计算总抗氧化能力。
式中:A0为空白对照组的吸光度;A1为AX待测液组或阳性对照组的吸光度;A2为磷酸盐缓冲液(0.01 mol/L,pH 7.2~7.4)代替ABTS溶液作为试剂空白的吸光度。
还原力:将50 μL AX溶液、50 μL 0.01 mol/L的磷酸盐缓冲液(pH 7.2~7.4)和50 μL质量分数为1%的铁氰化钾溶液混合均匀,于50 ℃反应20 min,冰浴冷却5 min,再加50 μL质量分数为10%的三氯乙酸和30 μL质量分数为0.1%的三氯化铁溶液,在700 nm波长处测定吸光度。按式(3)计算还原力。
式中:A0为空白对照组的吸光度;A1为AX待测液组或阳性对照组的吸光度。
DPPH自由基清除率:将50 μL AX溶液和200 μL 0.4 mmol/L DPPH溶液混合均匀,于25 ℃黑暗条件下反应30 min,在517 nm波长处测定吸光度。按式(4)计算DPPH自由基清除率。
式中:A0为空白对照组的吸光度;A1为AX待测液组或阳性对照组的吸光度;A2为甲醇代替DPPH溶液作为试剂空白的吸光度。
式中:A0为空白对照组的吸光度;A1为AX待测液组或阳性对照组的吸光度;A2为Tris-HCl溶液代替邻苯三酚溶液作为试剂空白的吸光度。
·OH清除率:将50 μL AX待测液和50 μL 9 mmol/L硫酸亚铁溶液、50 μL 9 mmol/L水杨酸-乙醇溶液混合均匀,加入50 μL 8.8 mmol/L过氧化氢溶液启动反应,于37 ℃反应1 h,在510 nm波长处测定溶液的吸光度。按式(6)计算·OH清除率。
式中:A0为空白对照组的吸光度;A1为AX待测液组或阳性对照组的吸光度;A2为水杨酸-乙醇溶液代替硫酸亚铁溶液作为试剂空白的吸光度。
1.4 数据处理与分析
所有实验均重复3 次,结果用平均值±标准差表示。运用SPSS软件进行单因素方差分析,P<0.05表示差异显著,结果具有统计学意义。
2 结果与分析
2.1 AX化学组成分析结果
利用不同方法从不同品种麸皮中提取得到的AX得率及化学组成测定结果如表1所示。本实验所用提取方法主要获得水不可提取性AX,在除淀粉的过程中除去了水可提取性AX[16],因此AX的得率低于其他报道[4]。相比于酶提法(超声辅助木聚糖酶提法得率:1.24%;超声辅助纤维素酶提法得率:0.21%),碱提法AX得率更高(3%左右),这可能是由于稀碱溶液中的羟基离子能破坏纤维素与半纤维素之间的氢键和酯键,且在碱性条件下,醛酸以阴离子的形式存在,导致AX之间互相排斥[1]。而酶的生物活性受反应时间、温度和pH值等影响,这导致其提取率低于碱提法。酶提法中,相比于纤维素酶,木聚糖酶对AX的提取率更高,可能是由于木聚糖酶可以打破木聚糖主链,随机断裂主链上的β-1,4-糖苷键,导致在水解水可提取性AX时,产生阿拉伯糖单/双取代或未取代的低聚木糖;在水解水不可提取性AX时,将其转化为水可提取性AX,使其分子质量降低,溶解度增加,从而提高得率[1]。

表1 不同方法提取AXs的化学组成和得率Table 1 Compositions and yields of AXs extracted by different methods
化学组成分析结果表明,利用碱法提取得到的5 个品种AX总糖质量分数均约为63%,几乎无差异,蛋白质量分数略有不同,糖醛酸质量分数无明显差异。酶法提取AX总糖质量分数略低于碱提AX,其中,AX-木(57.5%)高于AX-纤(49.4%)。蛋白质通过酰胺键与AX发生化学结合,碱提AX的蛋白质量分数低于酶提AX,这与Zhou Sumei等[4]的研究结果一致。阿魏酸通过酯键与AX发生化学结合,除分子质量和多糖取代度外,多酚含量对AX的功能特性也有较大影响,酶提AX总酚质量分数高于碱提AX,且AX-纤(2.7%)高于AX-木(2.1%)。总之,不同的提取方法各有优劣,并且由于所用酶及原料不同,提取得率也不同[6]。
2.2 AX分子质量分析结果
多糖的性质与其分子质量大小、分子质量分布及其分子结构密切相关。利用不同方法从不同品种麸皮中提取得到的AX分子质量如表2所示。碱提AX分子质量较大,为700 kDa左右,酶提AX分子质量较低。Xyl通过β-1,4糖苷键连接形成木聚糖,构成AX的骨架,Ara作为侧链连接在骨架上。酶作用于木聚糖骨架上任意位置的β-1,4-D-呋喃木糖键,从而得到分子质量不一的片段。因此,与碱提AX相比,酶提AX的分子质量较低,这说明酶法提取破坏了AX分子结构,而AX-木和AX-纤的分子质量减小程度不同,则说明不同种类酶的降解能力不同[27]。

表2 不同方法提取AXs的分子质量Table 2 Molecular masses of AXs extracted by different methods
2.3 AX红外光谱分析结果
傅里叶变换红外光谱是多糖结构表征常用的手段之一[28]。AX的官能团组成如图1所示,3 423 cm-1和2 924 cm-1处的宽吸收峰分别归因于—OH拉伸振动和—CH2中C—H的对称拉伸振动,1 654 cm-1处的吸收峰是由—COO-的不对称拉伸振动引起的[29],可能与AX中含有少量的糖醛酸有关。1 042 cm-1左右处的吸收峰归因于C—C、C—O或者C—O—H的弯曲振动[28],该信号反映了聚糖主链上分支数量的变化。
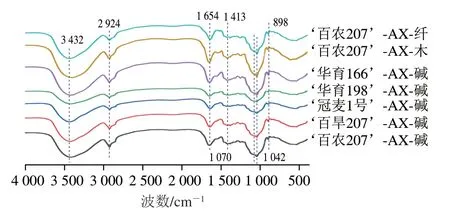
图1 不同方法提取AXs的傅里叶变换红外光谱Fig.1 Fourier transform infrared spectroscopy (FTIR) of AXs extracted by different methods
1 413 cm-1处的吸收峰是由C—C、C—O和C—O—H的弯曲振动引起的[28],该区域的吸收峰强度因取代量的不同而发生变化。随着取代度的增加,该区域的吸收峰强度降低(伴随着峰多重性的损失)。AX的红外光谱表明木聚糖残基的C3位有很高的Ara取代度(在898 cm-1和1 070 cm-1处的吸收峰),在1 100~1 000 cm-1区域中发生峰多重性的损失,是高度取代AX的特征。不同品种麸皮碱提AX以及3 种方法提取AX的红外光谱相似。
2.4 AX单糖组成分析结果
AX的单糖组成如图2所示,混标组成从左到右依次为Rha、Ara、Xyl、Man、Glc和Gal。AX主要由Ara和Xyl两种单糖组成的,还含有少量的Man、Glc和Gal。Gal可能来自半乳糖阿拉伯木聚糖或阿拉伯半乳糖,Man可能来自在各种谷物细胞壁中发现的葡甘聚糖,Glc可能来自β-葡聚糖和部分未水解淀粉[28]。与碱提AX相比,采用酶法提取的AX各单糖组分比例变化较大[27],这与胡叶碧等[30]的研究结果一致,可能是因为酶将膳食纤维中的不溶性成分降解为可溶性物质,在增加可溶性膳食纤维的同时也明显改变了其单糖组成。

图2 AXs的单糖组成分析气相色谱图Fig.2 Gas chromatograms for monosaccharide composition analysis of AXs
木聚糖主链上Ara残基的取代程度和分布非常重要,它们可以影响AX内部相互作用及与细胞壁和其他组分的相互作用,从而使这些大分子的理化和功能性质发生变化[28]。因此,木聚糖主链的平均取代度是评价AX结构特点的一个重要指标。Ara/Xyl值(Ara与Xyl物质的量分数比)能够反映AX的支链化程度,比值越大表明支链化程度越高[31]。根据峰面积比计算各单糖组分的物质的量分数,结果如表3所示。麸皮经碱提后所得AX的Ara/Xyl值由高到低依次为‘百农207’>‘冠麦1号’>‘华育198’>‘百旱207’>‘华育166’。可以看出,不同品种麸皮碱提所得AX在主链上的取代方式存在一定的差异[27-28],但均具有高度分支的结构。另外,AX-木和AX-纤的Ara/Xyl值分别为1.36和0.93,差异较大,且与碱提方法所得AX不同,这可能是由于纤维素酶会破坏Ara和Xyl主链的连接,此外,李凡等[1]报道,对麦麸进行脱淀粉处理,再用内木聚糖酶处理AX的Ara/Xyl值(0.83)比仅用脱淀粉处理AX的Ara/Xyl值(0.54)高,表明木聚糖酶优先作用于取代度较低的木聚糖片段,与本研究结果一致。类似地,Aguedo等[32]证明,酶辅助提取、热提取和碱提取的AX的Ara/Xyl值不同。

表3 不同方法提取AXs的单糖组成Table 3 Monosaccharide compositions of AXs extracted by different methods
2.5 AX甲基化分析结果
AX的甲基化分析结果如表4所示,AX主要由Xylp和Araf组成[16],其结果与单糖组成的测定结果一致。Xyl残基主要包括T-Xylp、4-Xylp、2,4-Xylp、3,4-Xylp和2,3,4-Xylp,Ara残基主要包括T-Araf、3-Araf和5-Araf。碱法提取AX的4-β-D-xylan主链含有未取代的Xylp、在O2/3位单取代的Xylp以及在O2和O3位双取代的Xylp。相比碱提AX,超声辅助木聚糖酶和超声辅助纤维素酶提取AX主链在O2位单取代的Xylp数量均非常少,超声辅助木聚糖酶提取AX主链不含在O2和O3位双取代的Xylp。Ara主要以末端形式附着在木聚糖主链上。同样,T-D-Xylp可能为D-Xylp主链的非还原性末端,作为单侧链连接在D-Xylp主链的O2/3位置,或者连接在支链L-Araf单元的O3/5位。阿魏酸可能连接在L-Araf单元的O5位[33]。总之,3 种方法从小麦麸皮中提取得到的AX糖苷键连接方式存在差异,碱提不同品种麸皮AX的糖苷键连接方式没有明显差异。

表4 不同方法提取AXs的连接方式Table 4 Types of glycosidic linkage in AXs extracted by different methods
2.6 AX 1H NMR分析结果
如图3所示,AX的异头区可分为两部分:δ5.5~5.0的信号归因于末端Ara残基在Xyl残基的C-(O)-3位单取代以及在C-(O)-2和C-(O)-3位双取代,δ4.2~4.5的信号归因于未取代、单取代和双取代的β-D-Xylp残基[21]。δ6.0~8.0的信号为阿魏酸的质子信号峰[34],通过对AX局部放大,δ6.0~8.0的信号强度较高,再次印证了超声辅助木聚糖酶和超声辅助纤维素酶提取AX能够更大程度地保留阿魏酸。

图3 AXs的1H NMR谱图Fig.3 1H nuclear magnetic resonance (NMR) spectra of AXs
2.7 AX热稳定性分析结果
AX的热降解特性可通过热重曲线分析,如图4所示,AX主要有3 个热降解阶段。第一个热降解阶段是20~120 ℃,质量损失约为7%,50 ℃左右出现了一个明显的质量损失峰,可能是由于样品失水造成的,且主要是AX中的结合水。第二个热降解阶段为200~400 ℃,质量损失约为50%,质量损失峰大约在280 ℃左右,此温度区间的质量损失加快,说明AX在此升温过程中化学结构发生降解[35]。第三个热降解阶段为400~600 ℃,质量损失约为30%,可能是由于碳化导致的。此外,在热重曲线中能够观察到不同提取方法AX热稳定性的差异。AX-碱、AX-木及AX-纤的最大热分解速率分别出现在282.26、275.90 ℃和273.31 ℃,可知AX-碱的热稳定性较好。

图4 不同方法提取AXs的热重曲线Fig.4 Thermogravimetric curves of AXs extracted by different methods
在食品加工过程中经常用到热处理,温度的控制则显得尤为重要,温度过低,达不到预期效果,温度过高,则可能造成某些物质分解,影响有效成分含量、产品品质及产生有害物质等。了解多糖的热稳定性可为其热加工处理提供参考。
2.8 AX抗氧化性分析结果
2.8.1 AX的总抗氧化能力
如图5A所示,在AX质量浓度0.25~2.00 mg/mL之间,随着样品质量浓度的增加,AX的总抗氧化能力明显增强,当质量浓度大于2 mg/mL时,AX-木和AX-纤的总抗氧化能力增加不明显,而质量浓度大于4 mg/mL时,AX-碱的总抗氧化能力增长缓慢。当质量浓度为0.25~4.00 mg/mL时,AX-木和AX-纤的总抗氧化能力无明显差异,但明显高于AX-碱,说明酶提AX的总抗氧化能力优于碱提AX。当质量浓度为5 mg/mL时,AX-木、AX-纤和AX-碱的总抗氧化能力分别为99.78%、99.73%、100.00%,其半抑制浓度(halfmaximal inhibitory concentration,IC50)分别为0.526、0.565、1.016 mg/mL,说明各AX均有较强的总抗氧化能力。
2.8.2 AX的还原力
生物体内存在游离金属离子,如铁离子,利用抗氧化剂能够将Fe3+还原成Fe2+从而测定抗氧化剂的还原力,还原能力愈强,其抗氧化活性愈高[36]。如图5B所示,AX质量浓度为0.25~5.00 mg/mL时,AX的还原力随着样品质量浓度的增加呈现上升趋势,当质量浓度为5 mg/mL时,AX-木、AX-纤和AX-碱的还原力分别为88.16%、79.40%、40.56%。AX-木和AX-纤的还原力相当,且高于AX-碱,这可能是由于AX-木和AX-纤的平均分子质量相对较小,另外,具有较强还原力的AX-木Ara/Xyl值较高(Ara/Xyl=1.36),因此,AX的还原能力也可能受其Ara/Xyl和Xyl残基取代度的影响[3]。
2.8.3 AX的DPPH自由基清除率
DPPH自由基是一种稳定的有机自由基,广泛用于体外抗氧化实验中,样品DPPH自由基的清除能力可反映其抗氧化活性[2]。如图5C所示,AX对DPPH自由基的清除效果呈量效关系。AX质量浓度为0.5~5.0 mg/mL时,随质量浓度的增加,对DPPH自由基清除率呈现上升趋势。在0~3.68 mg/mL之间,AX-纤对DPPH自由基清除率高于AX-木,在3.68~5.00 mg/mL之间,AX-木对DPPH自由基清除率高于AX-纤,但酶提AX的DPPH自由基清除率始终高于碱提AX。这可能是酶提AX的多酚含量较高,阿魏酸中含有酚羟基,为DPPH自由基提供了H+,形成了DPPH-H,使得DPPH自由基含量降低[37]。另外,AX-木DPPH自由基的清除能力最强,这可能是由于其平均分子质量较小且具有较高的分支结构(Ara/Xyl=1.36)[38]。当质量浓度为5 mg/mL时,AX-木、AX-纤和AX-碱的DPPH自由基清除率分别为45.28%、41.92%、19.50%,说明各AX均有较强的DPPH自由基清除能力。
2.8.5 AX的·OH清除率
·OH是氧化性最强的活性氧自由基,通过测定AX对·OH的清除能力能够评价其抗氧化性[2]。生物体内存在游离金属离子,如铁离子,能够催化H2O2生成·OH,导致相邻分子损伤,而抗氧化剂能够络合Fe3+,减少·OH的产生[3]。如图5E所示,AX对·OH的清除率随其质量浓度的增加整体呈现上升的趋势,AX质量浓度为0~5 mg/mL时,AX对·OH的清除率依次为AX-碱>AX-纤>AX-木。AX-木和AX-纤对·OH的清除作用较低,原因可能在于其杂质(蛋白质16.84%、15.79%)的干扰,影响了吸光度测定,导致吸光度偏大,清除率偏低[3]。
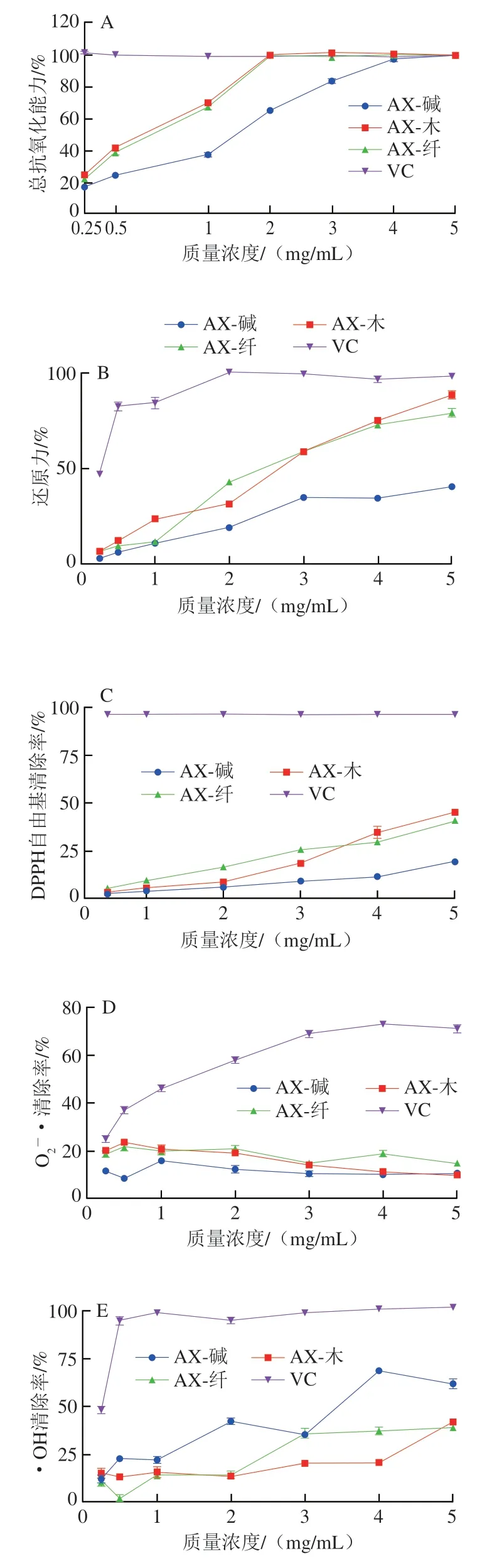
图5 AXs的总抗氧化能力(A)、还原力(B)、DPPH自由基清除能力(C)、清除能力(D)、·OH清除能力(E)Fig.5 Total antioxidant capacity (A),reducing capacity (B),1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity (C),superoxide anion radical scavenging capacity (D),and hydroxyl radical scavenging capacity (E) of AXs
3 讨论
本研究分别利用碱提、超声辅助木聚糖酶和超声辅助纤维素酶3 种方法从不同品种小麦麸皮中提取AX,并测定其化学组成、分子结构、热稳定性及抗氧化性等指标。结果表明,不同品种麸皮AX的分子质量不同,且各单糖组分比例变化较大,糖苷键连接方式及比例也存在不同,这与牟振坤[40]、Wang Libo[41]等的研究结果一致。与碱提法相比,超声辅助酶法提取的AX多酚含量明显更高,He Hongju等[33]也报道了酶法提取能更大程度地保留多酚,而总酚含量是影响AX抗氧化活性的重要因素,本研究也表明AX-木与AX-纤的抗氧化活性高于AX-碱,此外,Snelders等[42]证明,多酚存在的形式极大地影响AX抗氧化能力,且多酚与AX非共价结合的抗氧化能力强于共价结合。此外,多糖的结构差异也可能是导致抗氧化能力不同的原因[43],黄玉龙等[13]报道了不同提取方式造成多糖分子的单糖组成及糖苷键型不同从而使多糖的抗氧化活性存在差异。酶提AX单糖组分比例较碱提差别很大,Aguedo等[32]也有类似报道。另外,本研究发现酶提AX分子质量更低,糖苷键连接方式更复杂,但得率和总糖含量较低。进一步对比两种酶提方法,超声辅助木聚糖酶提AX得率更高,且总糖含量更高,而超声辅助纤维素酶提AX多酚含量更高,二者单糖比例及糖苷键连接方式也不同,但二者抗氧化活性差异并不明显,其具体机制仍需进一步研究。
