CaCl2电解水处理提高绿豆芽品质及其机理
2023-03-09张馨丹薛文通刘海杰
张馨丹,李 翠,薛文通,刘海杰*
(中国农业大学食品科学与营养工程学院,北京 100083)
绿豆富含多种营养活性物质,包括蛋白质、碳水化合物、脂类、氨基酸、酚类、矿质元素等[1]。绿豆发芽后得到绿豆芽,大量研究已经证明绿豆经过萌发后,其VC、酚类物质、膳食纤维、γ-氨基丁酸、矿质元素等的含量大幅度提高,同时植酸、蛋白酶抑制剂等抗营养物质含量明显降低[2-4]。我国绿豆芽消费需求量巨大,据估算,每人年消费芽菜18.25 kg(每人每天 50 g),按全国14亿人口计,芽菜年需求量达2 555万 t[5]。然而,由于其含水量高,质地脆弱极易受到损伤而引起品质劣变,从而影响货架期。在常温下一般只可保存1~2 d,在低温冷藏条件下也只有3~5 d,生产和销售受到一定制约[6]。
电解水是在电解槽中通过电解含有稀盐酸(HCl)或食盐(NaCl)的溶液而得到的,在食品工业中得到了广泛的应用[7]。其不仅可以实现对果蔬的消毒杀菌[8]、促进活性成分积累[9],同时大量的研究表明电解水可以通过抑制褐变、降低呼吸强度和乙烯产生、抑制细胞壁降解、清除活性氧积累等实现对果蔬的采后保鲜[10]。钙作为植物生长重要的信号分子和调节物质,其可以维持细胞膜的完整性,增强细胞壁的结构及与细胞间的黏结作用,调节体内各种酶的代谢过程及活性等达到延缓衰老、维持果蔬品质的目的[11],其中氯化钙(CaCl2)是果蔬保鲜常用的钙盐。绿豆芽不仅保鲜期短,同时已被确定为食源性疾病发生的一个重要风险因素[12],因此需要采取一定的处理手段来延长货架期、提高食用安全性。目前关于CaCl2电解水(CaCl2electrolyzed water,CEW)应用的相关报道还比较少。因此,本研究探讨CEW处理对绿豆芽采收后贮藏期间品质的影响,并对作用机理进行探讨,旨在为绿豆芽的贮藏保鲜提供参考和依据。
1 材料与方法
1.1 材料与试剂
实验所用的绿豆品种‘草原巨峰’绿豆购自北京市海淀区圣熙8号美廉美超市。
三氯乙酸、硫代巴比妥酸、碘化钾、邻苯二酚、硼酸、四硼酸钠、无水碳酸钠 上海麦克林生化科技有限公司;无水碳酸钠、磷酸氢二钠、磷酸二氢钠国药集团化学试剂有限公司;福林-酚、亚硝酸钠、氯化铝、愈创木酚、L-苯丙氨酸、交联聚乙烯吡咯烷酮、TritonX-100 北京索莱宝科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
WS150III恒温恒湿培养箱 上海树立仪器仪表有限公司;电解水生成器 实验室自制;RC-3F有效氯测定仪 日本笠原理化工业株式会社;pH测定仪上海佑科仪器仪表有限公司公司;UV-1600紫外-可见分光光度计 日本岛津公司;CT3质构仪 Brookfield(中国)有限公司;低场核磁共振成像仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 绿豆芽生产与贮藏
CEW制备:首先配制25 mmol/L的CaCl2溶液,在电解之前用浓盐酸调节pH值为4.4±0.05,之后倒入无隔膜电解槽中,接通电源,以恒定电流3.0 A电解,通过调节电解时间,控制电解水有效氯浓度为10 mg/L(用有效氯测定仪测定)。之后再次用浓盐酸调节pH值至5.50±0.05,得到CaCl2电解水,记作25CaE10。
绿豆萌发:挑选籽粒饱满、无虫害的绿豆种子,自来水冲洗干净,用5 倍籽粒体积的CEW于室温黑暗条件下浸种5 h,自来水组作为对照。浸种完毕后,将种子单层平铺于覆有纱布的发芽盒中,置于25 ℃、相对湿度85%的恒温恒湿培养箱黑暗培养,期间每天喷淋3 次保持种子湿润,具体流程如图1所示。4 d后收获豆芽,沥干表面水分,装入保鲜袋中4 ℃低温贮藏,并于贮藏第0、1、3、5天取绿豆芽鲜样测定采后各生理指标。

图1 CEW处理生产绿豆芽示意图Fig.1 Schematic diagram of the application of CEW processing to produce mung bean sprouts
1.3.2 绿豆芽指标测定
1.3.2.1 绿豆芽质量损失率的测定
在贮藏前测定每份绿豆芽的质量,在贮藏过程中取样时再次测定每份绿豆芽的质量。结果取3 次测量的平均值。质量损失率计算公式如下。
1.3.2.2 绿豆芽相对电导率的测定
参照Wang Lei等[13]的方法测定,采用简易浸泡法。
1.3.2.3 绿豆芽硬度、脆度的测定
采用CT3质构仪测定绿豆芽下胚轴的硬度及脆度,利用标准探头TA44(4 mm DIAM、35 mm LONG)进行50%形变压缩实验。探头速率为0.5 mm/s,触发点负载6.8 g。测定部位为距下胚轴基部2 cm处。
1.3.2.4 绿豆芽菌落总数的测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[14]测定绿豆芽菌落总数。
1.3.2.5 绿豆芽丙二醛、过氧化氢含量的测定
采用硫代巴比妥酸法[15]测定丙二醛(malondialdehyde,MDA)含量;采用碘化钾法[15]测定过氧化氢(H2O2)含量。
1.3.2.6 绿豆芽总酚含量的测定
采用福林-酚法[16]测定总酚含量,结果以每克样品所含没食子酸质量计,单位为mg/gmf。
1.3.2.7 绿豆芽褐变指数的测定
参照Sikora等[17]的方法测定绿豆芽褐变指数。取绿豆芽鲜样,黑暗放置5 min,充分吸净表面水分。取下胚轴中段2 g,加入8 mL蒸馏水,冰浴研磨成匀浆,4 ℃、6 000 r/min离心15 min后取上清测定波长420 nm下的吸光度,最终以10×OD420nm表示褐变指数。
1.3.2.8 绿豆芽水分状态的测定
利用低场核磁共振仪分析软件中的FID脉冲序列寻找磁场的中心频率及硬脉冲宽,利用硬脉冲回波序列CPMG采集不同贮藏时间绿豆芽的横向弛豫时间T2图谱。测定参数为:时间点数据722 434、射频延时0.08 ms、模拟增益20 db、重复采样等待时间5 000 ms、回波时间0.3 ms、回波个数1 2000和重复采样次数16。将采集生成的自旋回波信号导入核磁共振反演拟合软件各自反演,反演方法为SIRT。
1.3.2.9 绿豆芽褐变相关酶活力的测定
采用邻苯二酚法[18]测定多酚氧化酶(polyphenol oxidase,PPO)活力;采用愈创木酚法[15]测定过氧化物酶(peroxidase,POD)活力;参照张礼良等[19]的方法测定苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)活力。
1.4 数据处理与分析
所有实验均进行3 次重复,数据表示为平均值±标准差,利用Excel软件分析数据,SPSS 26软件进行单因素方差分析,利用Duncan多重比较分析数据显著性差异,显著水平为P<0.05,使用Origin和Excel软件制图。
2 结果与分析
2.1 贮藏过程中绿豆芽质量损失率、相对电导率以及代谢物MDA、H2O2含量的变化
从图2可以看出,在贮藏过程中,自来水对照组和25CaE10处理组绿豆芽的质量损失率、相对电导率、MDA以及H2O2含量变化趋势一致,均表现为逐渐增加,除了贮藏1 d时的质量损失率,25CaE10处理组的其余相关指标数值始终低于对照组。在贮藏1 d时,绿豆芽均还处于较新鲜的状态,失水较少,细胞膜较完整,H2O2还未开始积累,氧化损伤较轻;贮藏3 d时,质量损失率、相对电导率、MDA含量以及H2O2含量均有所提高,其中,质量损失率有较为明显的提高,但处理组与对照组之间不存在显著差异(P>0.05);贮藏5 d时,对照组与处理组的各指标数值进一步增加,其中,对照组的质量损失率由8.59%升高到20.66%,增加约1.41 倍,水分流失严重,而25CaE10处理组质量损失率(10.36%)明显低于自来水对照组,降低了约49.9%,并且存在显著差异(P<0.05);而贮藏5 d时对照组、25CaE10处理组的相对电导率分别为26.64%、22.24%,降低约16.5%;同时,25CaE10处理组的MDA、H2O2含量分别为2.243 nmol/gmf、192.176 nmol/gmf,相比对照组分别降低约27.5%、36.8%。说明CEW处理一定程度上抑制了绿豆芽的蒸腾失水,维持了绿豆芽细胞膜的完整性,减少内容物的流失,抑制MDA、H2O2含量的升高,减少积累,延缓细胞膜脂过氧化的速度。
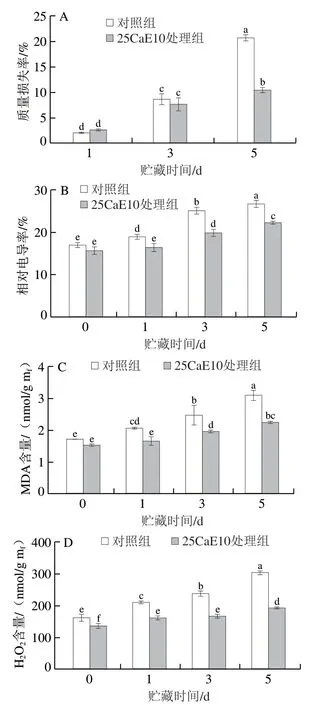
图2 CEW处理对绿豆芽贮藏过程中质量损失率(A)、相对电导率(B)、MDA含量(C)、H2O2含量(D)的影响Fig.2 Effects of CEW treatment on mass loss percentage (A),relative conductivity (B),MDA content (C) and H2O2 content (D) of mung bean sprouts during storage
2.2 CEW处理对绿豆芽采后低温贮藏水分状态的影响
水分的自由度随T2弛豫时间的变化而不同,T2越短说明水分和物质的结合程度越高,反之越低。从图3可以看出,绿豆芽的T2图谱大致有4 个峰,分别代表不同状态水分的分布情况,根据弛豫时间T2,将其划分为结合水(T210.1~10 ms)、不易流动水(T2210~100 ms)、自由水(T23100~1 000 ms)3 种,水分状态与王娟等[20]关于灵武长枣的检测结果基本一致。以峰面积A21表示结合水含量,A22表示不易流动水含量,A23表示自由水含量,三者之和A表示总水分含量,结果如表1所示。
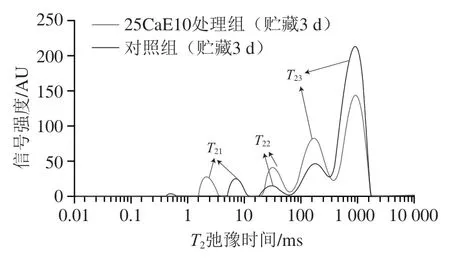
图3 绿豆芽贮藏3 d时的横向弛豫时间(T2)图谱Fig.3 Transverse relaxation time (T2) spectra of mung bean sprouts stored for three days
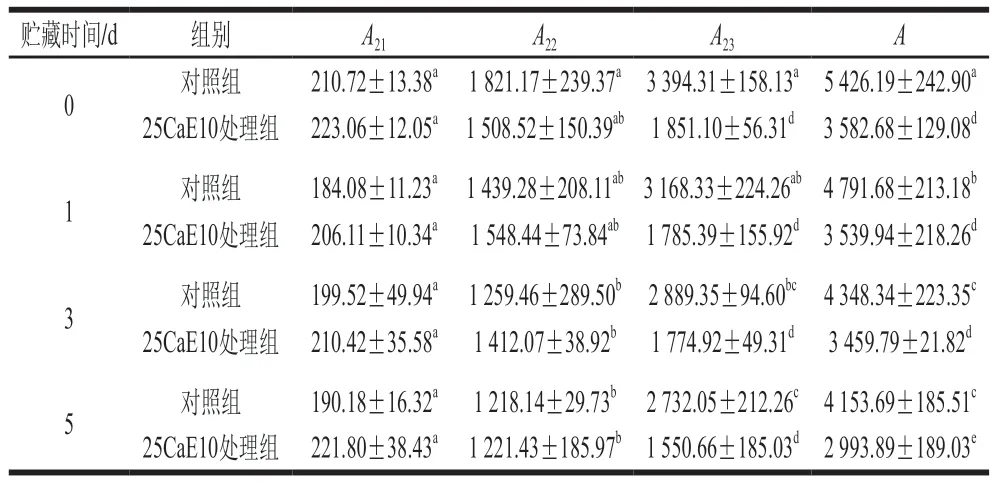
表1 绿豆芽贮藏过程中不同状态水的峰面积变化Table 1 Changes in the peak area of water in different states in mung bean sprouts during storage
从表1可以看出,绿豆芽中的水分主要以自由水的形态存在,其次是不易流动水,结合水含量最少。在贮藏过程中,对照组与25CaE10处理组绿豆芽的总水分含量A和不易流动水含量A22、自由水含量A23变化趋势相同,均表现为不断降低,说明贮藏期间绿豆芽水分不断流失,其中不易流动水、自由水散失严重;结合水含量A21基本保持稳定,不易散失。此外,在贮藏1、3、5 d时,25CaE10处理组的总水分含量A和自由水含量A23均显著低于对照组(P<0.05),不易流动水含量A22和结合水含量A21略高于对照组,差异不显著(P>0.05),说明CEW处理因为钙离子的引入,一定程度上对水分状态产生影响。同时,进一步分析实验数据发现25CaE10处理组总水分含量下降速率较慢,推测较好的保水性可能也是其贮藏效果最佳的原因之一。
2.3 CEW处理对绿豆芽贮藏期间质构特性的影响
从图4可以看出,在贮藏过程中,对照组和25CaE10处理组绿豆芽的硬度、脆度均表现为逐渐降低的趋势,25CaE10处理组的硬度、脆度始终高于对照组。贮藏0 d时,25CaE10处理组与对照组硬度存在显著差异(P<0.05),在贮藏第1、3、5天时,相比于前一个采样时间点,自来水组的硬度下降率分别为2.05%、4.05%、15.11%,而25CaE10处理组为5.65%、0.93%、4.93%,说明CEW处理可以延缓绿豆芽的软化;贮藏5 d时,对照组绿豆芽的硬度与0 d相比显著降低(P<0.05),为355.67 g,而25CaE10组的硬度为456.33 g,约为对照组的1.28 倍。脆度的变化趋势与硬度相似,随着贮藏时间的延长,脆度变化较为缓慢,处理组与对照组之间存在显著差异(P<0.05)。在贮藏过程中,相比于前一个采样时间点,对照组的脆度下降率分别为5.44%、9.48%、5.42%,而25CaE10处理组分别为1.59%、6.20%、3.78%;贮藏5 d时,处理组脆度仍然可达529.67 g,约是对照组的1.21 倍。说明CEW处理一定程度上可以有效延缓绿豆芽硬度以及脆度的下降,保持质地和口感。

图4 CEW处理对绿豆芽贮藏过程中硬度(A)、脆度(B)的影响Fig.4 Effects of CEW treatment on hardness (A) and brittleness (B) of mung bean sprouts during storage
2.4 绿豆芽贮藏过程中微生物数量的变化
从图5可以看出,在低温贮藏过程中,对照组和25CaE10处理组绿豆芽的菌落总数均表现为逐渐增加的趋势,贮藏0 d即绿豆芽采收时,处理组的菌落总数显著低于对照组,贮藏过程中,25CaE10处理组的菌落总数始终低于对照组(P<0.05)。同时,在贮藏期间,25CaE10处理组的菌落总数与对照组之间始终存在显著差异(P<0.05),贮藏1、3、5 d 时,其菌落总数对数值较对照组分别降低约1.08、1.09、0.71(lg(CFU/g))。说明CEW处理可以有效减少菌落总数,抑制微生物生长,这也为延长绿豆芽货架期和提高豆芽品质提供了有力保障。

图5 CEW处理对绿豆芽贮藏过程中菌落总数的影响Fig.5 Effects of CEW treatment on total bacterial count in mung bean sprouts during storage
2.5 CEW处理对绿豆芽采后低温贮藏过程中褐变的影响
贮藏期间绿豆芽的外观以及褐变情况如图6所示。对照组绿豆芽在贮藏3 d时已有较为明显的失水皱缩和褐变现象,贮藏5 d时品质劣变现象加重,而25CaE10处理组状况良好。从图6B可以看出,在贮藏过程中,对照组和25CaE10处理组绿豆芽的褐变指数均表现为逐渐增加的变化趋势,25CaE10处理组的褐变指数始终显著低于对照组(P<0.05),并且随着贮藏时间的延长,差异逐渐明显;贮藏3 d时,对照组绿豆芽的褐变指数明显增加,从贮藏1 d时的3.25增加到贮藏3 d时的4.90,而处理组的褐变指数增加缓慢,贮藏3 d时为3.14,相比对照组降低约35.9%;贮藏5 d时,处理组褐变指数为3.51,相比对照组降低了约33.9%。由此可见,CEW处理一定程度上可以抑制绿豆芽的褐变,延缓品质劣变。

图6 绿豆芽贮藏过程中外观(A)及褐变指数(B)的变化Fig.6 Changes in visual appearance (A) and browning index (B) of mung bean sprouts during storage
2.6 CEW处理对绿豆芽贮藏过程中总酚及褐变相关酶的抑制作用
如图7A所示,两组总酚含量均随着贮藏时间的延长略有增加,但25CaE10处理组的总酚含量始终显著低于对照组(P<0.05),在贮藏3 d和5 d时,其总酚含量分别为0.864、1.026 mg/gmf,相较对照组分别降低约25.8%、19.8%。酚类物质作为酶促褐变的重要底物,其含量的降低有利于控制酶促褐变,进一步说明CEW处理可在一定程度上抑制绿豆芽褐变。
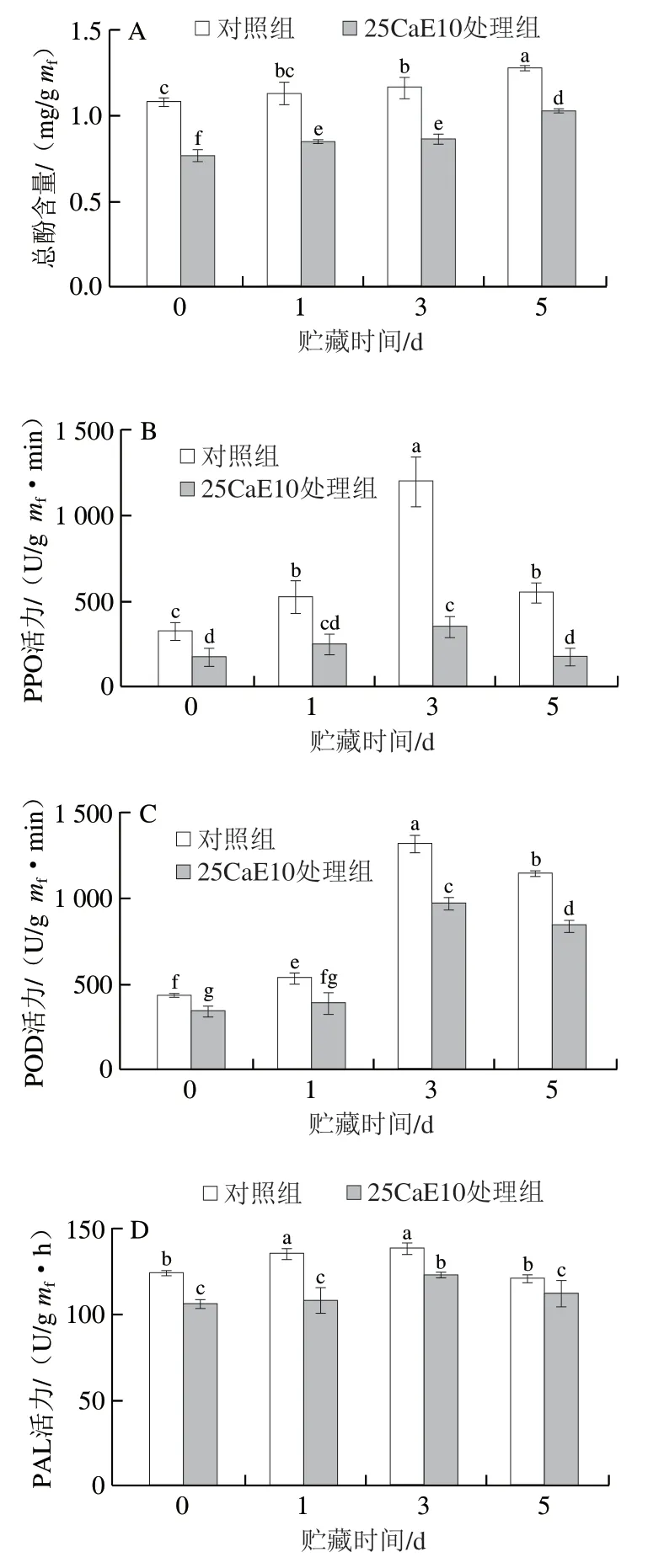
图7 CEW处理对绿豆芽贮藏过程中总酚含量(A)及PPO(B)、POD(C)、PAL(D)活力的影响Fig.7 Effects of CEW treatment on total phenol content (A) and PPO (B),POD (C) and PAL (D) activity of mung bean sprouts during storage
从图7B~D可以看出,在低温贮藏前期,对照组和25CaE10处理组绿豆芽的PPO、POD、PAL活力变化趋势一致,均表现为贮藏前期逐渐增加,贮藏第5天时开始下降,25CaE10处理组相关酶活力始终显著低于对照组(P<0.05)。贮藏1 d,各组别PPO活力缓慢增加,到贮藏3 d时,对照组绿豆芽的PPO活力大幅度提高,从贮藏1 d的525 U/(gmf·min)增加到1 200 U/(gmf·min),增加了约1.29 倍,而25CaE10处理组的PPO活力相对较低,只有350 U/(gmf·min),相比对照组活力降低了约70.8%。绿豆芽POD活力同样在贮藏3 d快速增长,25CaE10处理组的POD活力仍低于对照组,其活力为965 U/(gmf·min),相比对照组的1 317.5 U/(gmf·min),降低了约26.8%。此外,在贮藏过程中,绿豆芽的PAL活力较高,在贮藏3 d时,对照组的PAL活力为138.45 U/(gmf·h),而25CaE10处理组的活力为122.55 U/(gmf·h),降低约11.5%。通过对绿豆芽的褐变指数以及褐变相关酶的测定发现,绿豆芽在贮藏3 d时出现明显的褐变现象,CEW处理能够很好地抑制褐变相关酶活力,延缓绿豆芽的褐变。
3 讨论
果蔬在贮藏过程中,伴随着水分散失、组织软化、酶促褐变以及氧化损伤等导致品质劣变的过程。绿豆芽含水量极高,水分是新鲜果蔬重要的组成部分,蒸腾作用是导致水分流失的重要原因[21]。钙和电解水分别处理均能引起果蔬质量损失率的降低,减少水分损失[22-23],本研究结果发现,CEW处理可降低绿豆芽的质量损失率,同时核磁共振检测水分状态结果表明,CEW处理后水分状态略有改变,结合水含量增加,导致水分不易散失。此外,贮藏期间的成熟软化是一个复杂的过程,涉及到细胞壁降解、呼吸作用、能量代谢、微生物侵染、乙烯调控等[24]。其中,细胞壁主要物质果胶和纤维素的降解是软化的主要因素[25],细胞壁降解酶在其中发挥了主要的作用。钙和电解水处理都能够降低多聚半乳糖醛酸酶等细胞壁相关酶活力,抑制细胞壁成分分解[10,26],同时钙作为细胞壁的主要结构物质,还可与细胞壁中的果胶结合形成果胶酸钙,进一步维持细胞壁强度,保持硬度[27]。本研究结果发现,CEW能够抑制绿豆芽的硬度降低,同时保持一定的脆度,推测机理与抑制各种细胞壁降解酶活力相关。
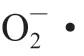
绿豆芽极易发生酶促褐变,褐变不仅影响产品外观还会影响食用品质。酶促褐变发生的三大必要条件包括氧气、PPO以及酚类底物。正常细胞中PPO与酚类物质是分离的,因此不易发生褐变,而当细胞膜受损后,二者相互接触,PPO被激活,催化酚类物质氧化聚合从而引起褐变[31]。因此,褐变的发生与细胞膜的完整性、总酚含量、PPO、POD、PAL等酶活力、ROS代谢等密切相关[31-32]。本研究结果表明,CEW处理可降低绿豆芽在贮藏过程中的褐变指数和总酚含量,同时抑制PPO、POD、PAL活力,配合相对电导率、MDA含量和H2O2含量的下降,从而有效缓解褐变。此外,综合分析褐变相关数据发现绿豆芽的褐变主要发生在贮藏3 d时,在此阶段施加干预,可以很好地抑制褐变现象。综上所述,CaCl2电解水处理对绿豆芽的采后低温贮藏保鲜具有一定的积极意义。
4 结论
利用含25 mmol/L CaCl2的电解水浸泡、喷淋绿豆萌发得到豆芽后,能够减少贮藏过程中绿豆芽的水分散失,增加结合水含量,保持硬度和脆度,降低表面微生物数量,维持细胞膜的完整性,减少代谢物MDA以及H2O2的积累,同时还可显著抑制褐变现象,降低酶促褐变底物酚类物质的含量以及褐变相关酶PPO、POD、PAL活力,延缓了品质劣变,对绿豆芽起到一定的保鲜效果。
