BHV-1感染牛巨噬细胞对CD300a转录的影响
2023-03-08王旭芬赵润涛张志丹周伟光
王旭芬,安 冬,侯 琳,赵润涛,张 贺,赵 洋,张志丹,周伟光*
(1.内蒙古农业大学 兽医学院 农业农村部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;2.呼伦贝尔市海拉尔区疫病预防控制中心,内蒙古 呼伦贝尔 021000)
牛传染性鼻气管炎(infectious bovine rhinoyracheitis,IBR)是由牛Ⅰ型疱疹病毒(bovine herpesvirus 1,BHV-1)引起的急性传染病,临床表现为体温升高、呼吸困难、呼吸道及气管黏膜严重发炎并高度充血,伴有结膜炎、脓疱性外阴阴道炎、母牛流产及犊牛脑膜炎等病症,此病一旦发生就难以根除,严重威胁全世界的养牛业发展。许多学者对BHV-1感染与宿主细胞之间的关系都进行了深入的研究。1996年,HANON等[1]发现BHV-1可诱导牛外周血单个核细胞(PBMC)和B淋巴瘤细胞凋亡,推测其诱导机制可能与一些病毒糖蛋白在病毒颗粒与靶细胞上受体的互作关系紧密,病毒粒子包膜上编码的糖蛋白对病毒附着、细胞免疫、病毒传播和趋向性至关重要[2]。BHV-1的结构蛋白gB、gD、gG是宿主免疫系统识别的主要位点;包膜蛋白gE通过阻断酪氨酸磷酸化减少病毒的复制[3-6];bICP0蛋白可以通过降解宿主细胞IRF3,抑制细胞IFN-1的转录来抵抗天然免疫[7],是诱导宿主免疫抑制导致机体发病时BHV-1发挥致病作用的重要途径。
疱疹病毒为了在动物体内建立潜伏感染和直接感染,已经进化出了利用免疫系统的抑制性信号通路钝化抗病毒反应[8]。目前,BHV-1感染的致病机理尚不清楚,原发性感染后,非特异性炎症和细胞免疫是机体对BHV-1感染的第一反应[9],揭示BHV-1感染宿主细胞诱导的天然免疫及其机制可为防控BHV-1提供新的理论依据。作为免疫细胞表面受体和免疫球蛋白超家族中的一类,CD300家族分子在免疫应答中发挥重要的作用。已证明,CD300家族成员参与TLR信号通路,并在一些感染性疾病中参与抑制或激活免疫应答功能[10],但是CD300家族分子调控病毒诱导天然免疫的相关性研究较少,更未见CD300分子与BHV-1相互作用的有关报道。重要的是,在筛选人类进化谱系中积极选择的基因时,一些与免疫防御相关的基因出现在列表的最前面,其中CD300a表现出了强阳性,在经历主动进化的50个基因中排名第二,这提示CD300a在宿主进化和免疫调节中承担了重要角色[11]。因此,研究CD300家族的受体CD300a在BHV-1感染牛单核巨噬细胞过程中触发的天然免疫反应中的作用及机制具有重要意义。本试验应用BHV-1内蒙古分离株感染牛单核巨噬细胞后检测对CD300转录的影响,为进一步研究CD300a调控BHV-1免疫机制提供依据。
1 材料与方法
1.1 试验材料BHV-1毒株由内蒙古农业大学兽医传染病学实验室保存;BHV-1抗原抗体阴性牛由内蒙古农业大学兽医学院动物园提供。
1.2 主要试剂牛外周血淋巴细胞分离液购自天津灏洋生物制品有限公司;pMD19-T载体、DH5α感受态细胞、Premix TaqTM、EASY Dilution、SYBR®Premix Ex TaqTMⅡ均购自TaKaRa公司;总RNA提取试剂盒、病毒DNA/RNA提取试剂盒购自天根公司;质粒小量提取试剂盒、琼脂糖凝胶DNA回收试剂盒、HiScript®ⅡQ RT SuperMix for qPCR反转录试剂盒均购自南京诺唯赞生物科技有限公司;胎牛血清、DMEM培养基、RPMI 1640培养基均购自Gibco公司。
1.3 引物设计与合成参照GenBank中CD300a (MN_001192456.2)基因序列、BHV-1 gE(GU-591891.1)基因序列、β-actin ( DQ838049.1)基因序列,使用Oligo7软件设计3个基因对应的特异性引物(表1)。引物由生工生物工程(上海)股份有限公司合成。

表1 CD300a、BHV-1 gE和 β-actin引物序列
1.4 牛单核细胞的分离及培养使用真空负压抗凝管采取健康牛静脉血50 mL,迅速转移至超净台内;将5 mL淋巴细胞分离液加入到15 mL PBMC高效离心管中,250×g离心1 min,取抗凝血按体积 1∶1 的比例与样本稀释液混匀。将5 mL稀释后的血液样本缓慢加于分离液液面上,1 000×g离心25 min 后,离心管中由上至下分为4层:第1层为血浆层,第2层为环状乳白色淋巴细胞层,第3层为分离液层,第4层为红细胞层;小心吸取第2层环状乳白色淋巴细胞层到另一离心管中,加入10 mL 清洗液,混匀细胞;250×g离心10 min,弃上清,用5 mL 清洗液重悬所得细胞,重复3次;弃上清,用5 mL 10% RPMI 1640培养基重悬细胞后转移到通气细胞瓶,5% CO2细胞培养箱中培养,3 h后弃上清,加入5 mL 10% RPMI 1640培养基继续培养2~ 3 d,得到分化成熟的单核巨噬细胞。
1.5 CD300a SYBR GreenⅠ荧光定量PCR检测方法的建立
1.5.1标准品的制备 按照细胞总RNA提取试剂盒说明书提取单核巨噬细胞RNA,反转录得到的cDNA作为模板,使用CD300a基因和β-actin基因特异性引物,扩增目的片段。反应体系25 μL:Premix TaqTM12.5 μL,上、下游引物各1 μL,模板2 μL,ddH2O补至25 μL。反应条件:98℃预变性2 min;98℃ 10 s,62℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min,10℃保存。用琼脂糖凝胶DNA回收试剂盒回收目的基因,连接到pMD19-T载体构建重组质粒,转化至DH5α感受态细胞中克隆,再接种到含Amp的培养基上倒置于37℃温箱过夜;挑取菌落进行鉴定,反应参数和体系与上述一致;挑取鉴定为阳性的菌落加入到5 mL液体培养基中,于37℃摇床过夜。用质粒小量提取试剂盒提取质粒再次进行鉴定,将鉴定为阳性的质粒送至华大基因科技有限公司进行测序。分析测序结果,选取测序正确的阳性质粒,用酶标仪测定重组质粒浓度,并根据公式:拷贝数(copies/μL)=6.02×1023×(质粒浓度(mg/L)×10-9)/(DNA长度×660),将质粒浓度换算成拷贝数,用EASY Dilution对质粒进行1×1010~1×100拷贝/mL梯度稀释作为标准品。
1.5.2标准曲线的绘制 以质粒为模板,上、下游引物用量(10 μmol/L)设置5个梯度(0.2,0.4,0.6,0.8,1.0 μL)、退火温度设置5个梯度(51,53,55,57,59℃)进行实时荧光定量PCR反应体系和条件的优化。采用最高效的工作浓度和退火温度为原则,最终确定的反应体系为Premix TaqTM12.5 μL,上、下游引物各0.4 μL,模板2 μL,ddH2O补至25 μL。反应条件:预变性95℃ 30 s;变性95℃ 5 s,CD300a退火温度55℃,β-actin退火温度58℃ 30 s,40个循环;溶解过程为95℃ 10 s,60℃ 5 s。选取1×108~1×101拷贝数的标准品作为模板,同时设置阴性对照,用优化好的体系及参数进行荧光定量PCR扩增,绘制CD300a和β-actin标准曲线。
1.5.3敏感性试验 选取1×108~1×100拷贝/μL的质粒标准品作为模板,ddH2O为阴性对照,评价本研究建立的CD300a基因荧光定量检测方法的敏感性,确定最低检出拷贝数。
1.6 BHV-1的分离鉴定采集疑似IBR病牛鼻拭子,提取病毒核酸,使用表1引物进行PCR鉴定。PCR反应体系25 μL:Premix TaqTM12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板2 μL,ddH2O补至25 μL。反应条件:98℃ 2 min;98℃ 10 s,59℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min,4℃保存。鉴定结果为阳性的病料用0.22 μm滤器过滤,取0.5 mL接种到单层均匀的MDBK细胞上作用1 h,同时设置空白对照,细胞出现典型CPE后收毒,冻融3次,传代至毒力稳定用Reed-Muench法测得TCID50。
1.7 检测BHV-1攻毒单核巨噬细胞后CD300a的转录变化用BHV-1接种分化成熟的巨噬细胞设为攻毒组,同时设置空白对照组,提取攻毒后0,6,12,24,48,72 h的细胞总RNA,反转录为cDNA,用建立好的CD300a荧光定量PCR检测方法进行样品的检测。使用双标准曲线法计算CD300a基因在不同攻毒时间的表达量,归一化值=目的基因浓度/看家基因浓度,最后通过公式计算攻毒前后CD300a的表达量差异倍数,F=(待测组样品目的基因浓度/待测组样品看家基因浓度)/(对照组样品目的基因浓度/对照组样品看家基因浓度)。
1.8 数据分析采用SPSS 22.0软件处理数据,采用单因素方差分析(One-way ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 牛单核巨噬细胞的鉴定结果成功分离单核巨噬细胞后,每天在倒置显微镜下观察分离出的贴壁细胞,可见细胞体积逐渐变大,长成不规则形态,两极分化出伪足(图1)。

图1 牛单核巨噬细胞
2.2 CD300a荧光定量PCR检测方法的建立
2.2.1目的基因扩增及标准品构建结果 提取巨噬细胞总RNA,反转录获得cDNA,使用CD300a基因、β-actin基因特异性引物进行PCR扩增,扩增片段分别为196,256 bp,大小与预期相符(图2)。目的片段回收纯化后,克隆至pMD19-T载体,选取测序正确的阳性重组质粒作为标准品,测得质量浓度分别为59.26,96.23 mg/L,换算成拷贝数分别为1.87×1010,2.98×1010拷贝/μL。
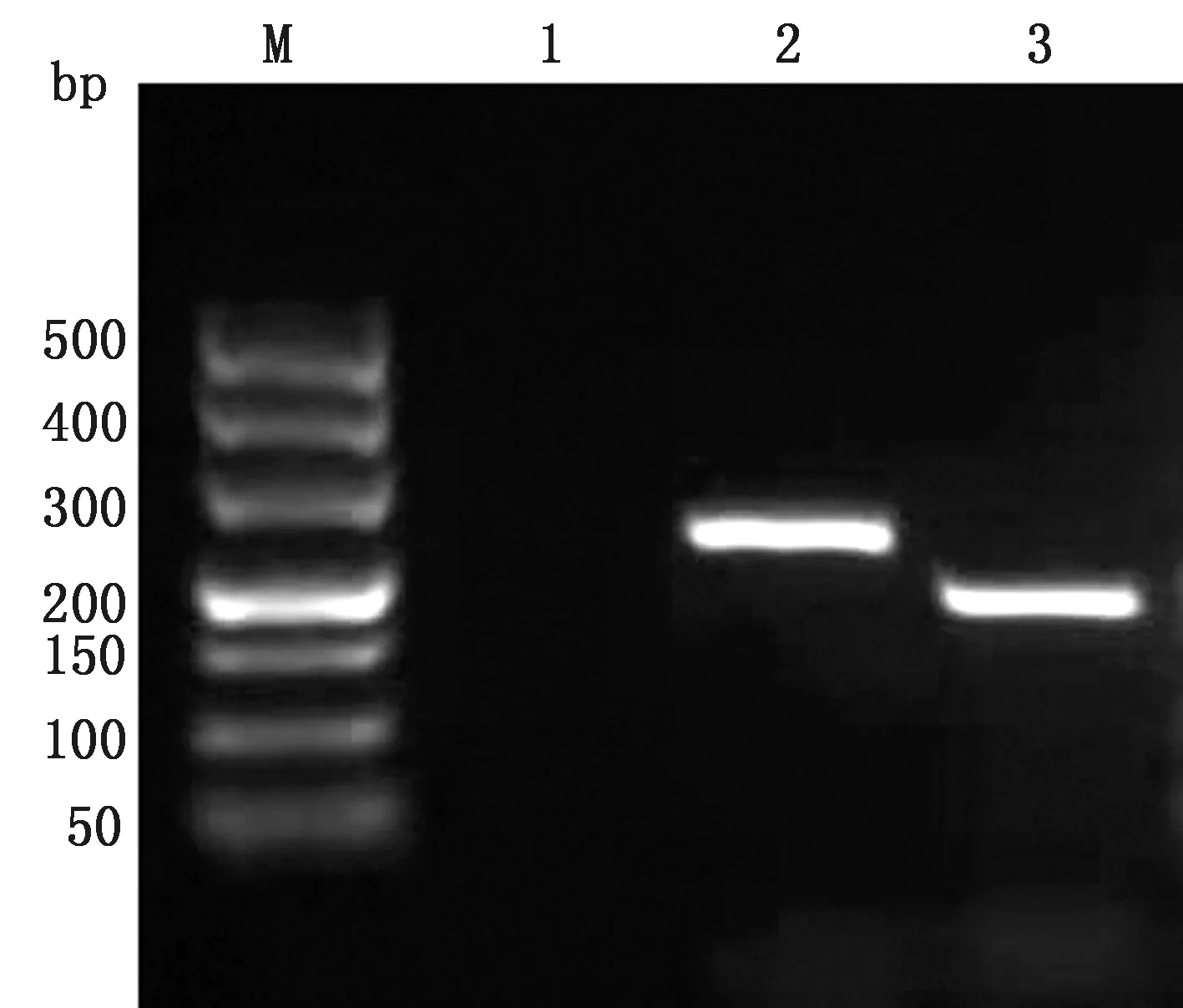
M.DL500 DNA Marker;1.阴性对照;2.β-actin扩增产物;3.CD300a扩增产物
2.2.2标准曲线的绘制 选取CD300a基因、β-actin基因质粒标准品的1×109~1×101拷贝/μL为模板,用优化好的体系及参数进行荧光定量PCR扩增,绘制标准曲线。结果如图3所示,CD300a基因的标准曲线Ct值与标准品浓度之间呈现良好的线性关系,获得的线性方程为y=-3.488x+44.078,相关系数R2为0.998,扩增效率为93.5%;CD300a溶解曲线为特异单峰,无非特异性扩增。β-actin基因的标准曲线Ct值与标准品浓度之间呈现良好的线性关系,获得的线性方程为:y=-3.523x+44.963,相关系数R2为0.999,扩增效率为92.2%;β-actin溶解曲线为特异单峰,无非特异性扩增。
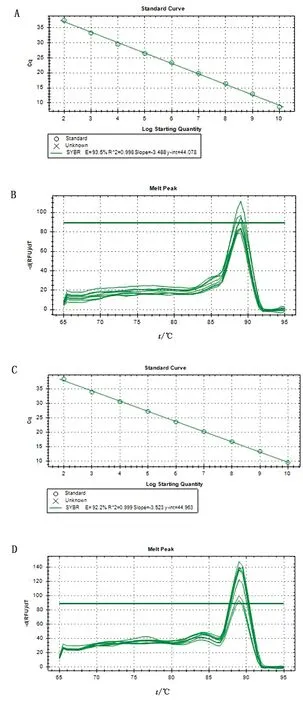
A,C.CD300a、β-actin荧光定量PCR的标准曲线;B,D.CD300a、β-actin荧光定量PCR的溶解曲线
2.2.3敏感性试验 对CD300a、β-actin基因1×108~1×100拷贝/μL的重组质粒标准品进行敏感性检测,结果显示,最低检测限均为10 拷贝/μL,证明本方法灵敏性高(图4)。
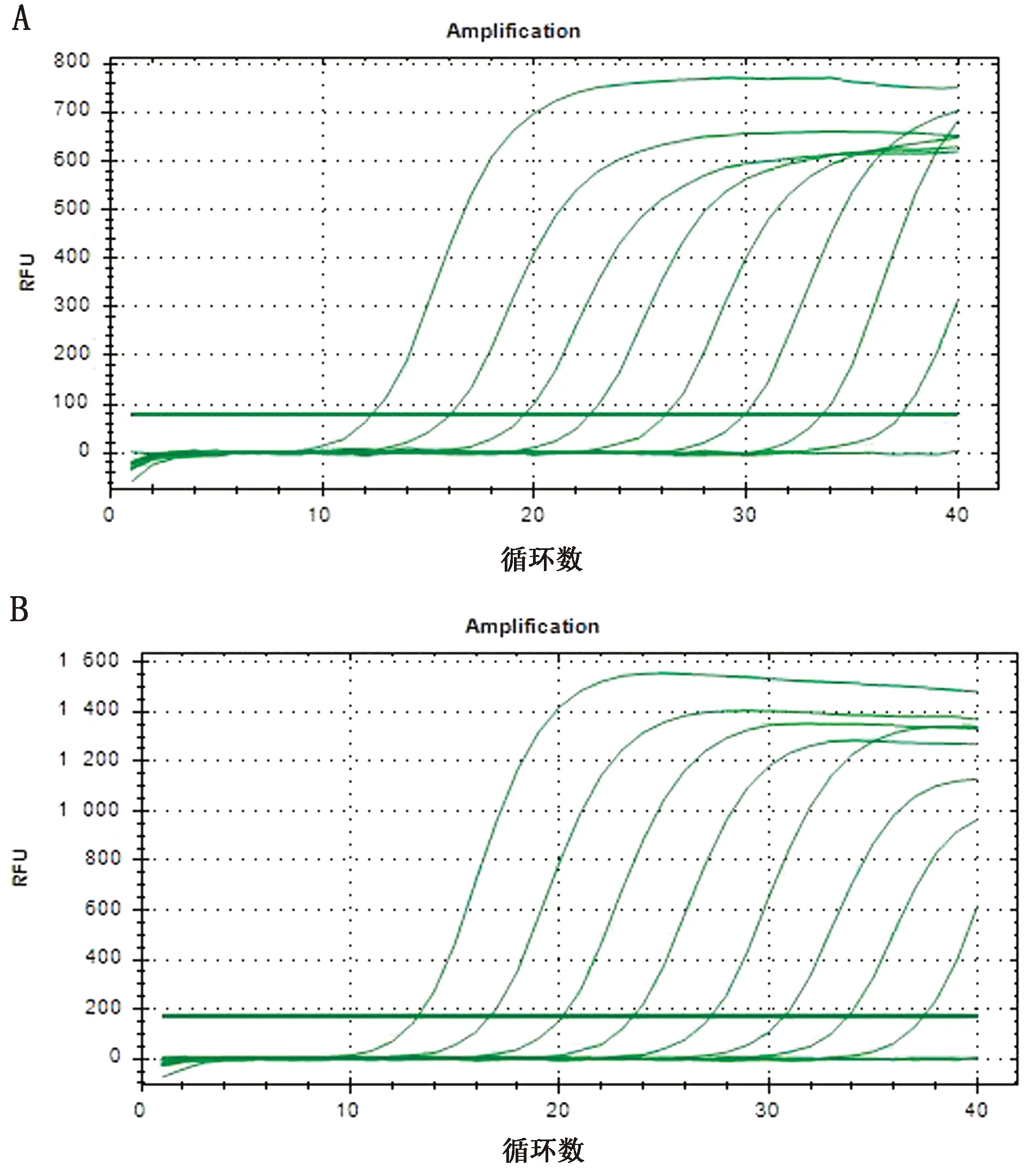
注:0.0.1×100拷贝/μL及阴性对照;1~8.分别为1×108~1×101拷贝/μL
2.3.3BHV-1的分离鉴定 使用BHV-1 gE基因特异性引物进行PCR扩增,扩增片段为101 bp,大小与预期相符(图5)。通过显微镜观察MDBK细胞接种病料后的细胞病变(CPE),盲传至毒力稳定,出现典型的CPE(图6,7),用Reed-Muench法测得其病毒滴度为107.23TCID50/ mL。
2.3.4检测BHV-1攻毒单核巨噬细胞后CD300a的转录变化 用建立的荧光定量PCR方法检测攻毒后0,6,12,24,48,72 h的CD300a表达量,每个样本做3个重复,通过双标准曲线法计算CD300a的转录变化。结果如图8所示:攻毒后CD300a在0~72 h内的相对表达水平均高于对照组,其中,6,12,24 h的表达差异倍数显著高于0,72 h (P<0.05),并且在12 h 时表达差异倍数达到最高,且显著高于其他各组(P<0.05);从攻毒之后CD300a的相对表达量就开始增加,在6~24 h内的差异表达倍数增长较快,其中在12 h达到最高,之后增长开始变缓慢,最后趋于水平,表达差异倍数整体呈抛物线增长。
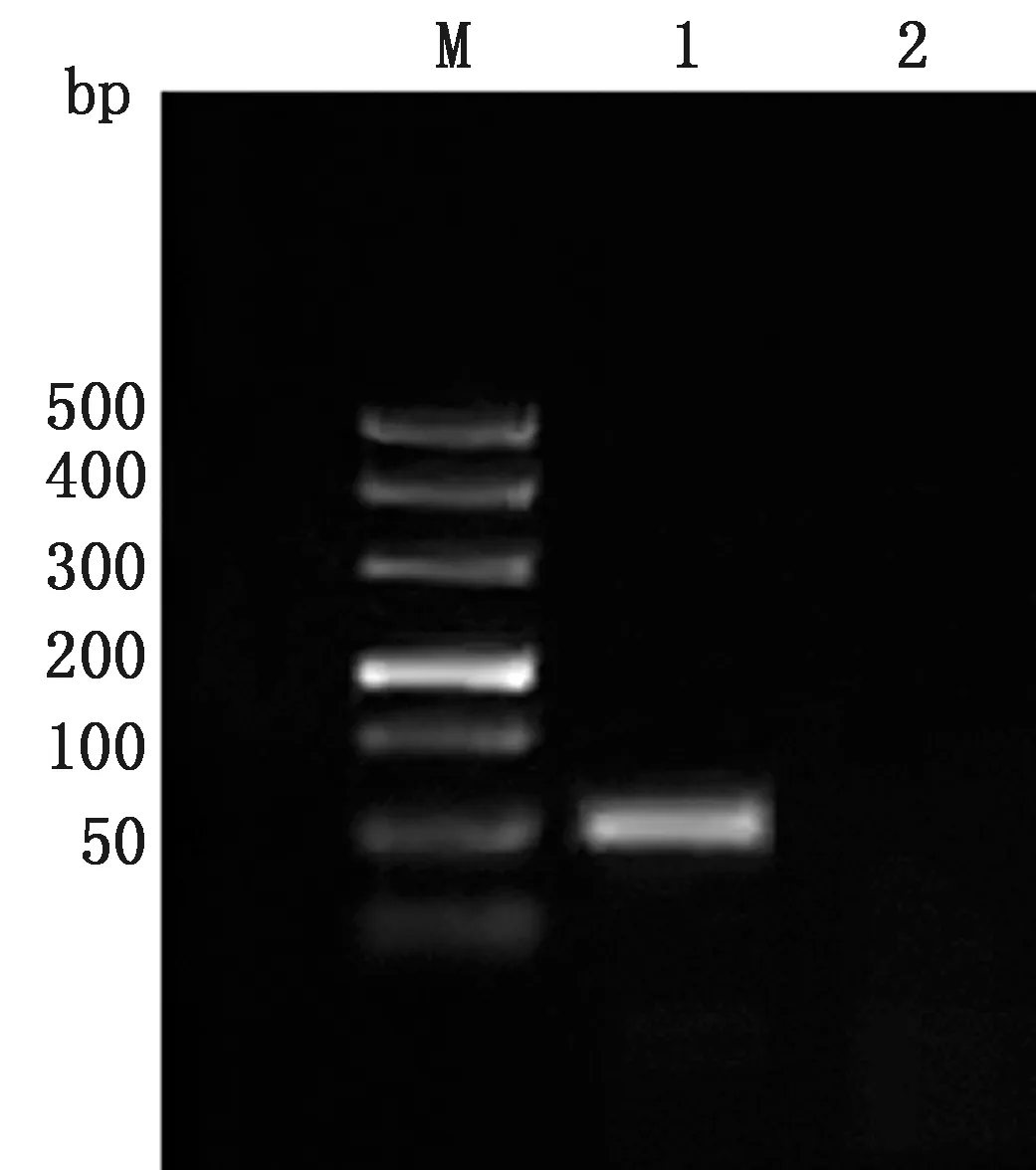
M.DL500 DNA Marker;1.阴性对照;2.目的基因扩增产物
图6 MDBK正常细胞
图7 MDBK出现CPE
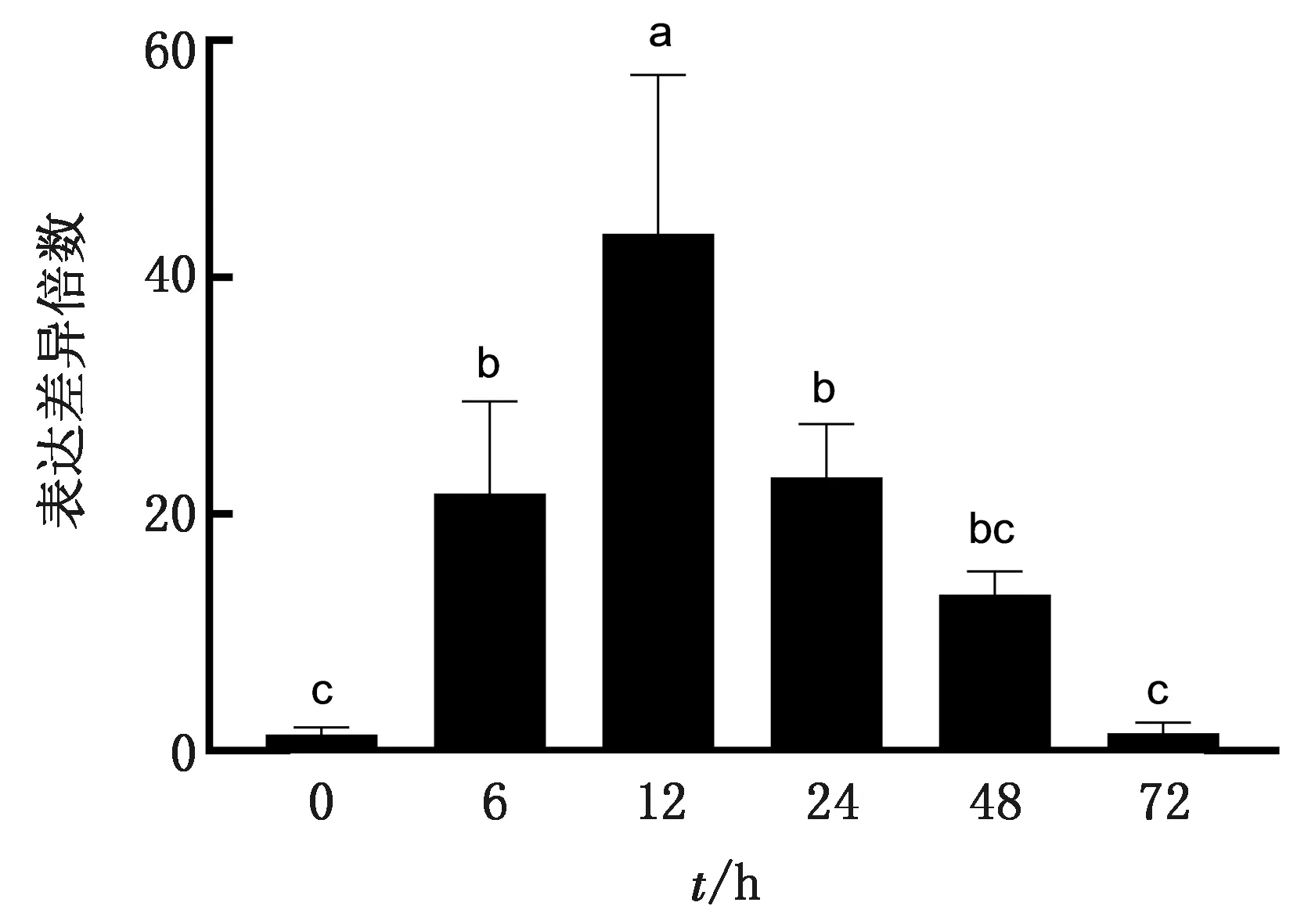
注:误差线代表标准误,所标字母不同表示差异显著(P<0.05),所标字母相同代表差异不显著(P>0.05)
3 讨论
BHV-1最早发现于20世纪50年代美国科罗拉多州的育肥牛群,当时欧洲为了提高产奶性能而引进北美奶牛,致使BHV-1迅速传播到欧洲[12]。1980年,我国从新西兰进口奶牛中首次报道该病,此后的血清学调查显示我国BHV-1流行趋势不断上升[13-15]。BHV-1的高血清率、隐形感染、严重的并发症和对奶牛产奶量、繁殖力和使役力的影响,都迫切的催促着人们探究BHV-1的免疫机理。BHV-1被认为通过诱导宿主细胞凋亡造成持续性感染及激活炎症复合物诱导严重的炎症反应,利用与细胞表面受体相互作用逃避免疫系统的攻击,造成宿主免疫抑制的发生[16]。病毒逃避免疫反应的几种策略之一是促进表达在不同免疫细胞类型上的抑制性受体与其感染细胞上的配体或直接与病毒颗粒的结合,诱导抗病毒反应的下调[17]。越来越多的研究表明,CD300a受体参与了许多病毒逃逸和免疫调节。SIMHADRI等[18]发现CD300a作为PS结合蛋白参与病毒进入宿主细胞并传递抑制信号,阻止单核细胞衍生的巨噬细胞吞噬死亡细胞;CLARK等[19]发现CD300a还可以影响树突状细胞和单核细胞的迁移;KOYANAGI等[20]发现猪伪狂犬病病毒(porcine pseudorabies virus,PRV)通过诱导磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)暴露于胞膜的外部,使抑制性受体CD300a与感染细胞上的配体PS和PE相结合,导致NK细胞的细胞毒性被严重抑制。同为疱疹病毒的BHV-1是否也利用同样的机制对宿主细胞造成免疫抑制,有待于进一步探究。其次,抑制性受体CD300a基于胞质尾部结构域的免疫受体酪氨酸的抑制序列(ITIMs),配体诱导ITIMs的酪氨酸残基磷酸化,是ITIMs作为抑制信号必不可少的条件,与不同的信号通路耦合,导致细胞的某些功能被抑制[21]。张宽等[22]在2016年发现BHV-1感染MDBK细胞后,gE蛋白在其酪氨酸残基上被宿主细胞酪氨酸激酶磷酸化,从而启动信号级联级,使用酪氨酸激酶抑制剂减弱控制BHV-1的感染,CD300a抑制信号的启动依赖ITIMs的酪氨酸残基磷酸化,使用酪氨酸激酶抑制剂可以控制BHV-1的感染,因此推测BHV-1感染宿主细胞和免疫抑制性受体CD300a相辅相成。
为了探究BHV-1攻毒后对抑制性受体CD300a影响,本试验首次建立CD300a的荧光定量双标准曲线法,双标准曲线法相对定量指的是在待测样本中目的基因相对于看家基因的量的变化,看家基因是稳定表达的一种基因,可以消除初始RNA或cDNA量的差异带来的表达差异,准确地比较不同处理样本中的基因表达水平的高低变化,得到的结果是比率[23-24]。使用双标准曲线法分析了BHV-1攻毒前后抑制性分子CD300a的转录变化,发现攻毒后6~48 h内CD300a表达水平相对于对照组显著增加(P<0.05),表达差异倍数呈现先上升,到12 h时达到顶点,之后再逐渐下降的趋势,推测攻毒12 h后,病毒增殖比较旺盛,但随着病毒的增殖,其也会诱导巨噬细胞的凋亡,到72 h时没有可供病毒增殖的活细胞,CD300a也相应下降。综上所述,本试验证明BHV-1对巨噬细胞的感染诱导了抑制性受体CD300a表达量增多,推测其在BHV-1免疫调控中起重要作用,试验结果为CD300a调控BHV-1致病机制的深入研究奠定了基础。
