局部晚期胰腺癌的治疗进展
2023-03-08郭世伟
郭世伟
(海军军医大学长海医院 肝胆胰外科,上海 200433)
胰腺癌(pancreatic ductal adenocarcinoma,PDAC)作为恶性程度最高的肿瘤之一,其发病率居恶性肿瘤的第9 位,但总体致死率极高,到2030年胰腺癌绝对致死人数将仅次于肺癌,成为全球第二大癌症致死原因[1]。缺乏突破性治疗手段,已有疗法在胰腺癌中获益人群有限(有明确免疫/靶向治疗指征仅占2%),是导致高致死率的主要原因。因此,目前胰腺癌仍需手术、化疗、放疗和靶向免疫等在内的综合系统治疗(systemic therapy)来解决问题[2]。在系统治疗过程中,根据解剖学表现对患者“根治性切除难度”进行分类[R(resectable):可切除;BR(boderline recectable):交界可切除;LA(locally advanced):局部晚期;MS(metastatistic):转移],并采取不同治疗手段的策略取得了一定效果。其中,对于交界可切除的胰腺癌先给予新辅助治疗(neoadjuvant therapy)可以明显延长总体生存时间(overall survival,OS)已经成为共识;对于转移性胰腺癌不做非根治性切除,建议其参与能覆盖全身病灶的化疗/靶向/免疫临床试验也已经成为主要推荐[2];对于可切除胰腺癌中高危可切除的争论也只是停留在先做新辅助治疗还是先手术的二选一问题中。局部晚期胰腺癌,由于没有远处转移,具有极大的潜在可治愈可能(高治疗价值)。然而局部晚期胰腺癌根治性切除的手术复杂、失败率高,传统的诱导治疗(induction therapy)转化率低[3],新的局部治疗技术(电场、射波刀、溶瘤病毒、纳米刀等)的疗效尚待明确。因此,如何让这些潜在可治愈的局部晚期胰腺癌患者获得治愈机会或长期生存是目前胰腺癌治疗领域应该重点解决的难题。
目前针对局部晚期胰腺癌的治疗争议仍较多,甚至“局部晚期胰腺癌”的定义本身就存在争议,加上“诱导治疗+巩固治疗”的复杂治疗体系,使得在临床治疗实践中每个节点的决策都充满了挑战。本文拟从局部晚期胰腺癌的概念和规范定义入手,汇总分析目前相关研究的最新进展,结合海军军医大学长海医院肝胆胰外科的治疗经验,对诱导化疗、转化手术和其他新兴局部治疗做一梳理,为临床诊疗提供循证依据和建议。
1 局部晚期胰腺癌的定义和用词规范
胰腺癌常用的四分类概念(可切除、交界可切除、局部晚期和转移)是建立在解剖学基础上的分类,其目的是划分根治性切除的难度,评估患者通过手术获得治愈的可能性。虽然目前的标准包含了根治性手术常涉及的血管和器官(腹腔干、肝总动脉、肠系膜上动脉、门静脉、肠系膜上静脉等)的评估,但患者是否能真正获得根治与术者经验、术者所在机构的规模和经验更为相关。尤其是在局部晚期这种涉及多支动脉,静脉切除/重建的手术中,术者的技术因素才是决定该患者是否可切除的最终标准。因此,在不同的中心/指南中对胰腺癌可切除的标准有不同的说明[4-7]。见表1和表2。

表1 交界可切除胰腺癌的常见定义

表2 不可切除胰腺癌的定义
值得注意的是,这种基于解剖学的四分类为胰腺癌患者“初治”的评估分类,其主要作用为指导“初治患者”的治疗决策;而对于经过治疗后(诱导化放疗等)影像学评估仍是局部晚期的患者,并不意味着不能行包括联合血管切除的手术治疗等[8]。
2 局部晚期胰腺癌治疗相关的规范用语
由于各国研究者开展局部晚期胰腺癌治疗的时间存在先后,研究的侧重点不同,对治疗各阶段使用的专有名词也各有不同,为避免歧义、统一用词,有必要对本文涉及的用词和翻译做出必要的规范和注释。
(1)Induction therapy: Using high doses of anticancer drugs in the initial treatment especially of advanced cancers in order to make subsequent treatment (as surgery or radiotherapy) more effective.
诱导治疗:通常针对进展期癌症患者,在初期治疗中使用较高剂量的抗癌药物,目的是有助于后续治疗高效的开展,后续治疗一般包括手术和放化疗等。
(2)Conversion surgery: It is defined as a surgical treatment with the goal of R0 resection in initially unresectable cancer patients after response to chemotherapy.
转化手术:指对最初无法手术但化疗后出现应答的患者进行以R0切除为目标的手术治疗。
(3)Conversion therapy: It is any attempt to change a person’s sexual orientation,gender identity,or gender expression.
转化治疗:是任何改变一个人的性取向、性别认同或性别表达的尝试。[9](鉴于我国学者在肿瘤的治疗中,常用“转化治疗”代表以转化手术为目的的综合治疗,在特定语境中也有应用,但不建议把中文的转化治疗翻译为:conversion therapy)
(4)Consolidation therapy: Cancer treatment given after induction therapy to consolidate the gains obtained,further reduce the number of cancer cells and enhance the likelihood of a durable complete remission.
巩固治疗:癌症患者诱导治疗后以巩固获得的成果继续给予的治疗,目的是进一步减少癌细胞数量,提高持久完全缓解的可能性。
3 局部晚期胰腺癌的亚型
局部晚期胰腺癌治疗的终极目的是通过诱导治疗获得根治性手术机会,即进行转化手术(conversion surgery)。然而不同动静脉包绕方式的患者,经过相同诱导治疗后获得根治性手术的概率是有很大区别的。例如,在笔者中心包绕腹腔干的胰腺癌患者有80%经过转化治疗后获得根治性切除的机会。因此,在初诊时就根据转化后可能获得根治性切除的概率进行亚型划分,可能有助于转化治疗目标的设定和选择转化治疗所使用的手段和强弱。
Chatzizacharias等[10]就在其研究中又把局部晚期胰腺癌划分成A型和B型,A型患者获得根治性切除的概率更大,生存更获益。笔者也同意此类做法,结合本中心治疗经验,根据肿瘤-血管解剖结构及手术难易程度进一步细分为三种亚型(长海分型),见表3。对于转化希望大的部分患者,治疗目的应设定为根治性切除;而对于另一部分转化手术希望渺茫的患者,治疗目的应设定为延长生存并获得更好的生活质量。

表3 局部晚期胰腺癌亚型
4 现有局部晚期胰腺癌的指导原则和争议
虽然目前全球学者/各大指南对局部晚期胰腺癌先进行诱导治疗的原则没有争议,但对治疗前需评估的内容,诱导治疗的初始方案,巩固治疗(consolidation)的可选方案及随访策略还存在一定的争议[11-12],见表4。

表4 当前ESMO/ASCO/NCCN指南推荐的局部晚期胰腺癌患者管理方案
诱导治疗的目的是给予后续治疗(subsequent treatment),其中对合适的患者施行转化手术(conversion surgery),对不具备手术条件/无意愿的患者采取化放联合的巩固治疗(consolidate therapy)或其他新一代局部治疗技术(SBRT、纳米刀等)。诱导治疗作为绝大部分局部晚期患者的初始治疗方案,其有效性和安全性决定了患者后续治疗“选项”的多寡[13]。诱导治疗效果好的患者更有可能获得根治性切除的机会,效果差的患者可能只能被迫进入姑息治疗。因此,诱导治疗是局部晚期患者最重要的治疗阶段,也是目前研究较多、争议最多的部分,下文也将按照“治疗前评估-诱导治疗-转化手术-巩固治疗-其他治疗方式-术后随访”的逻辑进行讨论。
4.1 治疗前评估
ASCO指南对于局部晚期胰腺癌的诊断仅需影像学评估,并未明确是否需要行穿刺活检。ESMO指南中规定对于拟行化放疗的患者需要行穿刺活检,一般考虑超声内镜下活检,只有在高度怀疑有腹膜转移的患者中才建议行腹腔镜下探查。NCCN指南则建议所有患者均应该行超声内镜下活检,而对于局部晚期的患者不考虑腹腔镜探查。
ASCO指南只建议治疗前行CT、症状和体力状态等评估,并未常规纳入CA199;ESMO指南建议行CT和CA199联合评估;NCCN指南同样建议行CT和CA199 联合评估,MRI可作为替代。同时,在2022年最新v1 版中,NCCN指南还建议,对于病理确认为胰腺导管腺癌的患者,应该行基因检测(包括遗传突变和体细胞突变),并对有梗阻性黄疸患者行胆管金属支架减黄。
4.2 诱导和巩固治疗
欧洲ESMO指南推荐的初始治疗方案为吉西他滨6 个月的单药治疗,可替代的方案为卡培他滨为基础的化疗联合放疗;而ASCO指南首选推荐为双药以上的联合化疗方案,备选方案为化放疗或单独放疗(SBRT)。NCCN指南则强烈建议体力状态较好的患者进入临床试验,未进入临床试验的患者建议行双药以上的联合化疗4~6个月,之后可以考虑化放疗或SBRT维持;体力状态较差的患者行单药化疗为主,不能耐受者可考虑姑息放疗和支持治疗。
虽然局部晚期胰腺癌没有明确的远处转移,但仍存在微转移风险,尤其是在高风险患者中(肿瘤指标高,肿瘤较大,合并淋巴结转移等)微转移的可能性极大[13]。因此,所有确诊局部晚期的胰腺癌患者都应尽早接受系统治疗(针对原发肿瘤和潜在微转移)。其中,对于体力状况良好的患者,应优先考虑进行诱导化疗或放化疗,控制疾病进展,缓解症状,改善生活质量。部分效果较好的患者通过初始治疗可能达到部分病理缓解甚至完全病理缓解,从而把无法切除的局部晚期胰腺癌转化为可切除的疾病。
虽然目前认为能接受诱导治疗的患者预后更好,但仍缺乏高等级证据的支持。针对局部晚期胰腺癌,已公布数据的3项前瞻性临床试验包括,Ⅱ期SCALOP(2013年)[14]、Ⅲ期LAP07(2016年)[15]和Ⅱ期LAPACT(2020年)[16]。由于研究设计的年份差距较远,所用的诱导治疗方案不同,其总体结果也存在一定差异。(1)SCALOP试验[14]的诱导方案为:3个标准周期的吉西他滨+卡培他滨;而后两组分别给予6 个周期的以吉西他滨或卡培他滨为基础的巩固放化疗(50.4 Gy)。(2)LAP07试验[15]的诱导方案的对照组为4 个标准周期的吉西他滨单药,实验组为吉西他滨+厄洛替尼;巩固治疗的对照组是6个周期的吉西他滨单药治疗,实验组为卡培他滨为基础的放化疗(54 Gy)。(3)LAPACT16的诱导方案为6个周期的吉西他滨+白蛋白紫杉醇(GnP),巩固治疗方案为:①手术;②以吉西他滨或卡培他滨为基础的巩固放化疗;③继续给予吉西他滨+白蛋白结合型紫杉醇化疗。在意向性分析中(ITT),58%(SCALOP)、87%(LAP07)和56%(LAPACT)的局部晚期患者在诱导治疗过程中出现肿瘤进展,无法进行后续巩固治疗,提示联合方案的诱导治疗可能更具优势。同时,随着FOLFIRINOX和GnP方案成为转移性胰腺癌的标准方案后,其也被建议为局部晚期治疗的一线方案,2015年以后的研究也多采用FOLFIRINOX或GnP方案作为诱导治疗的基准方案,以转化手术/化放联合治疗/维持治疗作为巩固治疗方式。
采用哪种联合化疗方案进行诱导治疗将成为下一个研究的焦点。目前已有的数据多为回顾性研究和基于回顾性数据的Meta分析[16-31],见表5。只有日本癌症协会在ASCO 2021 年会报道了JCOG1407研究(mFOLFIRINOX组vsGnP随机对照组)的初步结果:1 年总生存率77.4%vs82.5%,2 年总生存率48.2%vs39.7%,中位OS 2.0年vs1.8年,1年无进展生存率47.5%vs40.2%,缓解率30.9%vs41.4%。此外,Williet等[32]利用回顾前瞻性研究的方法(retroprospective study)比较了GnPvsFOLFIRINOX一线治疗局部晚期胰腺癌患者的效果,结果显示手术切除率(16.7%vs16.1%)和R0切除率相似(88.9%),中位PFS(9个月vs12.1个月)和中位OS无统计学差异(15.7 个月vs16.7 个月)。总体看两种方案的缓解率为18%~47%之间,切除率6.3%~44%,R0 切除率30%~100%,总体中位OS为10.4~35.4 个月,且手术切除患者的OS明显延长。因此,再结合FOLFIRINOX和GnP在可切除胰腺癌中的研究结果(SWOG1505),目前认为两种方案没有明显差别,均可作为诱导治疗的初始方案。
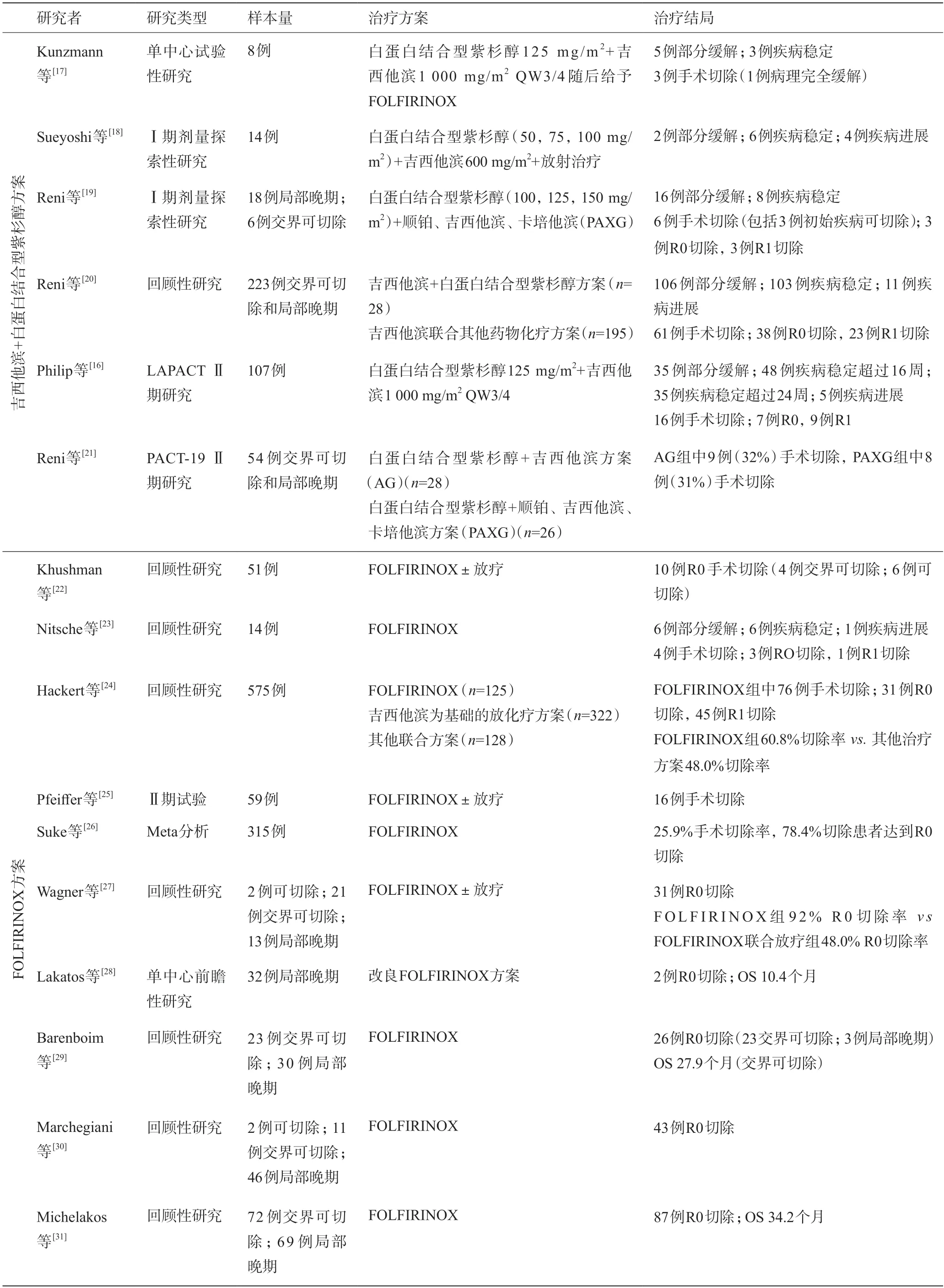
表5 局部晚期胰腺癌患者行吉西他滨+白蛋白结合型紫杉醇和FOLFIRINOX方案化疗的试验结果
同时,因为诱导治疗方案的不同,所需的诱导治疗时间也存在争议。目前在综合考虑常用化疗方案的起效时间,最大耐受剂量/周期,患者体力状况和潜在对手术安全性的影响下,一般认为不应超过6个周期[12](一般指6个月)。并建议在转化治疗过程中,每周期对患者进行一次再评估和重新分期,并由多学科团队根据结果讨论是否继续转化治疗或手术。
另外值得注意的是,即使同为局部晚期的胰腺癌患者也可能表现为截然不同的生物学行为:部分患者无论给予何种治疗都呈现出快速进展直至死亡,而另一些在诱导治疗或者姑息放疗后长时间稳定/不进展。因此,局部晚期患者的治疗选择不能仅仅依赖于肿瘤大小、淋巴结、远处转移和可切除性的解剖学定义,应更多考虑肿瘤的生物学行为,如CA199水平、体能状态、体重减轻和生化参数等[12,33-34]。
4.3 转化手术
转化手术的R0切除是延长局部晚期胰腺癌患者生存期的重要治疗方法[35],且绝大部分研究认为转化手术安全性与标准切除术相比没有统计学差异。因此,国际胰腺外科研究小组(ISGPS)强烈建议经过诱导治疗后,在有可能进行血管重建的情况下进行手术探查和切除,并对动脉和静脉侵犯/重建做出了说明[7]。
一般门静脉/肠系膜上静脉(PV/SMV)切除重建可分为四种常见类型:直接吻合、补片修补、自体血管重建、人工血管重建。四种方法各有优缺点,选择哪种切除重建方式主要取决于肿瘤大小及血管浸润程度。具体来说,肿瘤切除后静脉管腔狭窄<30%,首选直接吻合或补片修补,血管远期通畅率最高;管腔狭窄≥30%,切除静脉长度小于2~3 cm,可选择自体血管重建(推荐大隐静脉);否则选择人工血管重建[36]。大量文献荟萃分析结果显示:合并PV/SMV切除重建的胰腺癌根治性手术预后与标准手术切除在围手术期死亡率、并发症发生率、R0切除率及总体生存时间方面无明显差异[37-38]。但也有文献表明合并PV/SMV切除的患者围手术期死亡率增加,切缘阳性率更高,生存率更差[39],这可能与静脉切除组的疾病更晚期有关。
因动脉切除重建手术难度大,风险高,围手术期并发症和死亡率难以控制,术后患者无明显生存获益,所以是否行动脉切除重建存在很大争议。目前ISGPS共识不推荐术中合并动脉切除重建[7]。但随着新辅助治疗越来越多的应用于局部晚期胰腺癌的诱导治疗中,联合腹腔干切除的胰体癌根治术(DPCAR)显示出了良好的生存改善[40-41]。本中心经过多年摸索,在经过高度选择的局部晚期Ⅰ型和Ⅱ型的胰体癌患者中行新辅助治疗后的手术完成率、术后并发症发生率和围手术期死亡率均在临床可接受范围,且中位生存时间明显高于直接手术组[8,42]。
拟行转化手术前,充分的影像学评估是必不可少的。目前的影像学技术(胰腺动脉CTA/三维立体重建/PET-MRI等)使我们在术前评估血管浸润程度及判断能否切除重建都已成为可能,甚至允许术前就规划好手术入路和备好合适的人工血管等。因此,联合血管切除重建的转化手术应该是主动而不是被动的手术。但需要留意的是,由于化疗后间质纤维化、局部炎症粘连等问题,术前基于实体肿瘤疗效评价标准(RECIST)的影像学评估并不准确,可能导致不必要的血管切除重建,需要术者根据术中实际探查情况谨慎选择[43]。
4.4 “不可转化LAPC”的治疗
尽管诱导化疗在局部晚期胰腺癌患者的手术禁区迈出了一大步,但仍有70%的患者在治疗后因肿瘤无明显消退或持续局部进展而无法接受手术[44]。因此,针对局部晚期Ⅲ型,即“不可转化LAPC”患者的治疗显得尤为重要。目前可用于局部晚期胰腺癌的非手术治疗选择除传统的全身化疗、放疗外,还衍生出了许多局部治疗方法,包括:立体定向放射疗法(SBRT,即射波刀技术)、局部消融、高强度聚
焦超声(HIFU)和区域动脉内化疗(RIAC)等。其中,局部消融技术根据能量分为热消融技术和非热消融技术,前者包括射频消融(RFA)、冷冻消融(CA)、微波消融(MWA)等,后者主要为不可逆电穿孔(IRE,即纳米刀技术)和可逆电化学疗法(ECT)[45]。
立体定向放射疗法,即用多个三维设计的小照射野以单次大剂量定向照射靶区病灶,原理类似于利用放大镜将光线集中在一点,产生区域能量聚集以达到对靶区病灶的精确毁损作用。SBRT同时综合了3D适形放射技术(3D-CRT)的高生物有效剂量与强度调制RT(IMRT)的呼吸门控技术,常与化疗联合使用以改善肿瘤的局部控制。Kozak等[46]对接受SBRT治疗的局部晚期患者的19 项试验进行了系统评价和汇总分析,研究显示中位总生存期为17个月。但SBRT的临床应用也有诸多难题,各研究中心在照射总剂量和分割剂量上存在很大的异质性。通常认为使用总剂量范围为30~45 Gy,分3~5次,其有效生物剂量(BED)更高,可以产生更强的细胞破坏作用。其次是辐射相关并发症的问题,由于胰腺是一个腹腔深位器官,因此目标肿瘤剂量可能会被胰腺周围的其他器官接收,产生包括消化道溃疡和狭窄、十二指肠穿孔等在内的严重肠道毒性风险[47]。这些问题限制了SBRT的放疗次数,并要求SBRT治疗在一到两周内集中进行,从而减少化疗中断的时间,提高患者的依从性和疗效。
纳米刀技术使用超短高压直流脉冲在细胞膜上产生一个电场,此过程破坏膜稳态并不可逆地改变跨膜电位,从而激活凋亡途径并导致细胞死亡。纳米刀具有保留细胞外基质、关键血管结构、胆管和肠道的独特能力,并最大程度地减少热沉损伤。该技术除了细胞减灭能力外,还具有诱导全身免疫调节的能力。通过释放抗原和与损伤相关的模式分子(DAMPs),诱导肿瘤细胞凋亡和坏死后的全身性免疫反应,从而促进树突状细胞和其他抗原呈递细胞的成熟,这些细胞随后可以激活淋巴性T细胞,从而诱导持久的抗肿瘤效应。此外,这种效应可能导致远处转移的消退,这一过程被称为“远视效应”。这些作用与免疫疗法相结合可能提供一种全新的治疗方法[45],但其临床实际应用可能还有很长的一段路要走。
以上这些技术的出现和应用使得局部晚期患者的生存时间进一步延长,并有望使经联合治疗后肿瘤明显退缩的患者获得再次手术切除的机会。但这些技术中绝大多数缺乏高等级循证医学证据支持,更有部分是国外淘汰的技术拿到国内换个名称和包装再使用。因此,笔者中心通常采用SBRT作为优选治疗手段,无创/微创建议入组临床试验(如TTFiled电场治疗),不推荐有创治疗。
4.5 随访策略
ESMO指南中并未具体说明,仅强调关注症状、营养和社会心理的改善;ASCO指南推荐的随访周期为3~4个月,评估指标包括体格检查,肝肾功能,肿瘤指标和影像学检查;NCCN指南则对诱导化疗后切除患者的随访周期做了明确说明,建议术后2年内每3~6个月评估一次,评估指标应该包括体格检查,肿瘤指标和影像学检查。
这里要说明的是,由于不同指南更新的频次不一,表4所列的版本发布时间也不统一,目前只列出该指南发布时的建议,实际内容可能随着新版本的发布而更新。但从以上指南中的区别中我们仍能发现不同区域组织对待局部晚期胰腺癌的积极程度不一致,仍有许多问题等待进一步解决。
4.6 局部晚期治疗效果的再评估
目前,绝大多数肿瘤治疗的临床试验评价均以OS作为主要研究终点,其次是无疾病生存期(diseasefree survival,DFS)、无进展生存期(progression-free survival,PFS)和疾病进展时间(time to progress,TTP)作为次要终点。然而,目前局部晚期胰腺癌“诱导治疗+手术/化放疗/维持治疗”的复杂模式使单纯只依靠上述指标的评价模式不能完全反映整个治疗过程中出现的多种结局组合和重要事件。因此,除上述试验终点外,近期有研究提出采用无事件生存期(event-free survival,EFS)作为新的评价指标[48]。既往美国临床肿瘤学会将EFS定义为肿瘤复发或现有肿瘤进展的时间,美国国家癌症研究所将EFS定义为患者没有某些并发症或事件的时间,旨在预防或延迟这些并发症或事件。但在局部晚期的治疗过程中,要综合考虑手术和巩固治疗对总体生存的影响,因此,还应将终点概念扩展至:(1)未能在诱导治疗或手术结束后达到局部无疾病状态;(2)通过影像学检测发现疾病局部区域或远处复发;(3)死亡,详见图1。通过这样的描述,EFS终点可以更科学的评价局部晚期肿瘤的治疗效果,并可能在未来的研究中成为一个更有价值的研究终点,丰富甚至替代OS和生存质量(quality of life,QOL),加速临床研究的开展。
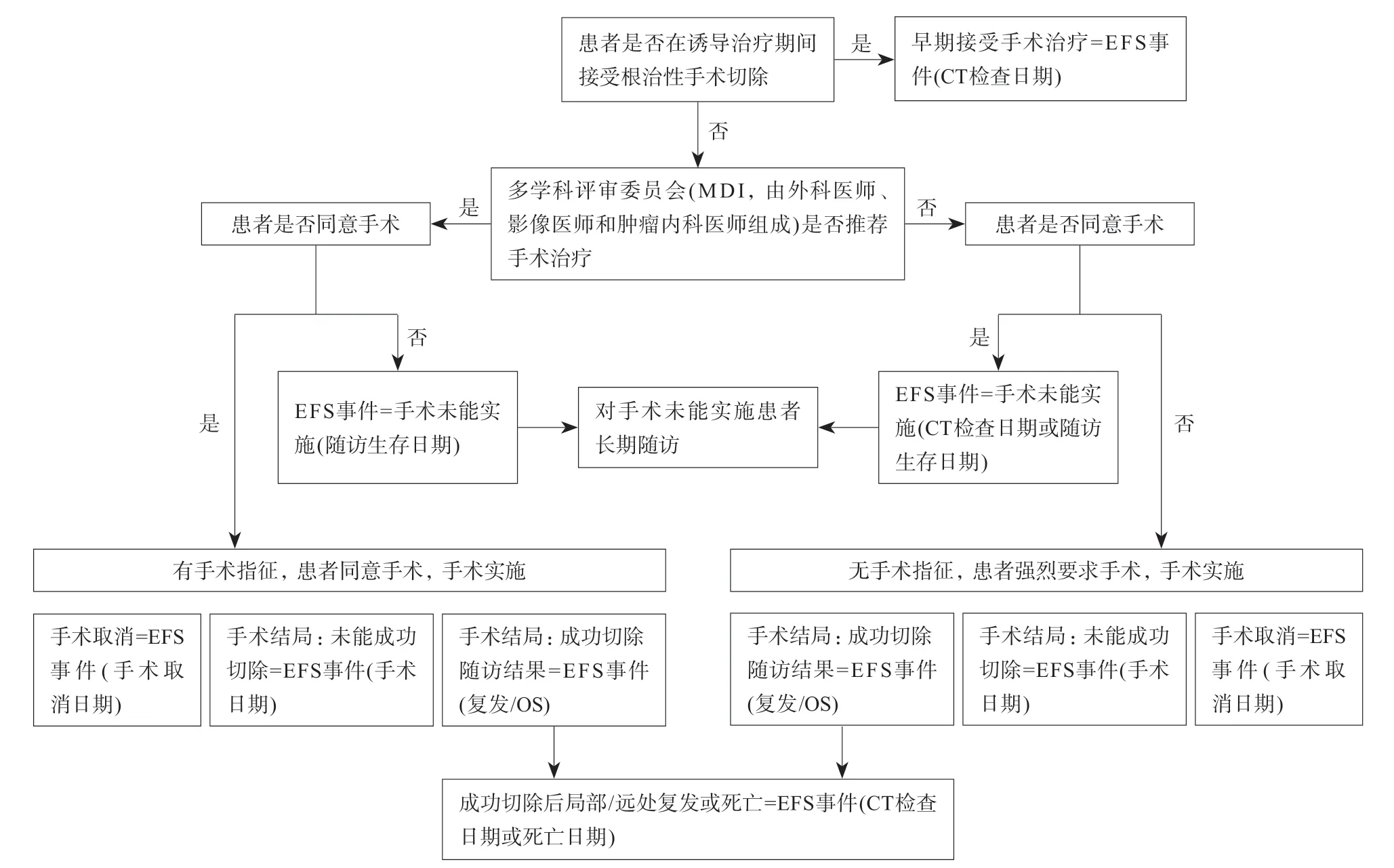
图1 LAPC中EFS的定义
综上所述,当和胰腺癌的全面战争真正缩小到“局部晚期”这个焦点战场的时候,“战术水平”的具体决策往往显得更为复杂。当前,其治疗要涉及多种治疗方案的选择,多个治疗阶段的衔接和最终总体治疗效果的评价,更加考验多学科团队的合作和综合实力。未来,局部晚期的最佳治疗模式需要更多替代研究终点,更科学的循证医学研究去证实。
