可切除或交界可切除胰腺癌新辅助治疗+手术与直接手术治疗的临床对比
2023-03-08易波杨召铭唐才喜赵志坚
易波,杨召铭,唐才喜,赵志坚
(中南大学湘雅医学院附属株洲医院 肝胆胰中心,湖南 株洲 412007)
胰腺癌为高度恶性的消化系统肿瘤,病情隐匿,预后极差,病死率居全球第四位[1]。根据2018 年全球癌症流行病学数据库预测,从2018年到2040年胰腺癌全球发病率和病死率均将呈现大幅度上升趋势。随着外科技术的进步,胰腺癌患者病死率有所降低,但总体生存时间仍无明显增加。目前约80%的患者在初诊时期就已经没有手术机会;并且对于可切除的胰腺癌,患者术后5年生存率也仅约20%。随着肿瘤综合诊疗理念的改变,新辅助治疗在胰腺癌中的应用逐渐引起重视。目前,新辅助治疗主要运用在交界可切除、可切除及部分局部进展期胰腺癌的治疗。新辅助治疗具备清除微小转移灶、提高肿瘤R0切除率以及评估患者化疗敏感性等理论优点[2]。近年来,国内外对于在胰腺癌手术前行新辅助治疗的安全性及对有效性进行了多项研究,但所得结论大有出入,难以形成广泛共识。本研究通过对本中心可切除或交界可切除的胰腺癌患者施行新辅助治疗+手术治疗,并与传统的直接手术治疗的有效性和安全进行比较分析,为临床选择提供一定参考,现报道如下。
1 资料和方法
1.1 一般资料
本研究为回顾性研究,研究对象为2016 年1 月至2018年12月在中南大学湘雅医学院附属株洲医院接受手术治疗的60例胰腺癌患者,其中接受直接手术治疗的患者30例(直接手术组),接受新辅助治疗+手术治疗的患者30例(联合治疗组)。本研究对患者术后展开随访调查,随访时间截止至2021 年12 月31日。两组患者入组时一般资料无统计学差异(P>0.05),详见表1。

表1 两组患者一般资料对比
纳入标准:(1)符合WHO胰腺癌诊断标准;(2)术前影像学及相关辅助检查判定为可切除或交界可切除胰腺癌,拟行手术治疗;(3)术前施行(或不施行)新辅助治疗,术后施行辅助放化疗。排除标准:(1)诊断为胰腺癌或已施行新辅助治疗后,患者拒绝行手术治疗;(2)胰腺切除手术后拒绝行辅助放化疗或未完整接受治疗;(3)新辅助治疗后因肿瘤进展无法行手术切除,或治疗过程中发生严重不良反应(包括接受放化疗后出现心肌梗死、十二指肠穿孔、多器官衰竭等危及患者生命的症状)而中断治疗;(4)随访期间失访。
1.2 治疗方法
直接手术组患者直接行手术治疗,术后2 周进行放疗,术后8周内进行化疗;联合治疗组患者在手术治疗前先进行新辅助治疗,术后2周再进行放疗,术后8周内进行放疗。具体操作如下。
1.2.1 两组患者手术治疗:帮助患者采取合适的体位,并对患者实施全部麻醉和气管插管,然后施行包括全胰切除术、胰头十二指肠切除术、胰体尾切除术、脏器切除术的手术治疗。
1.2.2 联合治疗组术前新辅助治疗:采取紫杉醇(哈药集团生物工程有限公司,国药准字H20059962,规格5 mL∶30 mg)及单药吉西他滨[齐鲁制药(海南)有限公司,国药准字H20113285,规格0.2 g(按吉西他滨计)×8支注射剂]静脉滴注化疗的方案,前者使用计量为125 mg/m2,后者使用剂量为1 000 mg/m2,第1、8、15天使用。或采取吉西他滨(1 000 mg/m2,第1、8 天)联合替吉奥(江苏恒瑞医药股份有限公司,国药准字H20100135,规格20 mg∶5.8 mg∶19.6 mg×14粒×3板胶囊剂,40 mg/次,2次/d,第1至14天)的化疗方案。
1.2.3 两组患者术后辅助治疗:采取序贯放化疗,具体如下。在手术治疗后2周进行放疗:首先对患者进行CT检测,以判断定位放疗区域;然后根据CT结果对患者进行个体化定位照射。其中直接手术组侧野剂量为15~18 Gy,总剂量为45~54 Gy,每次1.8~2.0 Gy,1次/d,5次/周;联合治疗组采取相同的方法实施同期放化疗,放疗剂量为36 Gy/15次;治疗2周停止1周,然后继续治疗,共治疗15次。术后8周内对患者行辅助化疗,单药吉西他滨(1 000 mg/m2,第1、8天)连用2周后休息1周,共治疗8个周期。
1.3 指标观察
(1)术后1年及3年生存率;(2)术后平均生存时间;(3)术后并发症发生率;(4)术后肿瘤复发转移率。
1.4 统计学分析
采用SPSS 22.0软件进行统计处理,本研究定量资料服从正态分布者以()表示,两组比较采用t检验,不服从正态分布者以中位数表示,采用Mann-WhitneyU检验;定性资料以率表示,采用χ2检验。两组生存曲线比较行Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后生存情况对比
Kaplan-Meier生存分析显示,两组总体生存情况有统计学差异(χ2=3.880,P=0.049),详见图1。联合治疗组术后1 年及3 年生存率均较直接手术组更高,术后生存时间较直接手术组更长,见表2。

表2 两组患者术后生存情况对比
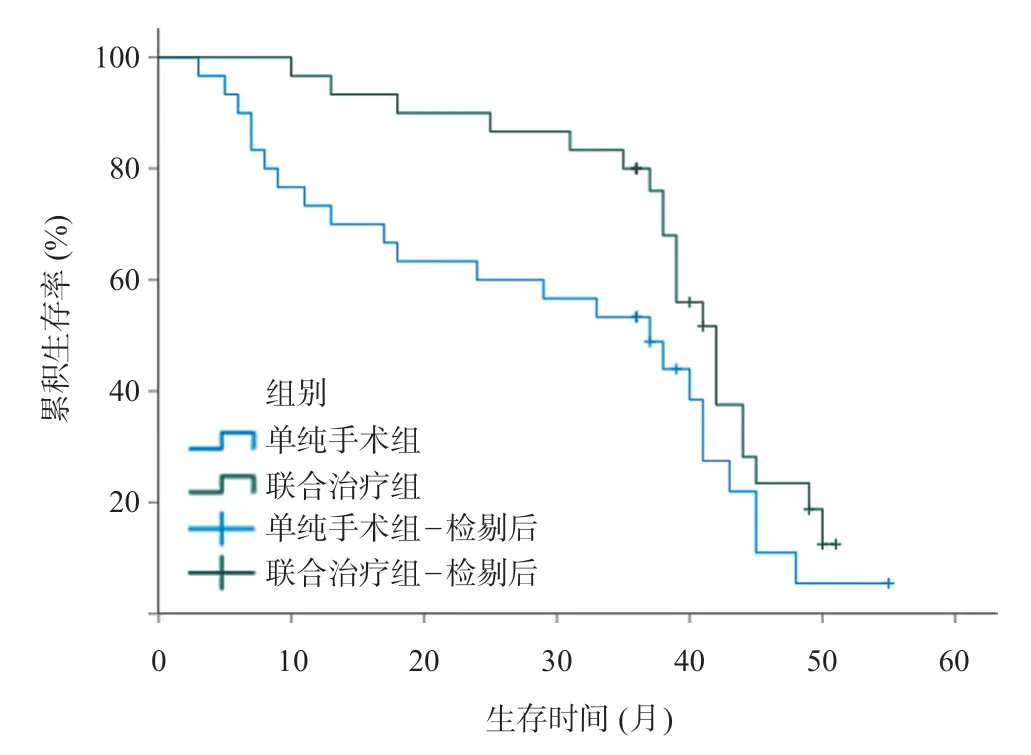
图1 单纯手术组与联合治疗组Kaplan-Meier生存曲线
2.2 两组患者术后并发症发生率对比
联合治疗组患者术后总体并发症发生率较直接手术组略低,但无统计学差异(P>0.05)。详见表3。
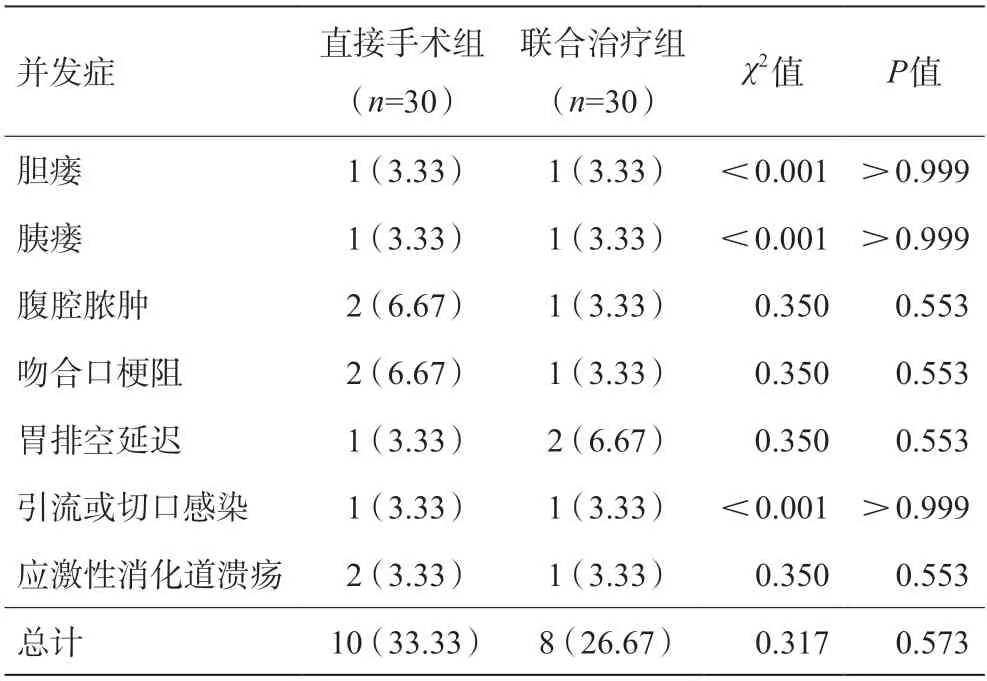
表3 两组患者术后并发症对比[例(%)]
2.3 两组患者术后复发率及转移率对比
联合治疗组患者术后复发率及转移率均较直接手术组更低,对比均有统计学差异(P<0.05)。详见表4。

表4 两组患者术后肿瘤复发及转移情况对比[例(%)]
3 讨论
手术是目前临床治疗胰腺癌最重要的方法,根据胰腺癌局部重要血管侵犯状况以及有无远处转移情况,临床将胰腺癌分为可切除、交界可切除、不可切除三种。其中对可切除胰腺癌的界定是[3]:(1)肿瘤未触及腹腔干、肠系膜上动脉或肝总动脉;(2)肿瘤未触及肠系膜上静脉或门静脉,或有触及但未超过180°,且静脉轮廓规则。而交接可切除胰腺癌的界定范围是:(1)肿瘤虽触及肝总动脉,但并未累及左右肝动脉起始部及腹腔干,可被完全切除重建;肿瘤触及肠系膜上动脉,但没有超过180°;肿瘤触及腹腔干未超过180°;肿瘤触及腹腔干超过180°,但未触及腹主动脉,且胃十二指肠动脉未受累;(2)肿瘤触及肠系膜上静脉或门静脉的范围>180°;或与肠系膜上静脉或门静脉的触及范围虽≤180°,但静脉轮廓不规则或合并静脉内血栓形成;受累部位的近端和远端血管正常,完整切除后可安全重建;肿瘤触及下腔静脉。对于交界可切除胰腺癌,术前新辅助治疗有助于提高R0 切除率,改善患者预后。而对于可切除胰腺癌,术前新辅助治疗能否提高患者的R0切除率及总体生存率仍有争议。有研究表明,术前新辅助治疗对可切除胰腺癌患者的中位生存期及R0切除率均无明显提高[4]。也有研究表明,术前新辅助治疗相对于直接手术可明显提高可切除胰腺癌患者的无瘤生存期及R0切除率[5]。本研究回顾性分析2016年1月至2018年12月在本中心接受手术治疗的胰腺癌患者,其中包括新辅助治疗联合手术治疗及直接手术治疗,结果表明新辅助治疗联合手术治疗相对于直接手术治疗,患者术后生存率明显提高,术后肿瘤复发及转移率更低,而肿瘤R0切除率及术后并发症发生率二者并无明显差异。
临床上对可切除或交界可切除的胰腺癌患者,国内外指南一般提议进行手术切除[6-7],但患者术后往往伴随肿瘤复发转移等,导致患者术后生存不佳。为提高胰腺癌患者的生存率,临床常采用术后放化疗的方式实施综合治疗,然而实际疗效不理想[4]。研究者进一步探讨术前新辅助治疗是否有利于降低术中、术后的癌细胞播散,从而达到提高胰腺癌R0切除率及预后的临床效果。目前术前新辅助治疗在许多胃肠道肿瘤的治疗中取得了显著的成果,可明显提高如食管癌[8]、胃食管交界/胃癌[9-10]及直肠癌[11]患者的生存率。针对胰腺癌患者,术前新辅助治疗在交界可切除及局部进展期胰腺癌的治疗中取得了良好的疗效,已被写入国内外指南中[7],得到了广泛应用,然而对于可切除胰腺癌患者术前新辅助治疗的应用目前尚存争议[3]。最近一项荟萃分析表明,新辅助治疗相较于直接手术可显著提高可切除胰腺癌患者的肿瘤R0切除率[12]。而一项新近研究也表明新辅助治疗可显著提高可切除胰腺癌患者的无瘤生存期并减少术后并发症的发生率[5]。胰腺切除术后的相关并发症主要为胰瘘,既往发生率高达20%左右[13]。而接受新辅助治疗后行胰腺切除术的胰腺癌患者术后发生胰瘘的几率极低,这可能与新辅助治疗诱发的胰腺纤维化有关[14]。尽管如此,目前仍未就新辅助治疗是否有益于可切除胰腺癌患者预后达成共识,期待更多高等级循证医学证据做支撑。
本研究存在如下不足:(1)本研究为回顾性分析,证据等级不高,所得仅为观察性结论;(2)根据指南,MDT团队需根据胰腺癌患者具体的临床信息进行评估,以决定其是否接受新辅助治疗及后续手术,本研究未能严格遵循标准方案,因此可能带来选择偏倚;(3)本研究缺乏对新辅助治疗具体方案毒性的评估及应对,缺乏数据完整性。
综上所述,新辅助治疗联合手术治疗相较于直接手术治疗能提高可切除或交接可切除胰腺癌患者的肿瘤R0切除率,减少术后相关并发症的发生,延长患者术后生存时间。
