高糖饲料中添加益生菌对松浦镜鲤生长性能、肠道消化酶和抗氧化酶活性及免疫基因表达的影响
2023-03-07李晋南王连生
李晋南 范 泽 吴 迪 王连生
(中国水产科学研究院黑龙江水产研究所,黑龙江省冷水性鱼类种质资源及增养殖重点开发实验室,哈尔滨150070)
与蛋白质和脂类相比,糖类物质是更经济、来源更广泛的能源物质,适量添加可以降低养殖成本,同时减少氮、磷排放,有利于减轻水产养殖对水环境的污染[1-2]。然而,鱼类被称为“先天性糖尿病患者”,研究表明,鱼类过多的摄入糖类物质,不仅会对其生长性能产生不利影响,也会损害肠道健康,使机体免疫功能下降,抗病力降低,严重的会导致养殖动物死亡[3-4]。在水产养殖领域,益生菌作为活体微生态制剂,因其天然、无污染等优点受到了越来越多研究者的关注[5-7]。当饲料中添加足够量的益生菌时,可以对宿主健康产生有益影响,其具有提高生长性能[8]、消化酶活性[9]、非特异性免疫功能[10]、肠道抗氧化能力[11]等功能。此外,在哺乳动物上的研究表明,摄入益生菌可以降低餐后血糖值,改善糖代谢异常[12]。但目前关于益生菌改善鱼类对饲料糖利用的研究还鲜有报道。
近年来,松浦镜鲤(Cyprinuscarpio)作为培育出的优良鲤鱼品种,因其具有体表无磷、含肉率高、生长速度快等优良的经济价值,已得到了广泛的推广。Wilson[13]对鲤鱼的研究表明,其利用淀粉的能力优于葡萄糖,饲料糖的最高耐受量为40%。因此,本研究以松浦镜鲤为研究对象,探讨在高糖饲料中添加4种不同益生菌对其生长性能和肠道健康的影响,旨在寻找安全、绿色的添加剂,促进水产养殖业的健康可持续发展,为糖类物质在饲料中的高效利用奠定理论基础。
1 材料与方法
1.1 试验动物及试验饲料
松浦镜鲤选自中国水产科学院黑龙江水产研究所呼兰实验站。以鱼粉、酪蛋白、豆粕为蛋白质源,淀粉为糖源,制成糖水平为45%、蛋白质水平为30%的基础饲料,将基础饲料作为对照组(G0组),其余4组分别在基础饲料中添加有效活菌数为1×108CFU/g的嗜酸乳杆菌(Lactobacillusacidophilus)(G1组)、动物双歧杆菌(Bifidobacteriumanimalis)(G2组)、鼠李糖乳杆菌(Lactobacillusrhamnosus)(G3组)和干酪乳杆菌(Lactobacilluscasei)(G4组)。试验饲料组成及营养水平见表1。饲料原料经粉碎过筛后,按表1配方准确称重配比,逐级充分混匀后,用双螺杆挤条机制成2 mm的颗粒饲料,制粒温度为(23±2) ℃,风干后存放于-20 ℃冰箱中备用。
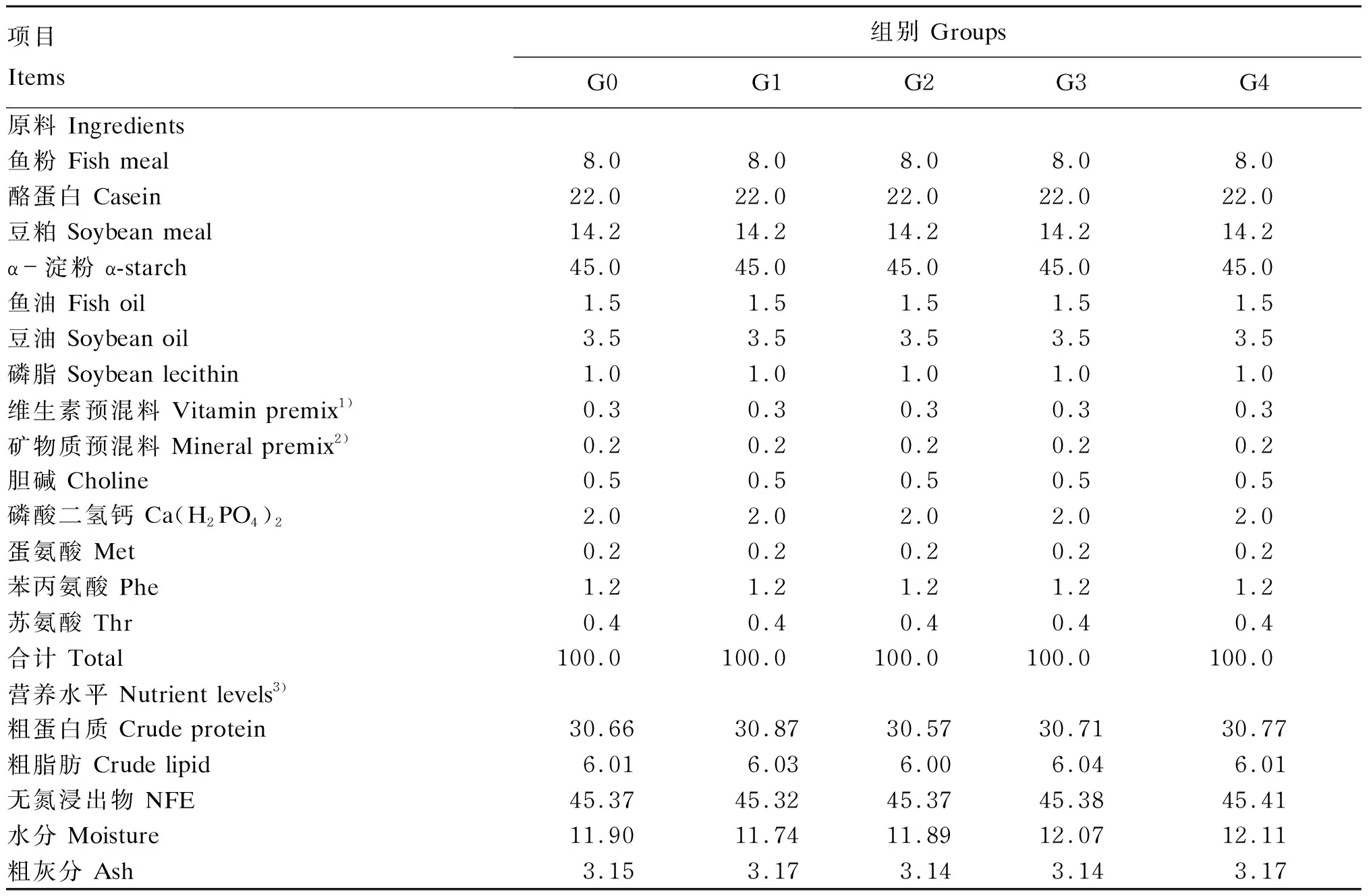
表1 试验饲料组成及营养水平(风干基础)
3) 营养水平为实测值。Nutrient levels were measured values.
1.2 试验设计与饲养管理
养殖试验在室内控温循环水族箱里进行,预饲2周后,选择规格均一的健康松浦镜鲤450尾,初始体重为(1.51±0.02) g,随机分为5组,每组设3个重复(30尾/缸)。每日饱食投喂3次(08:00、13:00和17:00),24 h不间断供氧,溶氧含量大于5.0 mg/L,温度为(23±1) ℃,试验周期为8周。每日吸除残饵和粪便,换1/3已曝气的水,观察并记录试验鱼摄食和死亡情况。
1.3 指标测定
1.3.1 生长性能测定
养殖试验结束后,试验鱼停食12 h,各组分别计数、称重。计算生长性能指标。
根据试验鱼体初重、末重、体长、内脏团质量、肝脏质量和肠道质量,计算增重率(weight gain rate, WGR)、饲料系数(feed conversion rate, FCR)、肥满度(condition factor,CF)、脏体指数(viscerosomatic index,VSI)、肝体指数(hepatosomatic index,HSI)和肠体指数(intestinal somatic index,ISI),具体公式如下:
增重率(%)=100×(Wt-W0)/W0;
饲料系数=F/(Wt-W0);
肥满度(g/cm3)=100×W/L3;
肝体指数(%)=100×Wh/W;
脏体指数(%)=100×Wv/W;
肠体指数(%)=100×Wi/W。
式中:W0为鱼体初重(g);Wt为鱼体末重(g);F为饲料摄入量(g);W为鱼体质量(g);L为鱼体长度(cm);Wh为鱼体肝脏重(g);Wv为鱼体内脏重(g);Wi为鱼体肠道重(g)。
1.3.2 体成分测定
每个重复随机取3尾鱼,用于检测体成分。采用烘干法(105 ℃)测定鱼体水分含量(GB/T 6435—2006);采用索氏抽提法测定粗脂肪含量(GB/T 6433—2006);采用550 ℃马弗炉灼烧法测定粗灰分含量(GB/T 6438—2007);采用凯氏定氮法测量粗蛋白质含量。
1.3.3 血清生化指标测定
每个重复缸随机取6尾鱼,用MS-222麻醉后,分别称量每尾鱼的体重和体长。尾静脉取血,置于无菌离心管中,4 ℃条件下3 000 r/min离心10 min,取血清分装后存于-80 ℃冰箱保存,用于检测血清中葡萄糖(glucose,GLU)、胆固醇(cholesterol,CHOL)和甘油三酯(triglyceride,TG)含量。血清生化指标由贝克曼ProCX4全自动生化分析仪测定。
1.3.4 肠道健康指标测定
在冰盘中迅速解剖并分离内脏团并称重,然后分离肝脏并称重。最后分离肠道,剔除肠道周围脂肪和内容物,用预冷的生理盐水洗净肠道,滤纸吸干水分,测量肠道重。将其中3尾鱼的肠道存于试管中,保存于-20 ℃冰箱中用于消化酶和抗氧化酶指标的检测。另外3尾鱼的肠道迅速置于液氮中,保存于-80 ℃冰箱中用于免疫基因相对表达量的检测。
1.3.4.1 肠道消化酶和抗氧化酶活性测定
肠道消化酶的测定:样品解冻后,加入9倍体积预冷的0.86%生理盐水进行匀浆(FJ-200CL高速组织匀浆机),4 ℃条件下3 000 r/min离心10 min,取上清液分装于1.5 mL离心管中,-20 ℃保存备用。胰蛋白酶活性采用福林-酚(Folin-phenol)法测定,淀粉酶和脂肪酶活性采用南京建成生物工程研究所试剂盒测定,具体方法参见试剂盒说明书。组织蛋白含量采用考马斯亮蓝法[14]测定。
抗氧化酶活性的测定:肠道抗氧化酶活性采用南京建成生物工程研究所试剂盒,用分光光度计或酶标仪进行测定,包括丙二醛(malondialdehyde,MDA)和一氧化氮(nitric oxide,NO)含量、总抗氧化能力(total antioxidant capacity,T-AOC)及总超氧化物歧化酶(total superoxide dismutase,T-SOD)、碱性磷酸酶(alkaline phosphatase,AKP)、总一氧化氮合成酶(total nitric oxide synthase,T-NOS)活性,具体方法参见试剂盒说明书。
1.3.4.2 肠道免疫基因表达测定
肠道样品置于液氮中研磨,利用Trizol法提取肠道总RNA,测定总RNA浓度和纯度,并进行反转录合成cDNA(PrimeScript RT Master Mix,TaKaRa)。免疫相关基因的Real-time PCR特异性引物见表2,所有引物由上海英潍捷基公司合成。根据SYBR Premix Ex Taq (TaKaRa)试剂盒说明书进行免疫相关基因相对表达量的检测,采用ABI 7500 Real-time PCR仪( Applied Biosystems,美国)进行分析。反应体系为20 μL:SYBR Premix Ex Taq(2×)为10 μL,上、下游引物各0.8 μL(0.4 μmol/L),ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA模板2 μL,补ddH2O至20 μL。β-肌动蛋白(β-actin)作为内参基因,使用2-ΔΔCt方法[15]进行数据分析,数据取3次重复的平均值。
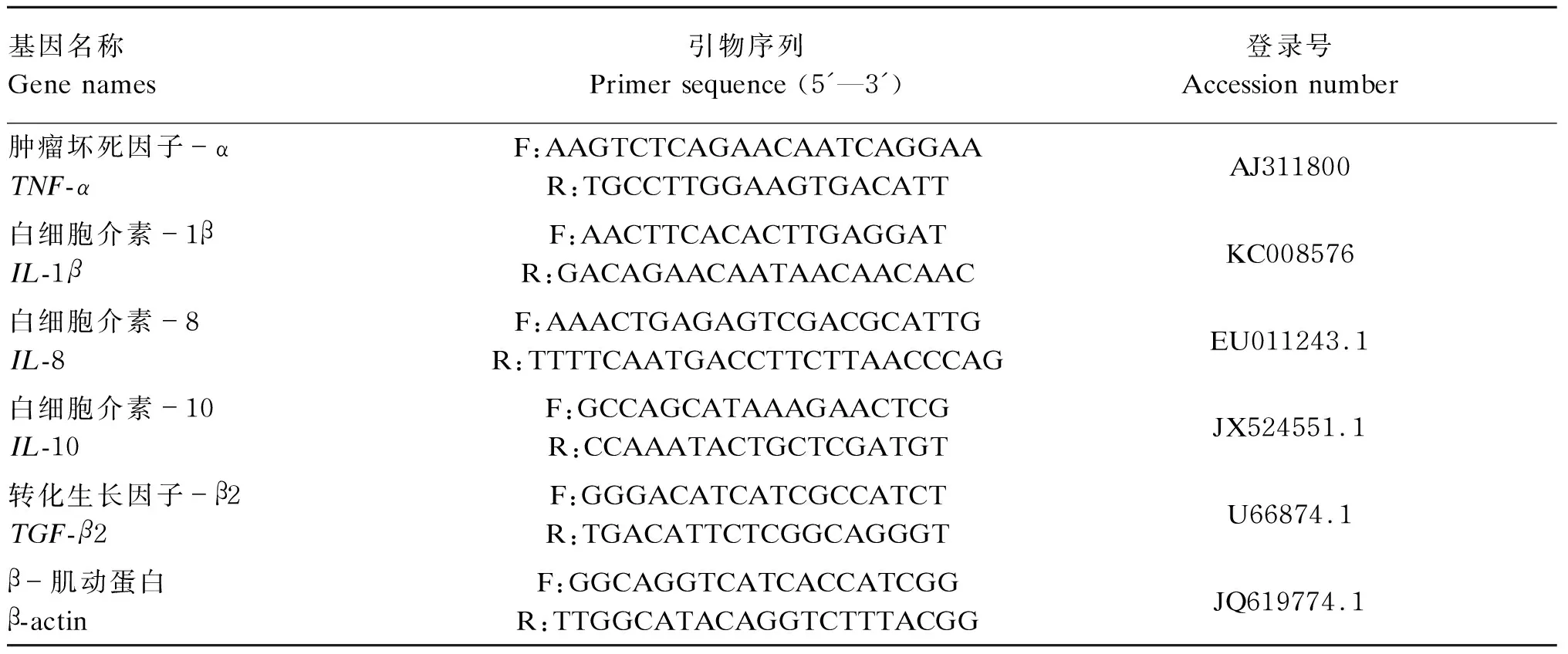
表2 免疫相关基因引物
1.5 统计分析
数据用平均值±标准差表示,利用SPSS 19.0统计软件进行单因素方差分析和Duncan氏法多重比较,P<0.05表示差异显著。
2 结 果
2.1 高糖饲料中添加不同益生菌对松浦镜鲤生长性能和血清生化指标的影响
由表3可知,与G0组相比,除G1组外,G2、G3和G4组松浦镜鲤的末重和增重率均显著提高(P<0.05),G2和G3组饲料系数显著降低(P<0.05);各组间肥满度没有显著差异(P>0.05);G2组的脏体指数、肠体指数和肝体指数为各试验组中最高,各添加组与对照组相比差异不显著(P>0.05)。
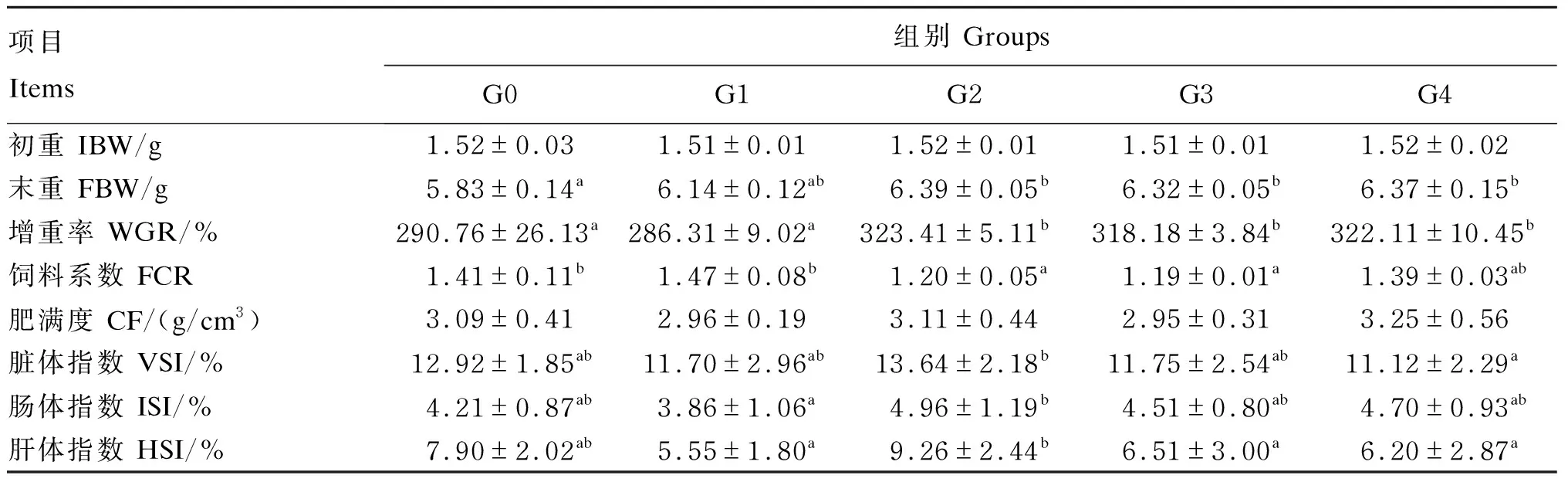
表3 高糖饲料中添加不同益生菌对松浦镜鲤生长性能的影响
由表4可知,G3组的血清GLU含量显著低于G0组(P<0.05),其他各组间血清GLU含量没有显著差异(P>0.05)。血清CHOL和TG含量各组间没有显著差异(P>0.05)。

表4 高糖饲料中添加不同益生菌对松浦镜鲤血清生化指标的影响
2.2 高糖饲料中添加不同益生菌对松浦镜鲤体成分的影响
由表5可知,与G0组和G2组相比,G4组全鱼的水分含量显著提高(P<0.05),粗脂肪含量显著降低(P<0.05);G2组全鱼粗蛋白质含量与G0组相比显著增加(P<0.05)。各组间粗灰分含量差异不显著(P>0.05)。

表5 高糖饲料中添加不同益生菌对松浦镜鲤体成分的影响
2.3 高糖饲料中添加不同益生菌对松浦镜鲤肠道消化酶活性的影响
由表6可知,与G0组相比,G2组肠道淀粉酶、胰蛋白酶和脂肪酶活性显著增加(P<0.05);G1和G3组肠道淀粉酶活性显著高于G0组(P<0.05)。
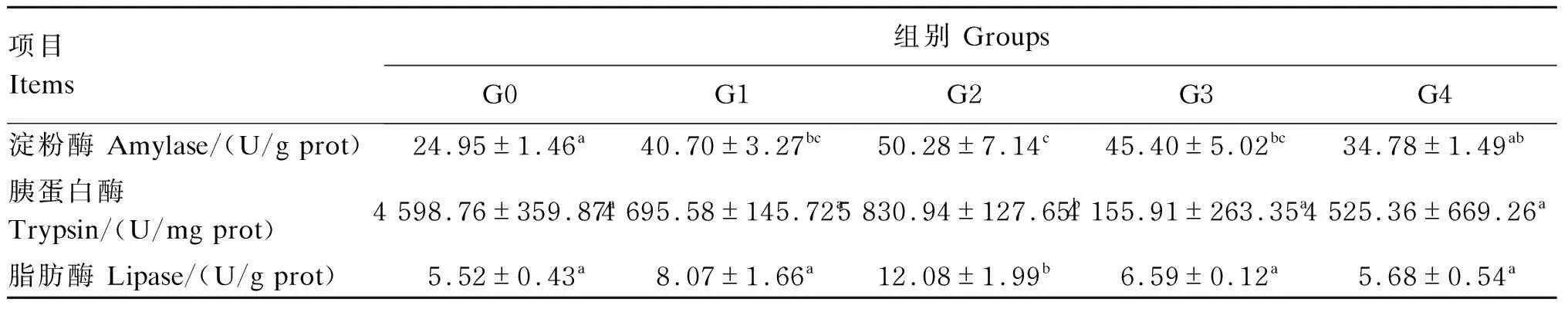
表6 高糖饲料中添加益生菌对松浦镜鲤肠道消化酶活性的影响
2.4 高糖饲料中添加不同益生菌对松浦镜鲤肠道抗氧化酶活性的影响
由表7可知,与G0组相比,各添加组肠道MDA含量均显著降低(P<0.05),同时显著增加肠道T-AOC(P<0.05),提高T-SOD活性(P<0.05)。G1、G3和G4组肠道AKP活性显著高于G0组(P<0.05)。G2、G3和G4组肠道NO含量显著高于G0组(P<0.05);G3和G4组肠道T-NOS活性显著高于G0组(P<0.05)。
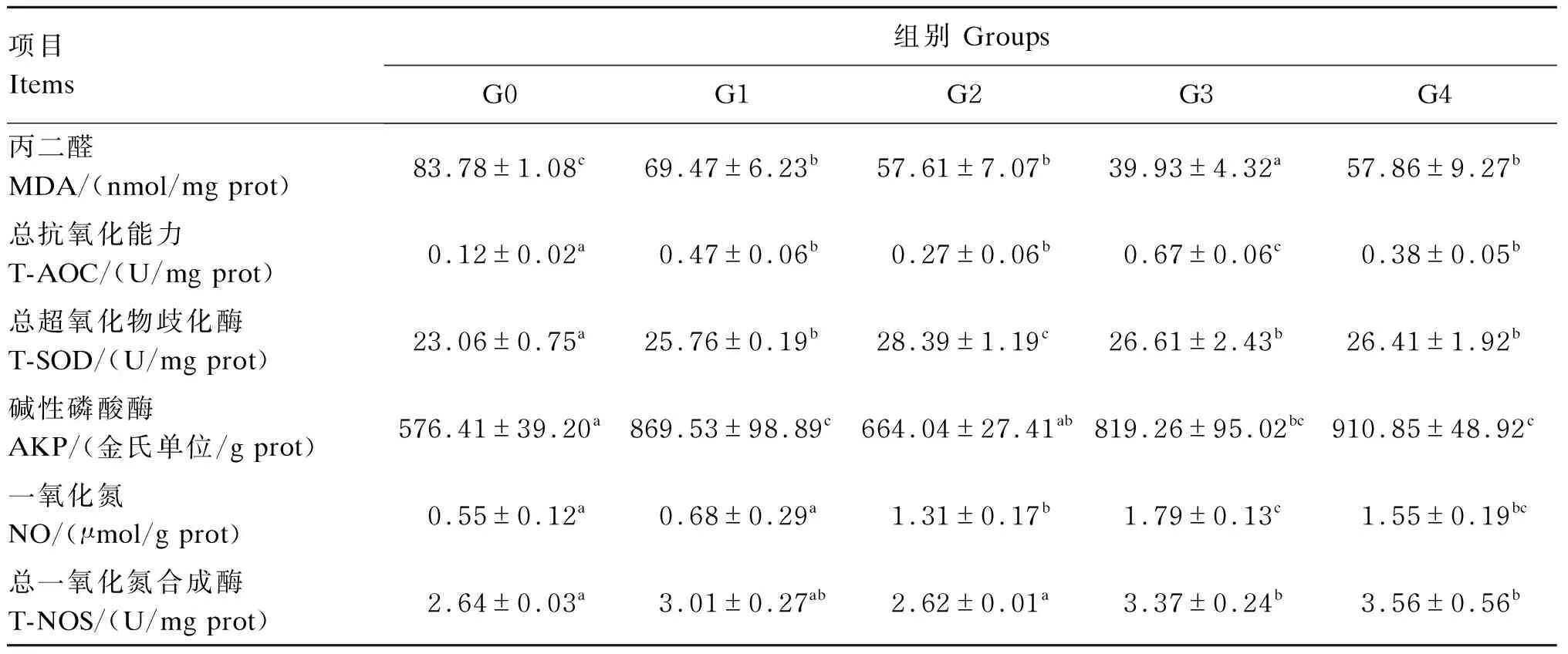
表7 高糖饲料中添加不同益生菌对松浦镜鲤肠道抗氧化酶活性的影响
2.5 高糖饲料中添加不同益生菌对松浦镜鲤肠道免疫基因相对表达量的影响
由图1可知,与G0组相比,各添加益生菌的试验组促炎因子白细胞介素-8(IL-8)和肿瘤坏死因子-α (TNF-α)基因相对表达量显著降低(P<0.05);除G3组外,其余益生菌添加组促炎因子白细胞介素-1β(IL-1β)基因相对表达量显著降低(P<0.05);转化生长因子-β2(TGF-β2)基因相对表达量在各试验组间没有显著差异(P>0.05),G1组的白细胞介素-10(IL-10)基因相对表达量显著高于其他各组(P<0.05)。

数据柱形标注不同小写字母表示差异显著(P<0.05)。
3 讨 论
3.1 高糖饲料中添加益生菌对松浦镜鲤生长性能的影响
本试验结果显示,高糖饲料中添加1×108CFU/g的动物双歧杆菌、鼠李糖乳杆菌、干酪乳杆菌均可以显著提高松浦镜鲤的末重和增重率,同时,饲料中添加动物双歧杆菌和鼠李糖乳杆菌显著降低了饲料系数。饲料中添加益生菌可以提高动物的生长性能,在牙鲆(Paralichthysolivaceus)[16]、大菱鲆(ScophthalmusmaximusL.)[17]、锦鲤(Cyprinuscarpio)[18]、黑鲷(Sparusmacrocephlus)[19]、尼罗罗非鱼(Oreochromisniloticus)[20]等水产动物上都有研究。但是,在本试验中,添加嗜酸乳杆菌对松浦镜鲤的生长性能没有显著影响,这一结果与大菱鲆[17]的研究结果类似,其研究显示添加嗜酸乳杆菌对养殖初期或中期的鱼体增重率有显著的影响,但在养殖后期增重率显著下降。吴志宏等[17]研究认为,其原因可能是过量添加嗜酸乳杆菌导致了鱼体内菌群结构失调,影响了鱼类的生长性能,或者是由于嗜酸乳杆菌在消化道内产生了过量的酶,抑制了体内内源酶的活性,降低了对营养物质的吸收作用,从而抑制了生长性能。李军亮等[21]在斜带石斑鱼(Epinepheluscoioides)幼鱼的研究中也发现,过量的添加嗜酸乳杆菌会降低生长性能。本试验中,除嗜酸乳杆菌没有提高松浦镜鲤生长性能外,其余3种益生菌均显著提高了松浦镜鲤的生长性能,其可能的原因是与嗜酸乳杆菌的添加剂量或投喂方式有关,需要进一步试验的验证。
鱼体的体成分可以反映鱼体对饲料营养物质的利用情况。本试验结果显示,饲料中添加动物双歧杆菌显著增加全鱼粗蛋白质的含量,这一结果与Sahandi等[22]和Mohapatra等[23]的研究结果一致。
3.2 高糖饲料中添加益生菌对松浦镜鲤消化吸收能力的影响
鲤鱼作为无胃鱼,肠道是其营养物质的主要吸收和消化的场所,肠道中分泌的消化酶活性则是衡量其消化能力的重要指标。本试验结果显示,高糖饲料中添加嗜酸乳杆菌、动物双歧杆菌和鼠李糖乳杆菌均显著增加肠道中消化酶的活性,这一结果与Mohapatra等[23]在南亚野鲮(Labeorohita)中的研究结果一致。动物双歧杆菌组肠道胰蛋白酶活性的增加提高了蛋白质消化能力,从而提高鱼体的生长性能和全鱼粗蛋白质的含量。李军亮等[21]对斜带石斑鱼的研究表明,其肠道消化酶活性及相关酶mRNA表达量随饲料中嗜酸乳杆菌的添加量增加呈先升高后降低的趋势。本试验高糖饲料中添加干酪乳杆菌并未改善肠道消化酶活性,其原因可能与其添加剂量有关。
3.3 高糖饲料中添加益生菌对松浦镜鲤肠道抗氧化功能的影响
抗氧化系统由1组抗氧化酶和1组低分子质量分子组成[24-26]。这种防御系统的重要组成部分是T-AOC、SOD和MDA等。MDA是脂质过氧化的产物,其含量的高低是细胞损伤程度的标志[27]。本试验中,各益生菌添加组肠道MDA含量显著降低,肠道T-AOC和T-SOD活性提高。有研究表明,过量的碳水化合物会导致鱼类持续高血糖,最终导致慢性应激[28],Zhao等[29]对大口黑鲈(Micropterussalmoides)的研究也表明,长时间的高糖摄入,会导致肠道抗氧化能力的降低。本试验结果说明,高糖饲料中添加适宜水平的益生菌可提高肠道的抗氧化能力,降低氧化损伤。赵瑞祯等[30]在刺参(Stichopusjaponicus)的研究中表明,益生菌组肠道MDA含量显著降低, SOD活性提高。AKP是机体免疫抗病必不可少的免疫酶[31],研究表明,其活性高低与鱼体的抗病力呈正相关[32]。本研究中,添加嗜酸乳杆菌、鼠李糖乳杆菌和干酪乳杆菌均显著提高肠道AKP活性。李咏梅等[33]在凡纳滨对虾(Litopenaeusvannamei)的研究中也得到相似的结果。T-NOS在机体免疫物质诱导下会释放大量的NO,生成的NO在机体免疫系统中的作用十分重要[34]。本试验结果显示,高糖饲料中添加动物双歧杆菌、鼠李糖乳杆菌和干酪乳杆菌显著提高肠道NO的含量,说明益生菌可以通过提高机体的NO含量来提高机体的免疫功能。
3.4 高糖饲料中添加益生菌对松浦镜鲤免疫指标的影响

4 结 论
综上所述,在高糖饲料中添加动物双歧杆菌、鼠李糖乳杆菌、干酪乳杆菌可以显著提高松浦镜鲤生长性能,同时提高肠道消化酶活性及抗氧化指标,以及肠道免疫功能。
