赊店老酒窖池中产己酸菌分离鉴定及产酸条件研究
2023-03-07张惠芳张婉莹周索周业皓谭莹孙君珂柯涛胡凡
张惠芳,张婉莹,周索,周业皓,谭莹,孙君珂,柯涛*,胡凡
(1.南阳师范学院生命科学与农业工程学院,河南省生物质资源化高校工程中心,河南南阳 473000)
(2.赊店老酒股份有限公司,河南南阳 473000)
(3.自然资源部第三海洋研究所海洋生物资源综合利用工程技术研究中心,福建厦门 361005)
浓香型白酒中己酸乙酯的含量要远比其他香型白酒中含量高,是浓香型白酒区别于其他香型白酒的主体香成分[1,2]。窖泥己酸菌(以下简称己酸菌)是以醇、乳酸、葡萄糖、D-半乳糖等为碳源,发酵积累己酸的微生物的统称,是关键性功能菌,在己酸或己酸乙酯的积累过程中起着决定性作用。通过发酵体系中微生物酶的催化作用使己酸与乙醇缩合生成己酸乙酯,这是浓香型酒窖内发酵的主要生香途径[3]。在这一途径中,己酸是形成己酸乙酯的前体物质,而己酸菌是窖泥中产生己酸的土壤细菌,因此筛选培养己酸菌是浓香型白酒生产中关键一环[4-7]。目前文献中已报道的己酸菌主要来自于梭菌纲梭菌属等菌属,近年来研究发现有越来越多的菌属也可以产己酸,多种不同菌属的菌群可能有共生或者互生的关系[8-15]。董蔚等[16]考察浓香型基酒中负责“烤香”和“窖香”的关键香气化合物及其交互作用,结果表明,己酸、丁酸、4-甲基苯酚、3-甲基吲哚和3-甲硫基丙醛5种香气化合物为负责“窖香”和“烤香”的关键香气化合物,证明在浓香型基酒中负责“烤香”与“窖香”的关键化合物间存在掩盖或加成作用。因此制作人工窖泥过程中应尽量引入多种可产生不同香气物质的菌种,而不是单一菌种,可丰富浓香型基酒的香气物质种类。为考察赊店老酒老窖池中产己酸菌的组成情况及筛选出更多的产己酸的菌种,本研究从赊店老酒老窖池中取窖池黄水和窖池窖泥作分离样品,分离筛选出己酸产量较高的己酸菌株,经过多轮筛选和优化,研究不同条件对己酸菌产酸量的影响,并通过分子鉴定获得产己酸和丁酸菌株的多样性情况,为窖泥人工培养和赊店老酒浓香型大曲酒的质量提高打下基础。
1 材料与方法
1.1 样品
样品来源于赊店老酒酒厂1号车间的窖池,窖龄均为50年左右。采样为窖底泥和窖池黄水。
1.2 培养基的配制
分离及富集培养基(巴氏合成培养基,m/m)[17]:乙酸钠0.5%,硫酸镁0.02%,磷酸氢二钾0.04%,硫酸铵0.05%,酵母膏0.1%,琼脂2%,乙醇2%,碳酸钙1%(碳酸钙干热灭菌,乙醇和碳酸钙在接种时 加入)。
发酵培养基(m/V):乙酸钠0.5%,酵母膏0.1%,磷酸氢二钾0.04%,硫酸铵0.5%,硫酸镁0.02%,碳酸钙1%,鲜酒糟10%,酒尾3%,乙醇2%。
1.3 试剂
DNA Maker(DL2000)、Taq酶、10× PCR buffer、dNTP、通用引物27F、1492R、细菌16S rDNA细菌基因组提取试剂盒,上海生工生物工程有限公司;正己酸、正丁酸、己酸乙酯、丁酸乙酯标准品,天津市精细化工研究所。其余所用化学试剂均为分析纯。
1.4 窖泥微生物的富集培养与己酸菌的初筛
窖泥己酸菌大多能生成芽孢,其孢子具有耐热性,而其营养细胞不耐热。取5 g老窖泥或黄水85 ℃加热处理10 min,淘汰较弱的芽孢,并同时杀灭营养细胞和其它杂菌,以达到纯化窖泥己酸菌的目的。冷却后加入富集培养基35 ℃厌氧培养7 d后,挑选出产气较早、较多的试管,对富集菌液再次进行热处理,冷却后按15%(V/V)的接种量接种于装有新鲜富集液体培养基的试管中,35 ℃厌氧培养7 d,选取产气泡好的富集液经适当稀释,在分离培养基上,采用夹层法厌氧培养[4,18,19],观察菌落形态。
1.5 己酸菌的复筛
挑选平板上的单个菌落移入发酵培养基试管中厌氧培养14 d,并结合发酵液的感官、硫酸铜显色、产气情况和浑浊度等指标,确定复筛菌株。对被确定为复筛的菌株再次进行单菌落分离,并对各单菌落进行 发酵试验(35 ℃,14 d),然后选取有酯香味、产气较多的浑浊发酵液进行己酸的气相色谱测定,选取己酸产量高的菌株。复筛后菌株经革兰氏染色后微分干涉显微镜观察细胞形态鉴定、保存。
1.6 硫酸铜显色法
取己酸发酵液2.0 mL,然后依次加入2.0 mL的2%硫酸铜溶液和1.0 mL的乙醚,充分振荡,使之反应分层,此时观察乙醚层呈现的蓝色(深浅程度),颜色越深,己酸含量就越高[20]。
1.7 气相色谱法测定丁酸和己酸
吸取10 mL培养成熟的己酸菌液样品于25 mL具塞比色管中,加0.5 mL色谱纯甲酸进行酸化,加乙醇至25 mL,在12 000 r/min、4 ℃条件下进行冷冻离心 5 min,取上清液,过0.2 μm微孔滤膜。进样前将样品和内标1:1混匀。色谱仪为安捷伦公司7820A型气相色谱仪,色谱柱为安捷伦CP-Wax 58 FFAP CB毛细管色谱柱,载气为高纯氮气,燃烧气为H2。内标为以25%(V/V)乙醇配制的1 000 mg/L的2-乙基丁酸。柱温初始温度70 ℃保持2.5 min后,以10 /min℃ 程序升温至180 ℃,保持3 min。进样口温度210 ℃,检测器温度210 ℃,柱前压0.06 MPa,尾吹6 mL/min,分流比35:1,进样量为0.5 μL,N2000色谱工作站,采用保留时间定性,内标法定量。
1.8 乙酸钠浓度对产酸的影响
从筛选到的产丁酸和己酸的菌株中挑选8株菌株分别接种到乙酸钠浓度为0.5%、1.0%、1.5%(m/V)的发酵培养基中培养,通过丁酸和己酸总量比较分析乙酸钠浓度对菌株产丁酸和己酸总量的影响。
1.9 氧气对产酸的影响
从筛选到的产丁酸和己酸的菌株中挑选己酸含量高的38株菌株,分别在厌氧培养箱和普通培养箱中,35 ℃条件下培养14 d,发酵液离心去除菌体后,经过过滤处理后,气相色谱法检测其丁酸和己酸含量,计算厌氧条件下和好氧条件下丁酸和己酸总量的比值,研究氧气对菌株产丁酸和己酸总量的影响。
1.10 培养温度对产酸的影响
从上述筛选的38株菌株中挑选己酸含量高的30株菌株,分别在30 ℃条件下和37 ℃条件下厌氧培养14 d,发酵液离心去除菌体后,经过过滤处理后,气相色谱法检测其丁酸和己酸含量,计算不同温度条件下丁酸和己酸总量的比值,比较培养温度对菌株产丁酸和己酸总量的影响。
1.11 PCR扩增及系统发育树的构建
挑取单菌落于巴氏合成培养基中,35 ℃条件下培养3 d,10 000 r/min高速离心1 min,收集菌体沉淀。采用细菌基因组DNA提取试剂盒提取细菌DNA,以其为模板,利用16S rRNA基因通用引物27F(5'-AGAGTTTG ATCCTGGCTCA-3')和1492R(5'-GGTTACCTTGTTA CGACTT-3')进行PCR扩增(94 ℃预变性5 min,95 ℃变性45 s,60 ℃复性45 s,72 ℃延伸1 min,30个循环)。利用1%琼脂糖电泳检测扩增产物,将扩增产物送至公司测序(上海生工)。将测得的细菌16S rRNA基因序列在NCBI数据库中进行BLAST比对分析,并将测定菌株的 16S rRNA基因序列与其同源性最高的序列采用Mega 5.0软件中的邻接法(Neighbor-Joining,NJ)进行系统发育分析。
1.12 菌株拮抗对峙实验
将不同菌株在巴氏合成培养基平板两两交叉划线,35 ℃条件下培养2 d,观察交叉处是否正常生长,判定两菌株是否有拮抗关系。
1.13 发酵时间对产酸及细胞生长的影响
从筛选到的产丁酸和己酸菌株中挑选5株高产菌株接种到发酵培养基中,逐级扩大接种到生产用的 1 000 L大缸中厌氧培养,35 ℃培养18 d,每隔3 d取样,通过气相色谱法检测乙酸、丁酸、己酸含量,研究不同发酵时间对己酸菌产酸的影响。取样进行梯度稀释涂平板法计细胞数。每个样品重复计数3次后取平均值[14]。根据检测结果绘制生长曲线。
1.14 数据分析
实验数据采用Excel 2019进行整理,采用SPSS 22.0进行单因素方差分析、皮尔逊相关系数分析,采用Origin 2019b进行作图。
2 结果与讨论
2.1 菌种筛选
把经过富集后的培养液稀释涂布平板,根据涂布平板的菌落形态,挑取疑似己酸菌的菌落划线纯化培养,通过CuSO4显色法初筛共获得118株疑似己酸菌。对初筛获得的菌株进行半固体穿刺培养,观察己酸菌的厌氧情况。厌氧性试验结果显示,其中有9株为好氧菌,只在接触空气的表面生长;有1株为厌氧菌,只在培养基内部生长,接触空气的位置不生长;其余均为兼性厌氧菌。菌落形态主要有圆形,规则或不规则边缘,颜色多为白色或乳白色。多数为长杆状和短杆状两种形态,并有鼓槌状的芽孢,大部分都具有良好的游动性,符合己酸菌的基本形态。将筛选出的菌株接种到液体培养基中培养14 d,发酵液过滤后经过处理,采用气相色谱法测定丁酸、己酸含量,计算己酸和丁酸的总和,共有96株菌株可产己酸和丁酸。其中有8株己酸与丁酸的比大于1,总酸含量最高可达到7.8 g/L。另外有3株菌株完全不产己酸,只产丁酸。不同菌株所产己酸及总酸的相对频率分布图如图1。
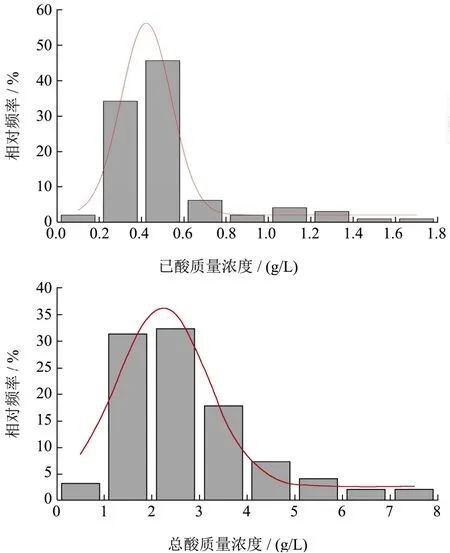
图1 不同菌株产己酸、总酸的相对频率分布图Fig.1 Relative frequency distribution of caproic acid and total acid productions of different species
由己酸相对频率分布图可知,大部分菌株产己酸量集中在0.2~0.6 g/L,相对频率达到80.21%,最高产量为1.69 g/L,相对频率为1.04%。由总酸相对频率分布图可知,总酸量集中在1~3 g/L,相对频率达到63.54%,产总酸量3~6 g/L的相对频率为29.17%,最高产量7.8 g/L。
2.2 乙酸钠浓度对产酸的影响
在产己酸和丁酸菌株中选取其中8株菌株,分别在乙酸钠浓度为0.5%、1.0%、1.5%(m/V)的发酵培养基中培养14 d,气相色谱法检测丁酸与己酸产量,通过丁酸与己酸的总酸含量,考察培养基中乙酸钠浓度对总酸的影响(图2)。结果表明,8个菌株均在乙酸钠浓度达到1.0%时总酸量最高,乙酸钠浓度为1.5%时,总酸含量降低。不同乙酸钠浓度对产总酸量影响显著(P<0.01),说明合适的乙酸钠浓度影响丁酸和己酸的产量。乙酸钠作为己酸菌生长过程中必需的物质,是以乙酸根的形式参与反应,与丁酸一起合成己酸。当乙酸钠浓度小于1.0%时,乙酸根不足,导致己酸合成量下降。同时,乙酸钠还是己酸菌生长的重要碳源。乙酸钠浓度小于1.0%,碳源不足,限制了己酸菌生物量的增加,影响了己酸菌代谢产酸,导致丁酸、己酸产量减少。当乙酸钠浓度大于1.5%时,培养基pH过低,影响细菌的生长,因此产酸量降低,所以合适的乙酸钠浓度为1%。

图2 乙酸钠浓度对总酸的影响Fig.2 Effect of sodium acetate concentration on acid production
2.3 氧气对产酸的影响
从96个菌株中挑选己酸含量高的38株菌,分别在普通培养箱及厌氧培养箱条件下培养14 d,检测丁酸和己酸产量并将二者之和记为总酸量,以厌氧条件培养时总酸量与好氧条件培养时总酸量之比为纵坐标作图,观察氧气条件对产酸的影响(图3)。实验表明38株菌中,28株菌厌氧条件产酸量与好氧条件产酸量之比大于1,即74%的菌株在厌氧条件下产总酸量要高于好氧条件下产总酸量,26%的菌株厌氧条件下产总酸量低于好氧条件下产总酸量。其中,14株菌厌氧条件产酸量达到好氧条件产酸量的2倍及以上,4株 菌两者比值可以达到4倍及以上,最高为6.4倍,说明大部分菌株在厌氧条件下更有利于丁酸和己酸的产生,这与多数研究结果一致。在窖池发酵过程中,经过长时间的驯化,窖池内形成独特的厌氧环境,微生物类群以细菌为主,且以厌氧及兼性厌氧菌为主,厌氧条件下更有利于多数菌代谢产酸。
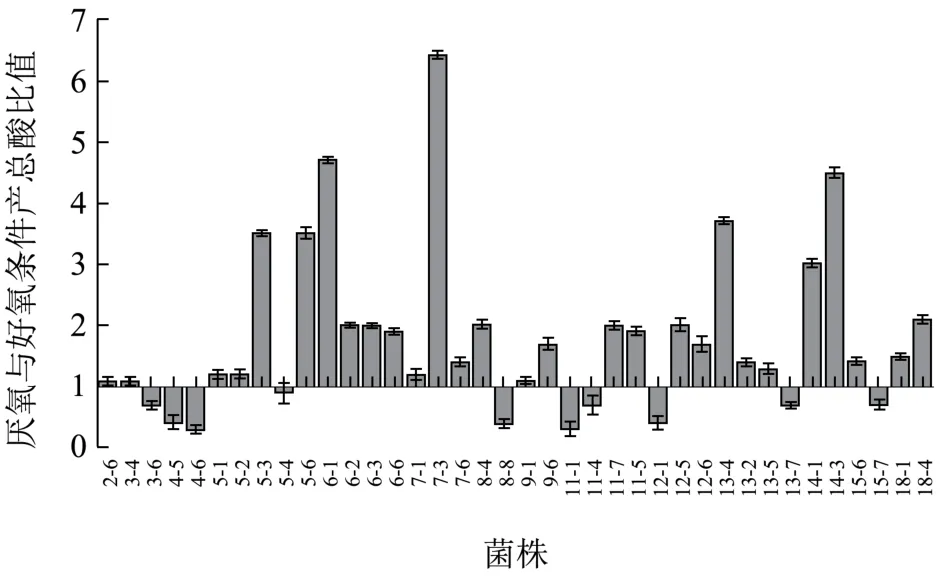
图3 氧气对产酸的影响Fig.3 Effect of anaerobic conditions on acid production
2.4 培养温度对产酸的影响
从上述38株菌株中挑选己酸含量高的30株菌,分别在30 ℃和37 ℃条件下厌氧培养14 d,检测丁酸和己酸产量并将二者之和记为总酸量,以30 ℃培养时总酸量与37 ℃培养时总酸量的比值为纵坐标作图,观察温度对产酸的影响(图4)。结果表明30株菌中,19株菌30 ℃产酸量与37 ℃产酸量之比大于1,即63%的菌株在低温时产总酸量高于高温时的总酸量,33%的菌株37 ℃时产总酸量高于30 ℃条件下产总酸的量。其中,8株菌两者之比达到2倍及以上,最高为4.4倍,表明大部分菌株适合低温条件下产酸。多项研究表明,较低的温度有利于窖池中产酸产酯的代谢过程,特别是有利于己酸、丁酸、己酸乙酯、丁酸乙酯及总酯的增加。30 ℃下,更适合多数窖泥己酸菌的生长、繁殖及代谢,使产酸量提高,白酒质量提高。
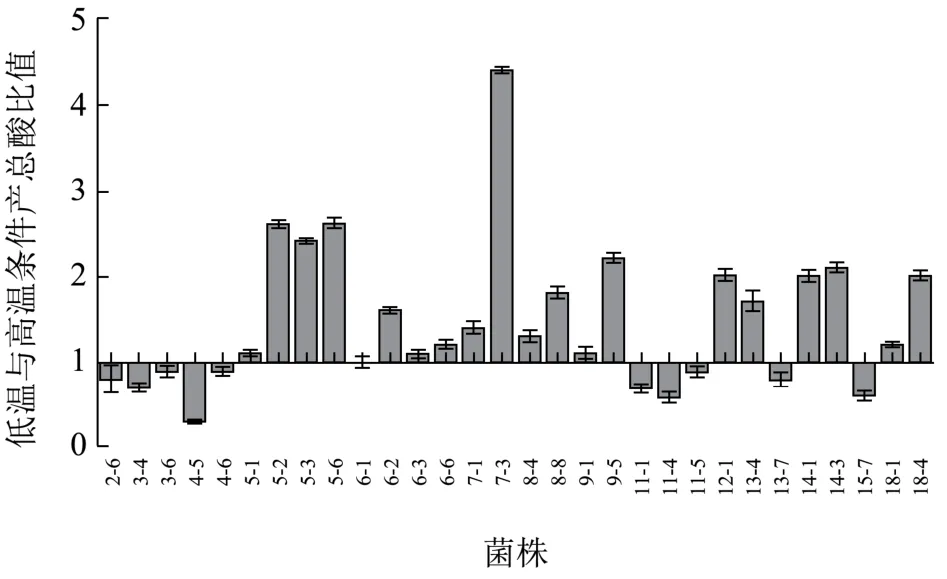
图4 培养温度对产酸的影响Fig.4 Effect of temperature conditions on acid production
2.5 分离菌株分子生物学鉴定及形态学观察
在30株菌株中挑取己酸含量高的10株菌株进行分子鉴定。提取总DNA后PCR扩增16S rRNA基因并测序。将测定细菌的16S rRNA基因序列提交NCBI进行在线比对分析及系统发育树分析(见表1),其中包括3株赖氨酸芽孢杆菌属(Lysinibacillus),3株芽孢杆菌属(Bacillus),2株寡养单胞菌属(Stenotrophomonas),1株棒杆菌属(Corynebacterium),1株拉梅尔芽胞杆菌属(Rummeliibacillus)。在巴氏合成培养基上,35 ℃培养3 d,光学显微镜下观察菌体形态。10个菌株除了寡养单胞菌属,大部分为革兰氏阳性菌,杆状,单个或链状排列,有芽孢(图5)。产酸主要包括丁酸、己酸和少量的乙酸。10个菌株均为兼性厌氧的菌属,兼性厌氧菌种更容易培养,在人工窖泥培养过程中,可节约培养成本,降低培养难度,提高窖泥培养效果。拮抗对峙实验结果表明10个菌之间均无拮抗作用,因此都可以进行混合培养。

图5 菌株细胞形态Fig.5 Cell morphology of strains
2.6 发酵时间对产酸及细胞生长的影响
从以上菌株中选取5株高产己酸菌株,分别为3-4、8-8、11-5、13-7、5-2,逐级扩大接种到生产用的1 000 L大缸中,在35 ℃的条件下厌氧发酵培养 18 d,每隔3 d取样一次。发酵液经过滤处理后气相色谱法检测己酸和丁酸含量,同时做梯度稀释平板计数,取平均值,计算菌浓度,研究其产酸及细胞生长随培养时间的变化规律(图6)。
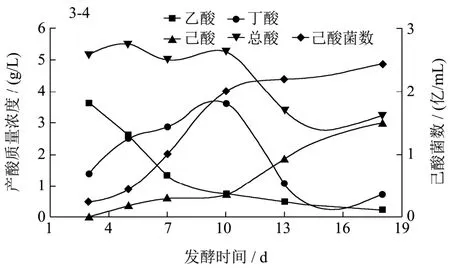
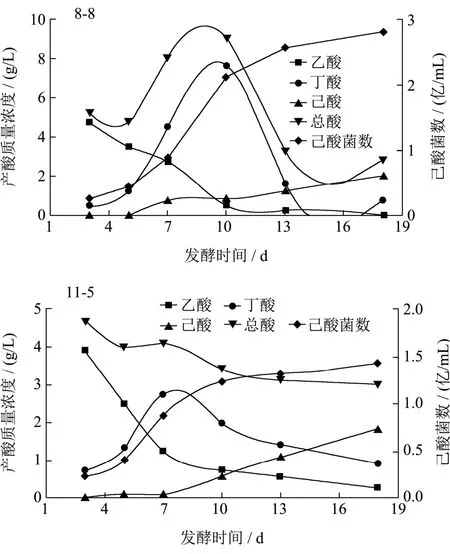
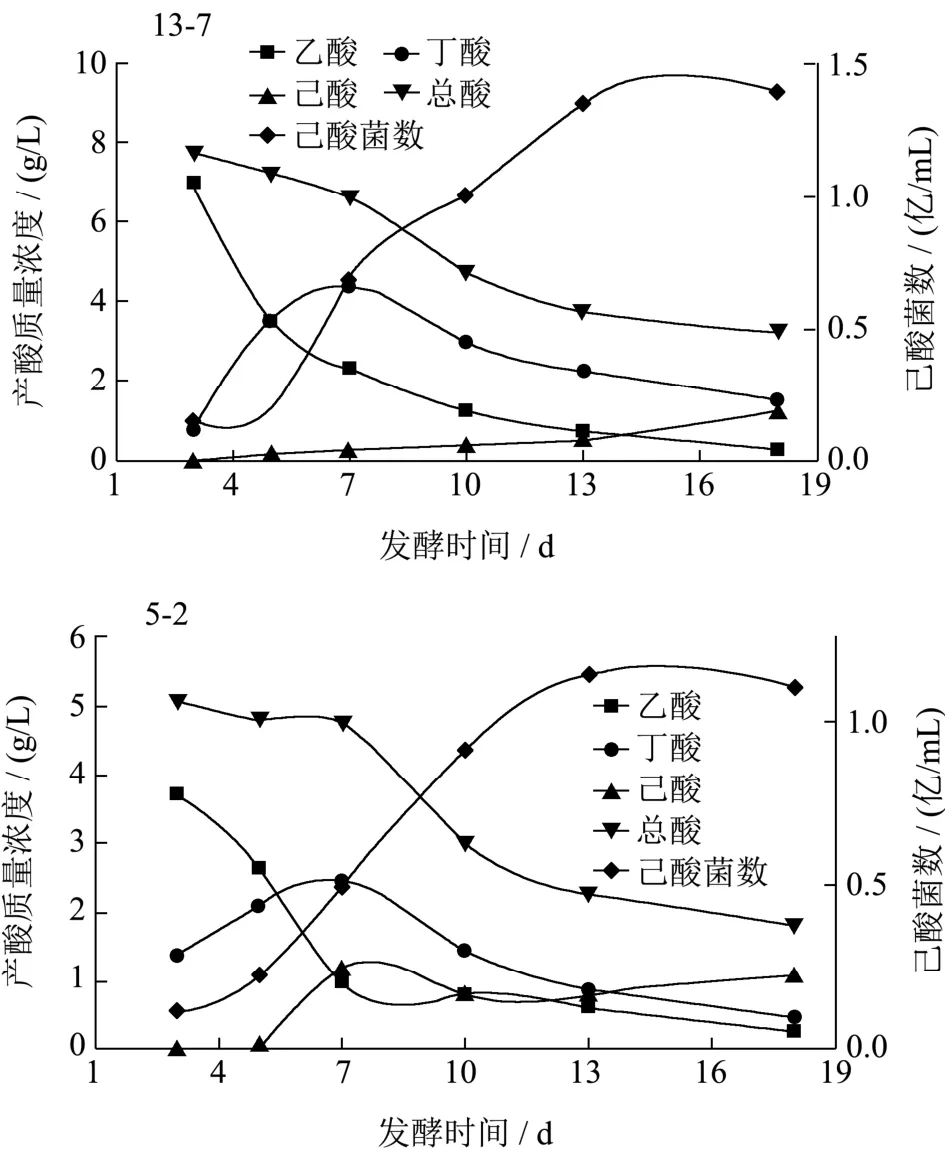
图6 发酵时间对产酸及细胞生长的影响Fig.6 Effect of fermentation time on acid production and cell concentration
5个菌株的变化趋势基本相似,在发酵周期18 d内,菌浓度逐步增加,而总酸量则随着培养时间逐渐降低。主要原因为乙酸含量逐步降低,而己酸含量则随着培养时间逐渐增加。丁酸含量随着培养时间的增加而增加,在7~10 d时达到最高,随后则随着培养时间的增加而降低。说明在培养过程中乙酸和丁酸作为合成己酸的底物会逐步转化,己酸是在培养后期逐步增加的。各菌株发酵时间与菌株产酸及细胞生长的相关性分析见表2。
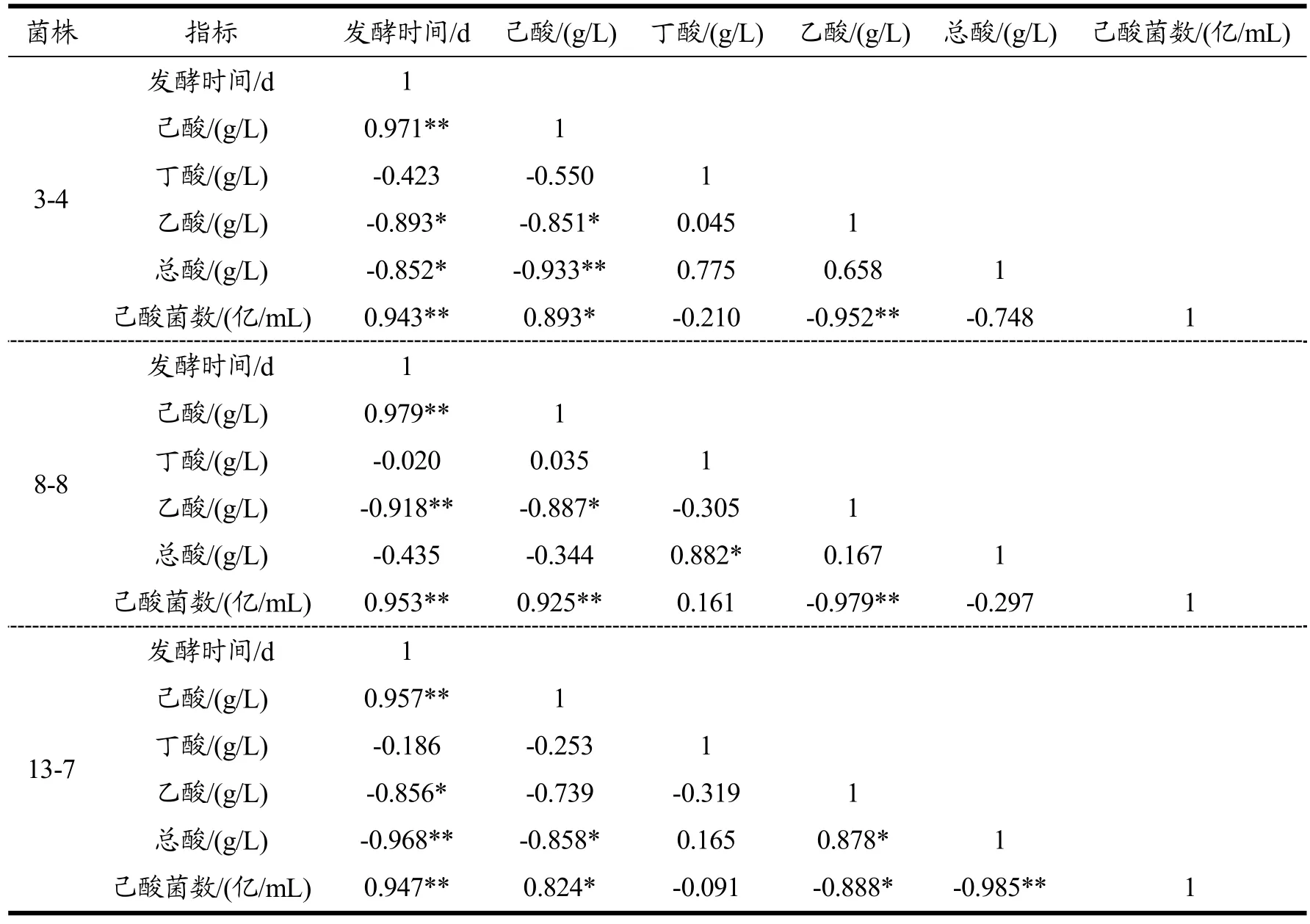
表2 发酵时间与菌株产酸及细胞生长的相关性分析Table 2 Correlation analysis of fermentation time with acid production and cell growth
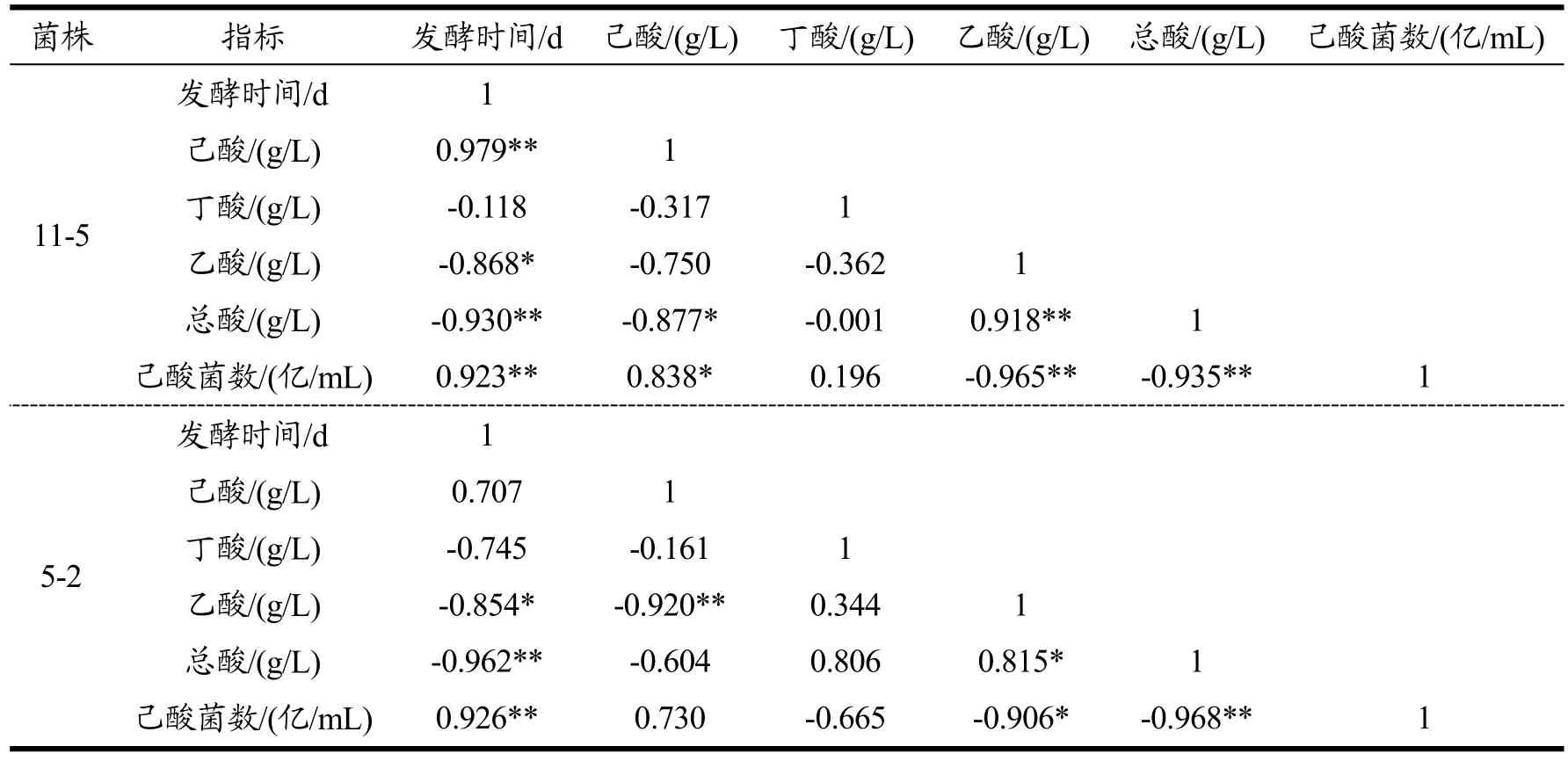
续表2
双变量Pearson检验结果显示,菌株3-4发酵时间与己酸产量呈极显著相关(r=0.971,P=0.001<0.01),与己酸菌数呈极显著相关(r=0.943,P=0.005<0.01);菌株8-8发酵时间与己酸产量呈极显著相关(r=0.979,P=0.001<0.01),与己酸菌数呈极显著相关(r=0.953,P=0.003<0.01);菌株13-7发酵时间与己酸产量呈极显著相关(r=0.957,P=0.003<0.01),与己酸菌数呈极显著相关(r=0.947,P=0.004<0.01);菌株11-5发酵时间与己酸产量呈极显著相关(r=0.979,P=0.001<0.01),与己酸菌数呈极显著相关(r=0.923,P=0.009<0.01);菌株5-2发酵时间与己酸产量相关性不显著(r=0.707,P=0.116>0.05),与己酸菌数呈极显著相关(r=0.926,P=0.008<0.01)。菌株3-4、13-7、11-5、5-2发酵时间与总酸产量呈高度负相关(P<0.01),菌株8-8发酵时间与总酸产量相关性不显著(P>0.05)。
3 结论
窖池窖泥对浓香型白酒的重要性不言而喻,究其原因是窖泥中微生物的代谢与微生物之间的相互作用,菌种分离是目前获得高产己酸菌的最常用手段。本研究经过初筛、复筛,从118株菌中筛选出96株可产己酸和丁酸的菌株,经部分条件优化后己酸产量最高达到3 g/L。10株菌株的分子生物学菌种鉴定结果表明,筛选出的菌株包括革兰氏阳性菌和革兰氏阴性菌,均为兼性厌氧菌,大部分菌株可产芽孢,有较强的抗逆性。其中产量最高的5株菌株分别属于棒杆菌属(Corynebacterium)、寡养单胞菌属(Stenotrophomonas)和芽孢杆菌属(Bacillus),均被报道过在酒厂不同环境中存在。本研究优化了培养基中的乙酸钠浓度,乙酸钠最佳浓度为1%,且不同乙酸钠浓度对总酸产量影响极显著(P<0.01)。氧气条件和温度条件对己酸和丁酸的产量有较显著的影响。在筛选的产己酸和丁酸菌株中,74%的菌株在厌氧条件下产总酸量要高于好氧条件下产总酸量,63%的菌株在低温时产总酸量高于高温时的产酸量。本研究筛选的高产己酸菌种的己酸发酵变化趋势基本相似,己酸均在培养后期逐步增加。随着培养时间的延长,乙酸量逐渐减少,丁酸产量高峰期要早于己酸,在7~10 d出现;随后丁酸产量逐渐降低,己酸产量逐渐增加,14 d后逐渐达到高峰期;而总酸量逐渐降低,说明己酸菌产己酸是一个相对缓慢而漫长的过程,乙酸、丁酸等逐渐合成己酸。
研究表明,复合菌液发酵较纯种发酵更能在香味成分、酒质方面凸显出优势。本研究筛选出的多种不同己酸菌拮抗对峙实验结果表明10个菌株之间均无拮抗作用,因此都可以进行混合培养。这些菌来自不同菌属,产酸的代谢途径不同,可以利用多种不同底物如乳酸、氨基酸、甲醇等为电子供体进行产酸,建立一个可协同作用的,稳定的微生物生态混合培养体系。其中,拉梅尔芽胞杆菌属(Rummeliibacillus)并没有被广泛应用到人工窖泥的培养。除在这10株菌间探寻最佳复配方法外,还可将其与甲烷菌、酵母菌、放线菌复配发酵。除此以外,将拉梅尔芽胞杆菌属(Rummeliibacillus)和球形厌氧杆菌属引入生物炭,可以建立一个独特的群落结构,利用厌氧菌群将有机废弃物利用乙醇,乳酸等底物,显著提高己酸等中链脂肪酸浓度,是一种非常有潜力、可持续利用的新型能源化和资源化技术。拉梅尔芽胞杆菌属(Rummeliibacillus)还可将硝酸盐还原为亚硝酸盐,耐受毒性作用较强,有很好的应用前景。
本实验后期将在掌握已筛选菌株理化性质和代谢特征的基础上,剖析不同菌株之间共生关系及与其他菌株的共生关系,在进行窖池养护、丰富新窖池中微生物种类、缩短新窖池向老窖池演变所需时间、调整老窖池微生物结构等方面发挥积极作用。
