蛋清溶菌酶的重组合成及粗酶生化特性研究
2023-03-07吴瑕刘志军查健龚国利
吴瑕,刘志军,查健,龚国利
(陕西科技大学 食品科学与工程学院,陕西 西安,710021)
蛋清溶菌酶(egg white lysozyme, EWLys)来源于鸡蛋清,属C型溶菌酶,由129个氨基酸残基组成,分子质量为14.4 kDa[1-2]。蛋清溶菌酶作为一种细菌细胞壁水解酶,通过降解肽聚糖层N-乙酰胞壁酸和N-乙酰葡糖胺之间的β-1,4糖苷键,使菌体发生溶胀、死亡,实现高效杀菌[3-4]。该酶因其广谱抑菌性能[5]而具有较高商业价值[6],在食品防腐和医药领域具有广泛用途[7-8]。近年来,随着无抗养殖的发展,蛋清溶菌酶被视为一种低成本饲料添加剂,用于预防及治疗动物细菌感染,在畜牧养殖领域具有良好的应用前景[9-10]。
目前,蛋清溶菌酶的工业化生产主要通过化学法从鸡蛋中提取,其回收率较低,生产成本较高[11]。利用微生物生产蛋清溶菌酶并配合高密度发酵,有望实现其低成本、高收率工业化生产[9]。目前,重组蛋清溶菌酶在大肠杆菌、乳酸乳球菌、酿酒酵母中得到表达,但是其分别面临菌体裂解、酶活力丧失、分泌效率低的问题[12-14]。巴斯德毕赤酵母作为一种广泛应用的异源蛋白表达系统[15-16],具有遗传背景清晰、分子操作简单、培养方便等优点,可对目的蛋白进行分泌表达及糖基化修饰[17-18],已成功用于高效表达多种来源的蛋白质[19-21]。蛋清溶菌酶在这一微生物中的重组分泌表达已有报道,活性收率达到667~976 U/mL[11,22]。然而,这些研究并未比较重组蛋清溶菌酶与天然蛋清溶菌酶之间的生化性质异同。现有研究表明,重组酶与天然酶的生化特性常存在不同程度的差异,且该差异随表达系统及表达条件的改变而发生变化[23-25]。
为此,本研究根据毕赤酵母GS115的密码子偏好性,合成了蛋清溶菌酶基因并将其整合至毕赤酵母基因组,构建了分泌型重组菌株,实现了蛋清溶菌酶在毕赤酵母GS115中的异源表达。通过对该重组酶粗酶液的主要生化特性进行分析及初步表征,证实其与天然蛋清溶菌酶性质相近。这一研究为蛋清溶菌酶的工业化微生物生产及应用提供了理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
藤黄微球菌Micrococcusluteus10209,中国工业微生物菌种保藏管理中心;巴斯德毕赤酵母GS115由本实验室保存;pPIC9K载体由本实验室保存;蛋清溶菌酶基因序列的密码子优化及合成由南京金斯瑞生物技术股份有限公司完成;引物由上海生工生物工程技术服务有限公司合成。
1.1.2 培养基及试剂
YPD培养基:蛋白胨20 g/L,酵母浸粉10 g/L,高压灭菌后加40%(质量分数)葡萄糖使其终质量分数为2%。MD培养基:3.4 g/L YNB(无氨基酵母氮源),10 g/L (NH4)2SO4,0.4 g/L DO Supplement(缺陷型氨基酸混合物),pH调至6.0,灭菌后40%葡萄糖使其终质量分数为2%。BMGY培养基:蛋白胨20 g/L,酵母提取物10 g/L,10 mL甘油溶解并定容至800 mL水中,高压灭菌后加入100 mL 1 mol/L磷酸钾缓冲液(pH 6.0),100 mL 10×YNB,2 mL 500×Biotin,混匀备用。BMMY培养基:蛋白胨20 g,酵母提取物10 g,溶解并定容于800 mL水中,灭菌20 min。冷却至室温,加入100 mL 1 mol/L磷酸钾缓冲液(pH 6.0),100 mL 10×YNB,2 mL 500×Biotin,5 mL甲醇。固体培养基在对应液体培养基的基础上加20 g/L琼脂粉。
1.1.3 仪器与设备
SX-500灭菌锅,TOMY;Infinite M NANO酶标仪,TECAN;A200 PCR仪,杭州朗基科学仪器有限公司;PHS-25精密pH计,上海仪电科学仪器股份有限公司;SW-CJ 生物洁净工作台,苏州安泰空气技术有限公司;DW-YL270医用低温箱,中科美菱低温科技股份有限公司;HNY-2102C恒温培养箱,天津欧诺仪器股份有限公司;SCIENTZ-2C基因导入仪,宁波新芝生物科技股份有限公司;B-500 超微量紫外可见分光光度计,上海元析仪器有限公司;MDF-382超低温冰箱,松下冷链大连有限公司;JY600C电泳仪,北京君意东方电泳设备有限公司;GL124-1SCN 精密电子天平,赛多利斯科学仪器北京有限公司。
1.2 实验方法
1.2.1 菌株构建及筛选
根据NCBI网站上发表的蛋清溶菌酶基因序列,根据毕赤酵母密码子偏好性人工合成蛋清溶菌酶目的基因,以pPIC9K载体为模板,通过Snab I和NotI酶切位点,构建重组表达载体pPIC9K-EWLys。
挑取经YPD平板划线活化的毕赤酵母GS115单菌落,接种于10 mL YPD液体培养基中,于30 ℃过夜培养,转接至50 mL YPD液体培养基,于30 ℃培养至OD600值为0.8~1.2。离心收集菌体(4 ℃,5 000 r/min,5 min),以20 mL无菌水及10 mL 1 mol/L山梨醇溶液分别洗涤1次,重悬于3 mL 1 mol/L山梨醇溶液,分装至无菌1.5 mL离心管中,完成感受态细胞的制备。使用SalI酶将表达载体pPIC9K-EWLys线性化,取2 μL酶切产物加入100 μL感受态细胞中,冰上静置5 min后转入预冷的电转杯中。设定电转参数为电压1.5 kV,电阻400 Ω,电容为25 μF。电击完成后立即加入1 mL YPD吸打混匀转至1.5 mL离心管中,于30 ℃、200 r/min条件下孵育2 h。离心(8 000 r/min, 2 min)收集菌体,以1 mL 1 mol/L山梨醇洗涤1次,重悬于200 μL山梨醇溶液(1 mol/L),并涂布于MD(Without His)平板,于30 ℃培养48 h。随机挑取转化子,使用引物5′-TACTATTGCCAGCATTGCTGC-3′(α-Factor)及5′-GCAAATGGCATTCTGACATCC-3′(AOX1)进行菌落PCR验证阳性转化子,之后使用G418抗生素梯度筛选高拷贝转化子。
1.2.2 高产工程菌株的试管发酵筛选
挑取阳性转化子单菌落接种于2 mL BMGY培养基中,于30 ℃、200 r/min培养24 h(OD600=6~8),离心收集菌体(12 000 r/min, 5 min),重悬于2 mL BMMY培养基,于30 ℃、200 r/min培养,每隔24 h补加甲醇溶液使其终体积分数为0.5%进行诱导,诱导72 h后,将菌液转移至50 mL离心管中,4 000 r/min离心10 min,收集上清液存于4 ℃备用。对照组为未经G418抗性筛选的工程菌株。
1.2.3 蛋清溶菌酶粗酶液的活性测定
测定方法参照GB 1886.257—2016《食品安全国家标准 食品添加剂 溶菌酶》,挑取藤黄微球菌Micrococcusluteus10209甘油菌过夜培养(30 ℃,200 r/min),转接培养至OD450值为0.6~0.8,取1 mL菌液离心(12 000 r/min, 1 min)后弃上清液,用50 mmol/L Tris-HCl润洗2次,之后用200 μL Tris-HCl重悬。以重悬后的藤黄微球菌为底物,在50 mmol/L Tris-HCl (pH 7.0)体系中测定重组蛋清溶菌酶粗酶(发酵上清液)的活性。在96孔板中设置反应体系为120 μL Tris-HCl缓冲液+15 μL菌悬液+15 μL发酵上清液,对照组为未经G418抗性筛选的工程菌株,利用酶标仪监测OD450值的变化,酶活力的计算如公式(1)所示:

(1)
式中:酶活力,U/mL;A2、A4为第2 min和第4 min测得的OD450值;2为时间间隔2 min;0.001为使用藤黄微球菌悬浊液在450 nm 处每分钟引起吸光度变化为0.001;0.015代表所用酶的体积为0.015 mL。
1.2.4 温度对重组蛋清溶菌酶粗酶液活性的影响
将重组酶在不同温度(60、70、80、90 ℃)加热处理不同时间后,测定残余酶活力(方法同1.2.3,以不加热时的酶活力为100%),并计算热失活过程的动力学及热力学参数。热力学参数的计算如公式(2)~公式(5)所示:
(2)
ΔH=Ea-R
(3)
(4)
(5)
式中:Ea为活化能,J/mol;R为摩尔气体常数,J/(mol·K);slope为Arrhenius图谱中曲线的斜率;ΔH、ΔG、ΔS分别为热失活过程中的活化焓、活化熵、活化吉布斯自由能,J/mol;T为绝对温度,K;h为普朗克常数;ki为不同温度下热失活速率常数,s-1;kB为玻尔兹曼常数。
1.2.5 pH对重组蛋清溶菌酶粗酶液活性的影响
同1.2.3蛋清溶菌酶活性测试方法,将酶活力测定反应体系中缓冲液替换为50 mmol/L的非离子型缓冲液,即pH 5.0的柠檬酸缓冲液、pH 6.0的MES缓冲液和pH 7.0~9.0的Tris-HCl缓冲液,以最高酶活力为100%,计算不同pH下重组蛋清溶菌酶的残余酶活力。
1.2.6 二价金属离子对重组蛋清溶菌酶粗酶液活性的影响
配制含有不同二价金属离子(ZnCl2,CoCl2,NiCl2,MgCl2,CaCl2,CuCl2)的50 mmol/L Tris-HCl (pH 7.0) 缓冲液,使金属离子终浓度为分别为0.1、1、10 mmol/L。同1.2.3测试方法,以未添加金属离子的体系作为对照(对应酶活力设为100%),计算不同金属离子存在条件下重组蛋清溶菌酶的活性。
1.2.7 盐浓度对重组蛋清溶菌酶粗酶液活性的影响
配制含有25、50、75、100、150 mmol/L NaCl的50 mmol/L Tris-HCl (pH 7.0)缓冲液,同1.2.3测试方法,以未添加NaCl的体系作为对照,以最高酶活力为100%,测试不同盐浓度对重组蛋清溶菌酶活性的影响。
2 结果与分析
2.1 GS115-pPIC9K-EWLys重组菌株的构建及筛选
将蛋清溶菌酶的编码基因按照毕赤酵母的密码子偏好性进行密码子优化,通过Snab I和NotI酶切位点克隆至pPIC9K表达载体。将重组表达载体转化至毕赤酵母菌株GS115,在缺少组氨酸的MD平板上进行筛选。重组质粒pPIC9K-EWLys为整合型质粒,目的基因与载体上携带的G418抗生素抗性基因共同整合至毕赤酵母基因组(图1)。为提高目的基因的拷贝数,研究中逐渐提高G418抗生素的浓度,对重组菌株进行驯化,最终在16 mg/mL G418的质量浓度下获得高拷贝转化子。随机挑取一个转化子进行重组蛋清溶菌酶的诱导表达,发现诱导24 h后出现目标条带,表明重组菌株构建成功(图2)。重组蛋清溶菌酶的表达量随诱导时间的延长而增加,在诱导72 h时达到最大。

图1 蛋清溶菌酶编码基因的基因组整合示意图

图2 重组毕赤酵母分泌表达蛋清溶菌酶的SDS-PAGE分析
为获得产量较高的重组菌株,随机挑取100个高拷贝转化子进行试管发酵,诱导72 h后取发酵液上清测试重组蛋清溶菌酶的活性,如图3所示。20号转化子发酵产生的重组蛋清溶菌酶活性收率最高,达到665 U/mL,比未经G418筛选的工程菌株提高3.02倍。选取该菌株进行后续测试。

图3 高产蛋清溶菌酶的毕赤酵母转化子筛选
2.2 重组蛋清溶菌酶粗酶液的生化特性测试
2.2.1 温度对重组蛋清溶菌酶粗酶液活性的影响
天然蛋清溶菌酶具有较好的热稳定性,在30~60 ℃加热30 min后能保持较高的稳定性,在70 ℃加热30 min仍可保留78%的酶活力,在80 ℃加热30 min后,保留52%的酶活力[26]。为了解重组蛋清溶菌酶是否具有相近的性质,本研究将重组酶的粗酶液在不同温度下加热30 min,测定残余酶活力。如图4所示,重组蛋清溶菌酶在60 ℃以下加热后酶活力略有升高,在70、80、90 ℃加热30 min后可分别保留78%、68%、50%的活性,表明其热稳定性略优于天然蛋清溶菌酶。

图4 温度对重组蛋清溶菌酶粗酶液活性的影响
为进一步系统解析重组蛋清溶菌酶的热失活动力学特性,本研究在不同温度对粗酶液加热处理不同时间,测定残余酶活力。如图5所示,将重组蛋清溶菌酶在60 ℃加热4 h后,其活性没有明显变化,而在70、80、90 ℃分别加热240、160、100 min后,活性完全丧失。以这3个温度下残留酶活力的对数对加热时间作图,发现二者呈线性关系,如图6所示,表明重组蛋清溶菌酶在相应温度下的热失活遵循一级反应动力学模型。以绝对温度的倒数为横坐标,以热失活动力学反应常数的对数为纵坐标,发现二者呈线性相关,如图7所示。根据图6斜率计算其活化能,利用1.2.4公式计算热失活过程的热力学参数,结果如表1所示。蛋清溶菌酶的热失活活化能为62.85 kJ/mol,活化吉布斯自由能约为110 kJ/mol,表明其热稳定性较强,不易在热加工过程中完全丧失活性[27]。此外,其热失活活化熵约为-144 J/(mol·K), 负值较大,说明其在热失活过程中可能出现结构紧缩,导致活性中心折叠包埋。

a-60 ℃处理;b-70 ℃处理;c-80 ℃处理;d-90 ℃处理

图6 重组蛋清溶菌酶粗酶液的热失活动力学

图7 重组蛋清溶菌酶粗酶液热失活的Arrhenius图谱

表1 重组蛋清溶菌酶粗酶液热失活动力学参数
2.2.2 pH对重组蛋清溶菌酶粗酶液活性的影响
天然蛋清溶菌酶对盐浓度较为敏感[26]。因此,在测定重组酶粗酶液活性随pH值变化规律的过程中,为避免盐浓度的影响,本研究选用一系列非离子型缓冲液。图8表明重组蛋清溶菌酶在pH为6.0时活性最高;当pH为7~9时酶活力随pH的上升而降低。天然溶菌酶在pH 5~8可保持85%以上的相对酶活力,且最适pH为6.0[26]。重组酶在pH 5~8可保持60%以上的相对酶活力,与天然酶相比,其pH稳定性有所下降。
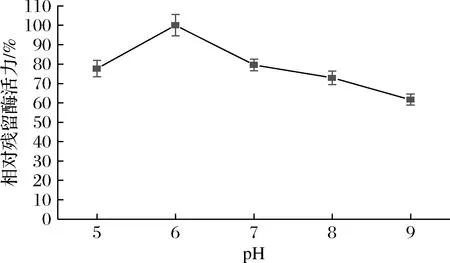
图8 pH对重组蛋清溶菌酶粗酶液活性的影响
2.2.3 盐浓度对重组蛋清溶菌酶粗酶液活性的影响
天然蛋清溶菌酶对盐浓度较为敏感,通常150 mmol/L NaCl即可完全抑制酶活力[28]。为探究重组蛋清溶菌酶对盐浓度的敏感性,本研究测试了NaCl浓度对重组粗酶液活性的影响,并进一步考察了这一影响是否具有pH依赖性。如图9所示,在pH为6~9的非离子型缓冲液中,重组蛋清溶菌酶的活性随NaCl浓度升高而降低,该性质与天然蛋清溶菌酶一致。此外,在pH为6和7时,150 mmol/L NaCl可抑制约80%的重组酶活性,而在pH为8和9时,75 mmol/L NaCl即可完全抑制重组酶的活性。这一结果表明,随着pH的升高,重组蛋清溶菌酶对NaCl浓度更为敏感。

图9 盐浓度对重组蛋清溶菌酶粗酶液活性的影响
2.2.4 金属离子对重组蛋清溶菌酶粗酶液活性的影响
对于天然蛋清溶菌酶,Ca2+(10 mmol/L)对酶活力有较强激活作用,Zn2+(10 mmol/L)有明显抑制作用,Mg2+(10 mmol/L)对酶活力没有明显影响[28]。对于重组蛋清溶菌酶,Zn2+、Ca2+、Ni2+、Mg2+、Co2+、Cu2+在0.1~10 mmol/L对酶活力均呈现不同程度的抑制作用,且该作用与金属离子浓度呈正相关,如图10所示。在10 mmol/L浓度下,Zn2+使重组酶的活性下降了约35%,与文献报道一致;然而,Ca2+和Mg2+使重组酶的活性分别下降了30%与50%,与文献报道明显不同。这一偏差可能由多方面原因导致。首先,本研究使用粗酶液进行测试,金属离子可能与发酵液中的某些代谢物结合,影响重组蛋清溶菌酶的稳定性;其次,重组蛋清溶菌酶与天然酶在结构上存在某些差别,使得重组酶更易与金属离子结合,引起活性下降;第三,本研究所用酶浓度较低,在底物过量的情况下,酶活力的变化对反应速率及反应进行程度的影响较为明显。
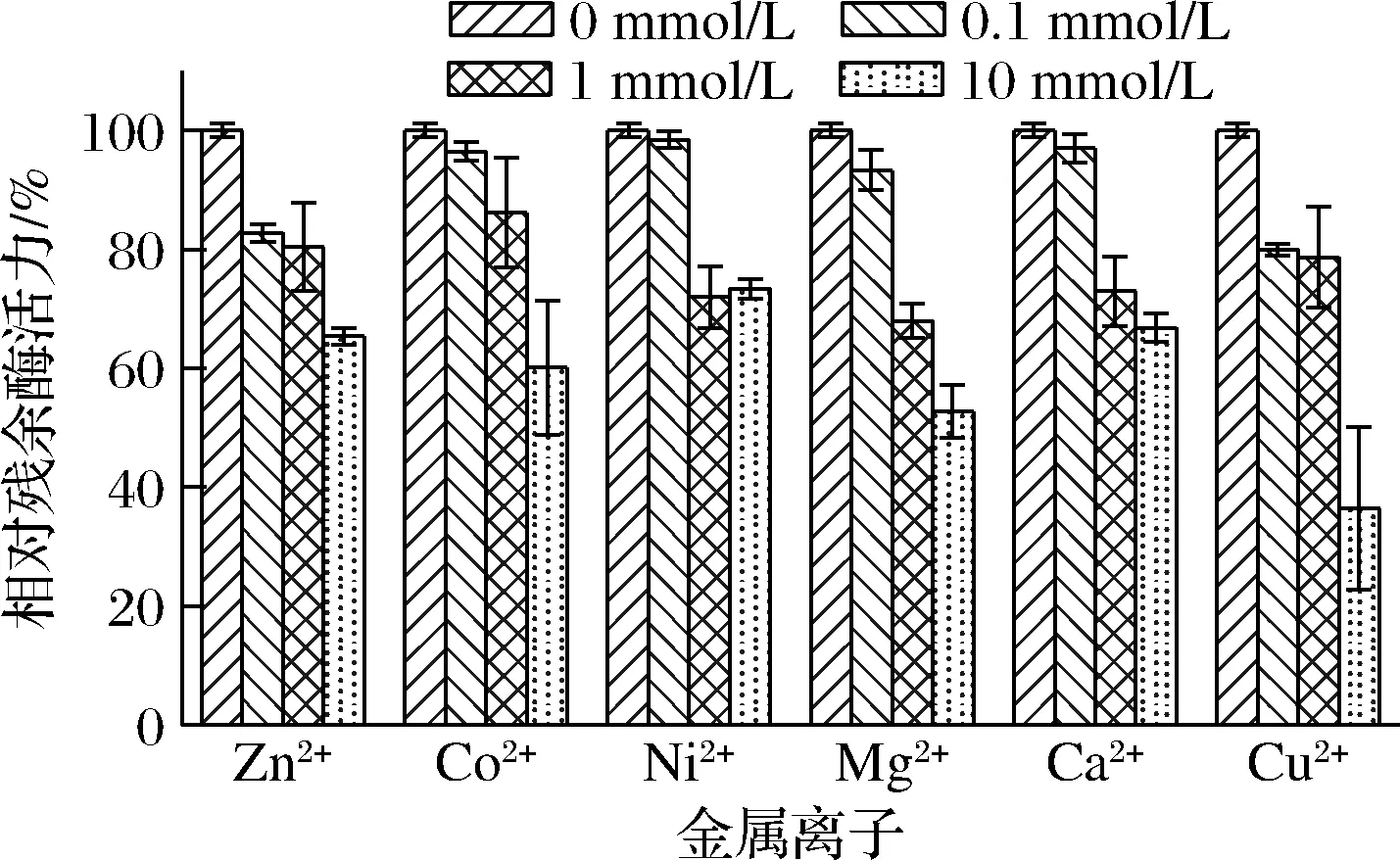
图10 二价金属离子对重组蛋清溶菌酶粗酶液活性的影响
3 结论与讨论
本研究通过构建重组载体pPIC9K-EWLys,实现蛋清溶菌酶在毕赤酵母中的异源表达,并筛选出高产工程菌株。生化特性分析表明,重组蛋清溶菌酶粗酶液在90 ℃加热30 min仍能保持50%活性,热稳定性较强,最适pH为6.0,在pH 5~9能够保持60%以上的活性,且对盐浓度和金属离子敏感。这一结果表明,该重组蛋清溶菌酶可用于热加工处理。此外,用作饲料或食品添加剂时,需注意盐浓度和金属离子的浓度,以保证较大抗菌活性。本研究为蛋清溶菌酶在毕赤酵母中的后续研究提供了理论指导。
