茶多酚-壳聚糖复合液对虹鳟鱼肉贮藏品质和 菌群结构的影响
2023-03-06吴昕宁李鸣泽梁释介张靖暄谭雨青罗永康
吴昕宁,李鸣泽,梁释介,张靖暄,熊 欣,谭雨青,罗永康*
(中国农业大学食品科学与营养工程学院,北京 100083)
虹鳟(Oncorhynchus mykiss)属太平洋鲑属[1],是典型的冷水鱼[2]。虹鳟鱼滋味鲜美、营养丰富、生长快、易人工繁殖,是联合国粮农组织向世界推广的产量高且品质优良的四大淡水养殖品种之一[3]。虹鳟鱼肉具有水分含量高、营养物质丰富、内源酶活性高、pH值近中性等特点,成为微生物适宜的生长繁殖环境,因此在贮藏、运输、销售过程中极易在微生物和内源酶的共同作用下发生腐败变质。李东萍等[4]研究发现,3 ℃冰藏下的虹鳟鱼片的货架期仅有6 d;此外,高不饱和脂肪酸使其极易发生脂肪氧化,造成鱼肉风味、质地劣化,产生不愉快的嗅感和味感[5]。有效的保鲜手段对虹鳟鱼货架期的保障和品质的维持十分重要。
生物保鲜剂在肉类保鲜中应用广泛[6]。茶多酚是茶叶的主要活性成分[7],是含有多羟基酚类化合物的复合物,具有显著的抗氧化活性[8],是一类水产品抗菌保鲜领域的良好抗菌剂,李双双等[9]将其应用于金枪鱼保鲜。壳聚糖是几丁质脱乙酰化后得到的多糖,具有良好的抑菌活性[10], 周强等[11]将其用于草鱼保鲜。目前研究表明,还没有任何一种抑菌剂有比较全面的抑菌谱,为发挥协同保鲜效果,将不同功能生物保鲜剂联合使用,互补单一生物保鲜剂在感官及抑菌效果方面的不足,有较强的抑菌效果,能扩大抑菌谱,更好抑制产品腐败变质,延长其货架期[12],因此复合生物保鲜剂具有非常好的应用前景[13]。 茶多酚和壳聚糖的复合保鲜在鮸鱼、三文鱼、南美白对虾中均已得到应用[14-16]。
目前在虹鳟鱼贮藏加工与品质控制方面已取得初步进展,但在虹鳟鱼鱼肉贮藏过程中微生物菌群动态变化规律、菌群组成与鱼肉品质的内在关系和生物保鲜剂控制特定腐败菌等方面的研究还相对欠缺,需要更加深入的研究。本研究以生鲜虹鳟鱼为原料,研究其在(4±1) ℃条件下贮藏时菌群结构的变化,并且通过复配保鲜剂涂膜(茶多酚-壳聚糖),研究复配保鲜剂涂膜对生鲜虹鳟鱼肉在(4±1) ℃贮藏过程中品质变化的影响,以期为延长生鲜虹鳟鱼肉贮藏时间提供研究基础。
1 材料与方法
1.1 材料与试剂
鲜活虹鳟鱼购于北京市四道口水产品批发市场,平均体长(42.59±1.58) cm,平均体质量(0.86±0.09) kg。
茶多酚(纯度>80%) 安徽红星药业股份有限 公司;壳聚糖(纯度>90%、脱乙酰度>90%) 北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
BCD-251 WBCY冰箱 青岛海尔股份有限公司;YT-C1-1ND超净工作台 北京亚泰科隆实验科技开发中心;DHP-9082电热恒温培养箱 上海一恒科学仪器有限公司;KDY-9820半自动凯式定氮仪 北京通润源机电仪器设备公司;DSHZ-300A水浴恒温振荡器 苏州培英实验设备有限公司;GL-21M冷冻离心机 长沙平凡仪器仪表有限公司。
1.3 方法
1.3.1 样品处理
鲜活虹鳟鱼充氧运输至中国农业大学食品科学与营养工程学院。将其迅速敲头击晕,去鳞剖腹后取出内脏,切去头部,用流水冲淋鱼体,取背部肌肉分割为8 cm×6 cm×2 cm的鱼片并清洗沥干,将得到的鱼片随机分组。
1.3.2 保鲜剂处理
配制3 g/L溶于水的茶多酚溶液为GTP组,10 g/L溶于体积分数1%乙酸的壳聚糖溶液为CS组,上述茶多酚溶液和壳聚糖溶液等体积混合为MIX组。将生鲜鱼片按以上处理组于清洁烧杯常温浸泡,保持液面完全没过鱼片,10 min后沥干至无水滴落,装入食品级聚乙烯袋并编号。未做浸泡处理的空白对照组为CK组。处理后的鱼片贮藏于预消毒4 ℃冰箱,分别于0、2、4、6、8 d随机从每组取3 片进行指标测定。对未到贮藏限值的组别,延长其贮藏期,分别在10、13、15 d测定指标。
1.3.3 感官评价
感官评价参考Berizi[17]、罗忠云[18]等的方法,结合虹鳟鱼本身特征作出调整。感官小组由经过专业感官实验训练的6 名实验室成员组成,含3 名男性和3 名女性,年龄为21~23 岁,感官小组成员分别对鱼片的色泽、气味、质地和弹性进行5 分制打分,评分标准见表1。

表1 虹鳟鱼肉感官评价标准Table 1 Criteria for sensory evaluation of rainbow trout flesh
1.3.4 菌落总数测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》。称取5 g虹鳟鱼背部肌肉于无菌均质袋中,再加入45 mL无菌生理盐水,用拍打式均质机拍打30 s,制得1∶10的样品稀释液。之后用4.5 mL无菌生理盐水连续10 倍梯度稀释0.5 mL样品悬液。选择2 个合适稀释度的悬液,吸取100 μL于无菌平板计数琼脂上涂布。每个稀释度作2 次平行,并以无菌生理盐水作为空白对照。操作结束后将培养皿转移至(30±1) ℃的微生物恒温培养箱培养48~72 h,菌落清晰可见而不重叠时培养结束。取出进行计数,菌落单位为(lg(CFU/g))。
1.3.5 挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的半微量定氮法。称取5 g搅碎的鱼片于100 mL离心管中,加入45 mL蒸馏水,均质1 min后在摇床上振荡30 min,4 ℃条件下4 500 r/min离心3 min。吸取5 mL 10 g/L氧化镁与5 mL上清液于消化管中,混合均匀后进行蒸馏。锥形瓶中加入100 μL混合指示剂(1 g/L次甲基蓝溶液与2 g/L甲基红-乙醇溶液按体积比1∶1混合)和用于吸收馏出物的10 mL 20 g/L硼酸溶液,蒸馏5 min后,用盐酸标准溶液(0.01 mol/L)滴定至吸收液呈蓝紫色。以5 mL蒸馏水代替样品悬液为空白对照。
1.3.6 菌群结构测定
取10 g鱼片与20 mL无菌生理盐水混合,漩涡低速振荡30 s后100 r/min摇床振摇15 min,使鱼片表面的微生物分散于生理盐水。200 r/min离心5 min获得上清液以去除鱼肉,1 000 r/min离心10 min获得沉淀物。用1.5 mL无菌水洗涤沉淀后,12 000 r/min离心1 min获得菌体沉淀。参照Liu Xiaochang等[19]的方法提取细菌DNA,将其运送至上海美吉生物医药科技有限公司[20],委托该公司采用 第2代测序技术进行聚合酶链式反应扩增和产物纯化,并通过细菌16S rRNA基因V3~V4区的测序分析进行鉴定[21]。
1.4 数据处理
所有指标均测3 个平行,实验结果用平均值±标准差的形式表示。采用Excel 2016软件进行统计分析,采用IBM公司SPSS统计软件进行差异显著性分析,显著水平为5%。采用Origin软件作图。
2 结果与分析
2.1 虹鳟鱼片4 ℃贮藏过程中的感官评分变化

感官评价是食品领域广泛采用和认可的评价方法。由图1可知,贮藏开始,虹鳟鱼片色泽、气味、质地和弹性等感官品质均处于完全新鲜的状态,呈明亮的橙黄色,表面颜色鲜亮,肌肉致密紧实、富有弹性。鱼片的各项感官评分随着贮藏时间的延长均下降。由于微生物增殖和脂肪氧化,逐渐色泽暗淡,产生异味,组织松散无弹性。贮藏初期,GTP组的气味和色泽评分相对CS组较高,可能由于茶多酚本身具有芳香,且对食品中的色素具有保护作用。Gram[22]指出,食品腐败主要是指食品经感官评价后判定为感官不可接受时的状态。通常,将鱼肉刚好达到感官不可接受点的时间定义为鱼肉的货架期。本研究将2 分作为不可接受限值,结果表明,贮藏虹鳟鱼片的感官货架期为6~8 d,茶多酚和壳聚糖复合保鲜剂能将货架期延长至10 d。壳聚糖的抗菌性抑制腐败变质,茶多酚的抗氧化性抑制脂肪氧化酸败,结合使用效果更佳。
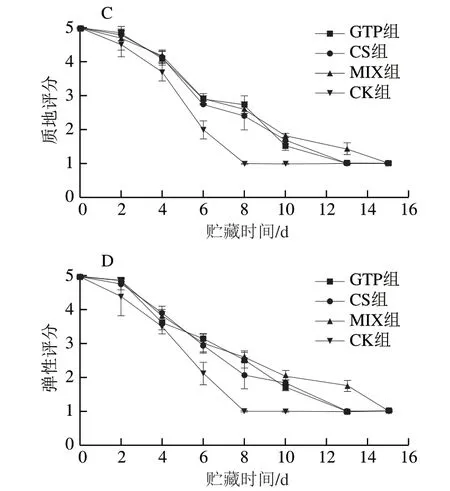
图1 虹鳟鱼片4 ℃贮藏过程中色泽(A)、气味(B)、 质地(C)及弹性(D)评分变化Fig. 1 Changes in color (A), odor (B), texture (C) and elasticity (D) of rainbow trout fillets during refrigeration at 4 ℃
2.2 虹鳟鱼片4 ℃贮藏过程中的菌落总数变化
水产品的腐败变质多数是由微生物引起的。由图2 可知,GTP组、CS组、MIX组虹鳟鱼片初始菌落总数分别为3.32、3.27、3.14(lg(CFU/g)),CK组为 3.40(lg(CFU/g)),与MIX组相比有显著差异 (P<0.05),表明复配保鲜剂具备一定程度的减菌作用。随着贮藏时间的延长,各组鱼片菌落总数均不断增长。贮藏8 d时,CK组已达8.07(lg(CFU/g)), 明显超出SC/T 3116—2006《冻淡水鱼片》中淡水鱼的上限7.0(lg(CFU/g));此时,GTP组和CS组分别为7.32、6.02(lg(CFU/g)),MIX组仅有 4.38(lg(CFU/g));CK组的菌落总数显著高于其他组(P<0.05)。贮藏13 d时,MIX组的菌落总数达 7.08(lg(CFU/g)),仍显著低于单独处理的GTP组和CS组(P<0.05)。这说明茶多酚和壳聚糖复配保鲜剂处理可以较好控制虹鳟鱼片微生物生长,复合涂膜对虹鳟鱼片中菌落的抑制能力强于仅用壳聚糖或茶多酚处理的样品。现有研究表明,茶多酚对革兰氏阳性菌和革兰氏阴性菌均有明显抑制作用[23];壳聚糖通过改变细菌细胞膜的通透性阻碍细胞内外的气体交换,进而抑制细菌生长繁殖[24]。

图2 虹鳟鱼片4 ℃贮藏过程中菌落总数变化Fig. 2 Changes in total aerobic colony count of rainbow trout fillets during refrigeration at 4 ℃
2.3 虹鳟鱼片4 ℃贮藏过程中的TVB-N含量变化
TVB-N是指动物性食品在内源性酶及微生物的作用下使蛋白质分解而产生的氨及胺类等碱性含氮化合物,与微生物活动息息相关[25],TVB-N含量越高,说明鱼片腐败程度越显著。由图3可知,GTP组、CS组、MIX组和CK组虹鳟鱼片初始TVB-N含量分别为7.7、6.1、6.3、7.2 mg/100 g,表明鱼片的初始质量良好,与成传香等[26]报道的基本一致。随着贮藏时间的延长,各组的TVB-N含量均随贮藏时间延长而逐渐升高,后期由于菌落总数的增长,腐败加剧而上升明显。贮藏8 d时,各组之间出现显著性差异(P<0.05)。GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》规定,淡水鱼鱼肉TVB-N含量的可接受上限值为20 mg/100 g。贮藏10 d时,CK组增加至23.3 mg/100 g,已超过可接受上限值;而此时GTP组、CS组的TVB-N含量分别增加至16.3、14.9 mg/100 g,均显著低于CK组(P<0.05),表明保鲜剂能延缓TVB-N含量的增加;MIX组的TVB-N含量仅为12.1 mg/100 g,显著低于GTP组和CS组 (P<0.05),说明复配保鲜剂效果优于单独使用。贮藏13 d时,GTP组、CS组和MIX组的TVB-N含量分别为25.0、19.1、16.1 mg/100 g,MIX组最低。贮藏至15 d,MIX组的TVB-N含量为20.1 mg/100 g,达到上限值。研究[27]显示,茶多酚处理可以减弱肌肉组织中蛋白质的降解,延缓TVB-N的积累。壳聚糖具有抗菌性能[28],可能通过抑制微生物进一步延缓含氮物质的分解。
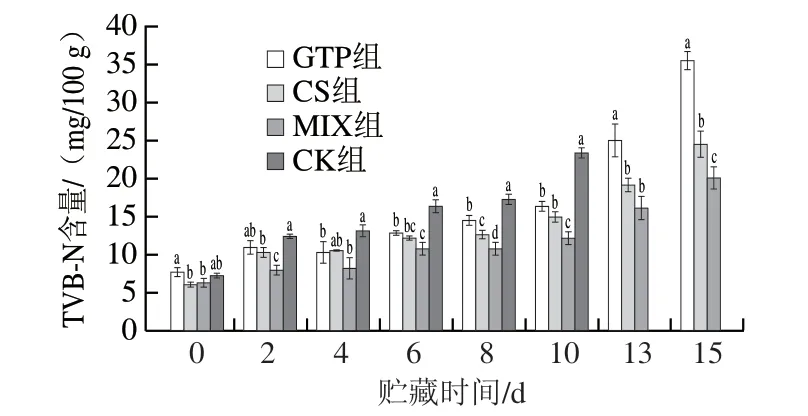
图3 虹鳟鱼片4 ℃贮藏过程中TVB-N含量变化Fig. 3 Changes in TVB-N content of rainbow trout fillets during refrigeration at 4 ℃
2.4 虹鳟鱼片4 ℃贮藏过程中的菌群结构分析
2.4.1 高通量测序序列信息及α多样性分析
在本研究中,基于感官评价和菌落总数结果将0 d作为贮藏的初期,GTP组的6、10 d分别作为茶多酚处理组贮藏的中期和末期,CS组的6、10 d分别作为壳聚糖处理组贮藏的中期和末期,MIX组的8、13 d分别作为茶多酚和壳聚糖复合处理组的中期和末期,CK组的4、8 d分别作为对照组贮藏的中期和末期,通过高通量测序技术进行鱼片菌群结构分析。
α多样性是指一个特定区域或生态系统内不同物种种类的丰富程度以及物种数量分布的均匀程度[29],在本研究中即为虹鳟鱼片样品中微生物的多样性和丰富程度。覆盖率是用于评估测序深度的指数,能够反映测序结果代表样本中微生物的程度,其值越接近于100%,表明样品中物种被检测的概率越高。
由表2可知,各组样品的覆盖率均在99.9%以上,说明高通量测序结果可以反映样品中几乎全部微生物的群落丰度和多样性。Ace、Chao 1和Shannon指数分别用来分析微生物群落的丰富度和多样性[30]。Ace指数和Chao 1指数越大,代表群落物种种类越丰富,Shannon指数越大,说明群落多样性越低。各组鱼片贮藏末期的Ace、Chao 1和Shannon指数均低于0 d,说明随贮藏时间延长,各组鱼片的菌群丰富度呈下降趋势,这与Zhuang Shuai等[31]的发现一致,可能由于出现了优势菌属,抑制其他微生物的生长,从而降低多样性。另一方面,MIX组贮藏8 d的Ace指数为233.60,远远高于CK组贮藏8 d的28.72,及GTP组、CS组贮藏6 d的33.63、175.78,说明茶多酚和壳聚糖的复配处理可以使虹鳟鱼片贮藏后期的菌群结构保持较高多样性。

表2 虹鳟鱼片4 ℃贮藏过程中菌群高通量测序信息及α多样性分析Table 2 High-throughput sequencing information and α-diversity analysis of bacterial flora in rainbow trout meat during refrigeration
2.4.2 菌群分析
微生物是引起鱼肉腐败的主要原因,对虹鳟鱼腐败过程作用至关重要[32]。鉴定鱼肉贮藏过程中的菌群结构变化能够揭示鱼肉的腐败模式和腐败进程,对生鲜鱼肉贮藏保鲜控制技术的开发具有重要参考价值。高通量测序结果显示,在各组鱼片贮藏过程中,属水平上共鉴定到16 个相对丰度≥1%的微生物菌种。由图4可知,贮藏0 d时,鱼片优势菌属为考克氏菌属(Kocuria),占比26.8%,及假单胞菌属(Pseudomonas),占比21.9%,此外有巨型球菌属(Macrococcus)占比8.0%,不动杆菌属(Acinetobacter)占比7.2%,链球菌属(Streptococcus)占比5.2%。随着贮藏时间的延长,各组鱼片菌群多样性水平均降低,且假单胞菌属在各组鱼片中的相对丰度持续增加,并成为优势腐败菌。Syropoulou等[33]对鲈鱼的研究中也发现,假单胞菌属是鱼片中的主要细菌,它通常来源于鱼类生活的环境。

图4 虹鳟鱼片4 ℃贮藏过程中属水平微生物相对丰度的变化Fig. 4 Changes in relative abundance of bacterial genera in rainbow trout during refrigeration
水产品中有多种微生物存在,但只有其中部分会导致腐败变质[34]。虹鳟鱼片贮藏中后期的优势菌为假单胞菌属。CK组贮藏4 d时假单胞菌属占比85.6%,贮藏8 d占比98.4%;GTP组贮藏6 d假单胞菌属占比99.8%;CS组贮藏6 d假单胞菌属占比84.6%,显著低于GTP组,并低于CK组贮藏8 d的占比,说明壳聚糖对优势腐败菌假单胞菌属的抑制作用优于茶多酚。MIX组贮藏8 d的优势菌假单胞菌属占比75.9%,显著低于CK组的98.4%,说明茶多酚和壳聚糖的复配保鲜剂有较好的抑制假单胞菌属生长繁殖的作用。在贮藏末期,GTP组、CS组贮藏10 d和MIX组贮藏13 d,假单胞菌属占据显著优势。结合Wang Hang等[35]针对草鱼的实验,该研究表明,假单胞菌属与鱼肉腐败直接相关,是典型的低温腐败菌,具有很强的蛋白质和脂肪分解能力[36],可以判断假单胞菌属为贮藏虹鳟鱼片的特定腐败菌。因此,茶多酚和壳聚糖的复配生物保鲜剂可以通过改变鱼片菌群组成,尤其是抑制假单胞菌属来减缓鱼片品质劣变,进而延长生鲜鱼片的 货架期。
3 结 论
茶多酚和壳聚糖复配保鲜剂的涂膜处理是一种有效延长虹鳟鱼货架期的保鲜方法,具有作为良好天然防腐剂的潜力。涂膜处理抑制了鱼片中菌落总数的增长,延缓感官评分下降和TVB-N含量增长。结合多个指标,复配保鲜剂涂膜处理将4 ℃贮藏虹鳟鱼片的货架期延长约5 d。茶多酚和壳聚糖单独处理也有一定抑菌效果,但复配保鲜剂效果更佳。可能由于茶多酚和壳聚糖分别存在有效的生物活性成分和天然抗菌剂,复配保鲜剂具备更广泛的抗菌谱,抑菌覆盖面更宽,具有协同增效作用。新鲜虹鳟鱼的菌群由16 个菌属组成,其中考克氏菌属和假单胞菌属为新鲜虹鳟鱼的优势菌属,假单胞菌属随贮藏时间延长不断占据优势,成为虹鳟鱼的优势腐败菌,壳聚糖和茶多酚复配保鲜剂可能通过抑制假单胞菌属生长而减缓腐败过程。本研究为虹鳟鱼品质控制技术提供了理论参考。
