鸭茅内生木霉菌株TD-MM鉴定及其特性研究
2023-03-05郑嘉淇李梦圆张超文韩玉竹
郑嘉淇, 景 浩, 李梦圆, 张超文, 韩玉竹,2*
(1. 西南大学动物科学技术学院, 重庆 400000; 2. 草食动物科学重庆市重点实验室, 重庆 400000)
植物病害在世界各种植区内频繁发生,在一定程度上会降低农作物的产量与品质,限制作物的栽种与培育,影响农产品的运输与贮藏,造成经济损失[1]。绝大多数植物病害是由真菌侵染引起的[2],致病性真菌能够引起植物出现根腐、萎蔫、叶斑、叶枯等病理症状,对寄主造成毁灭性的伤害[3]。许多真菌病害的防治十分依赖化学杀菌剂。然而,长期不规范地施用化学农药,增强了病原微生物的抗药性,加剧了土壤理化性质的恶化,严重破坏了粮食安全[4]。因此,寻找绿色、高效的病虫害防治手段,是实现农业可持续发展的重要目标。生物防治符合生态农业的理念,近年来备受青睐。其中,利用拮抗微生物防治植物病害是一种相对安全和有效的方法[5-6],其具有选择性强、经济、无残留的特点,能够为开发环保型制剂提供技术支撑[7]。
植物内生菌广泛分布在植物组织中[8-9],驻留在寄主的细胞间或细胞内,形成稳定互利的共生体系。植物体为内生菌的生长繁殖提供必需的营养物质,而内生菌则通过自身功能及其代谢产物直接或间接地影响植物[10]。相关研究表明,植物内生真菌能够分泌多种抗菌活性物质,与病原微生物竞争营养及生态位,诱导寄主植物产生广谱的系统抗性[11]。此外,内生菌能够通过溶磷、固氮、产生铁载体等机制促进作物对营养物质的吸收,并分泌赤霉素和生长素等植物激素[12]。如蜂巢草(Leucasaspera)叶片中的内生木霉具有促生和防病价值[13]。我国生物资源种类繁多,挖掘植物内生菌的应用潜力,可为提高植物抗逆性和维持生态系统平衡提供有益参考。
鸭茅(DactylisglomerataL.)是世界上最著名的冷季型禾本科牧草之一,在世界各地广泛栽培[14],具有产量高、适应性强[15]、适口性好和碳水化合物含量高等特点,对畜牧业生产有着重要意义[16-17]。鸭茅根系发达,能够固定表层土,提高土壤抗侵蚀能力,推进石漠化地区的生态修复[18]。然而,目前利用鸭茅内生真菌进行生物防治的研究较少。木霉是一类典型的植物内生菌,在农业、工业和生态应用中具有重要意义[19-21]。为进一步探索鸭茅内生生防菌株,课题组从鸭茅叶片中分离获得32株内生木霉,经平板对峙实验筛选得到的菌株TD-MM对多种植物病原真菌均具有强拮抗作用。本研究基于形态学以及rDNA-ITS,EF-1α,LSU rDNA和RPB2序列分析明确菌株TD-MM的分类学地位,对该菌株的抑菌活性和防治效果进行初步研究,并测定其生物学特性,以期为内生木霉菌资源的开发及其在植物病害生物防治领域的应用提供科学依据。
1 材料与方法
1.1 材料
供试内生菌株哈茨木霉TD-MM(Trichodermaharzianum);植物病原真菌双核丝核菌(binucleateRhizoctonia)、立枯丝核菌(Rhizoctoniasolani)、交链格孢(Alternariaalternata)、胶孢炭疽菌(Colletotrichumgloeosporioides)、尖孢镰刀菌(Fusariumoxysporum)和辣椒疫霉(Phytophthoracapsici)(表1),均来源于西南大学牧草微生物课题组。
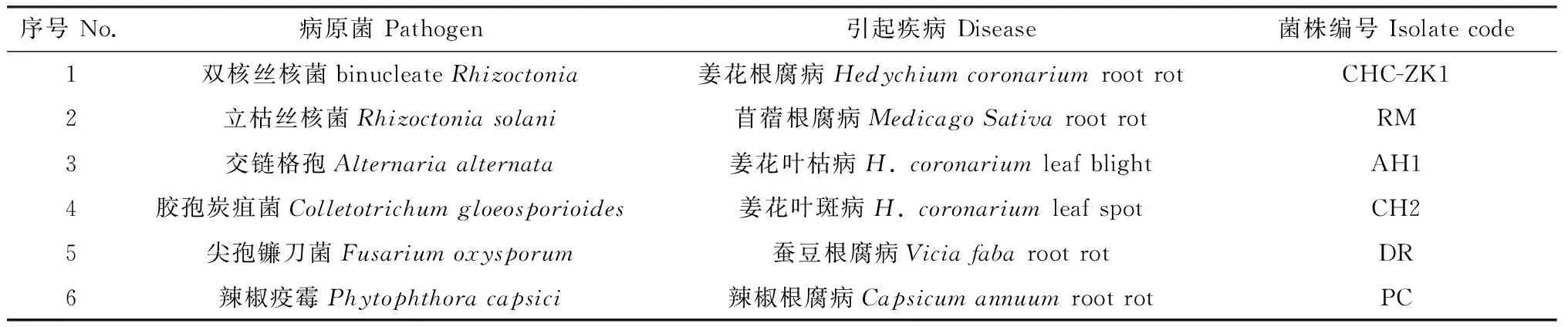
表1 供试植物病原真菌信息Table 1 Information of plant pathogens tested in this study
马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基:马铃薯浸粉5 g、葡萄糖20 g、琼脂20 g。
燕麦(Oatmeal agar,OA)培养基:燕麦片65 g、琼脂15 g。
平板计数琼脂(Plate count agar,PCA)培养基:胰蛋白胨5 g、酵母浸粉2.5 g、葡萄糖1 g、琼脂20 g。
马铃薯蔗糖琼脂(Potato sugar agar,PSA)培养基:马铃薯浸粉5 g、蔗糖20 g、琼脂20 g。
麦芽浸膏琼脂(Malt extract agar,MEA)培养基:麦芽浸膏30 g、大豆蛋白胨3 g、琼脂20 g。
虎红琼脂(Rose bengal chloramphenicol agar,RBC)培养基:蛋白胨5 g、葡萄糖10 g、磷酸氢二钾1 g、硫酸镁1 g、孟加拉红0.033 3 g、琼脂20 g。
1.2 样品采集及分离
2019年5月,从重庆市荣昌区西南大学种植基地采集鸭茅,装入无菌袋中并编号,置于4℃冰箱保存备用。切取新鲜健康的鸭茅叶片(5 mm×5 mm),在70%酒精中浸泡1 min,置于3%次氯酸钠溶液消毒2 min,随后用无菌水冲洗3次,使用无菌吸水纸擦干后,接种至含0.1%氯霉素的PDA培养基。25℃下暗培养4 d后,挑取菌落边缘少许菌丝接种至PDA平板纯化培养,分离筛选得到32株木霉菌株。经对峙实验获得1株对多种病原真菌具有强拮抗作用的木霉菌株,命名为TD-MM。将纯化后的TD-MM菌株转接至PDA斜面保存备用。
1.3 菌株TD-MM的鉴定
1.3.1形态学鉴定 将菌株TD-MM接种于PDA平板上,在25℃恒温黑暗条件下培养,每日观察、记录菌落培养特征,定期在光学显微镜下观察菌丝、分生孢子梗以及分生孢子形态、大小等显微结构特征,作为菌株鉴定的形态学依据。
1.3.2分子鉴定 刮取PDA培养基上的菌丝,按照真菌基因组试剂盒PlantGen DNA Kit (CW0553A) 的方法提取真菌DNA,保存于—20℃备用。分别选用引物ITS4/ITS5,EF1-728F/EF2,fRPB2-5F/fRPB2-7cR[22],LR0R/LR7[23]对真菌的ITS,EF,LSU和RPB片段进行PCR扩增,扩增产物送苏州金唯智生物科技有限公司测序。得到的序列在GenBank上用BLAST进行同源性比较,利用MEGA 5.05软件以最大似然法构建系统发育树。
1.4 菌株TD-MM对植物病原真菌的抑菌活性
采用平板对峙培养法进行抑菌试验,将PDA平板上培养3天的木霉菌株TD-MM和6种植物病原性真菌分别用直径4 mm的打孔器制成菌饼,将菌株TD-MM菌饼与丝核双核菌、立枯丝核菌、尖孢镰刀菌、辣椒疫霉、胶孢炭疽菌、交链格孢的菌饼分别接种在直径为90 mm的PDA平板两侧,2个菌饼相距4 cm。以只接种病原菌为对照,每组设3次重复,25℃恒温培养3天后,观察记录病原菌和TD-MM菌落生长半径,并计算抑菌率。拮抗等级参照Belll等[24]的分级标准。基于平板对峙实验,挑取两菌交界处及病原菌内部的菌丝,通过显微镜进行观察,记录菌株TD-MM和6株病原真菌相互作用的形态特征。

1.5 菌株TD-MM生物学特性的测定
1.5.1培养基对菌株TD-MM生长和产孢量的影响 将直径为4 mm的木霉菌饼转接到PDA,PSA,PCA,MEA,OA和RBC平板中央,于25℃黑暗培养,各试验处理均设3次重复。每天用十字交叉法测量菌落直径。3天后,在平板中加入10 mL无菌水混合均匀,获得病原菌的孢子悬液,稀释后用血球计数板计数,计算每mL孢子悬浮液中的孢子数。
1.5.2温度对菌株TD-MM生长和产孢量的影响 将菌饼移至PDA平板中央,分别于15,20,25,30和35℃黑暗培养,各试验处理均设3次重复。每天测量菌落直径,3天后测量产孢量。
1.5.3pH值对菌株TD-MM生长和产孢量的影响 调节PDA培养基pH值为4,5,6,7,8和9,接种菌饼后于25℃黑暗条件下培养,各试验处理均设3次重复。每天测量菌落直径,3天后测量产孢量。
1.5.4光照对菌株TD-MM生长和产孢量的影响 将菌饼转接至PDA平板中央,在人工气候箱内设置24 h连续黑暗、24 h连续光照、12 h光照/12 h黑暗三种光照条件,于25℃下进行培养,各试验处理均设3次重复。其中,光照强度为5 000 lx。每天测量菌落直径,3天后测量产孢量。
1.5.5菌株TD-MM分生孢子的致死温度测定 将TD-MM菌饼置于经高压蒸汽灭菌的离心管中,每支离心管中加入500 μL无菌水。以10支离心管为一组,每组处理设3次重复。将离心管分别置于40,45,50,55,60,65,70和75℃的水浴锅中加热10 min,冷却后吸取200 μL孢子悬液涂在PDA平板上,培养7天后观察是否有菌丝出现。根据试验结果缩小范围,以1℃为单位设置温度梯度,确定致死温度,测定方法同上。
1.6 菌株TD-MM对姜花、蚕豆和辣椒根腐病的防效测定
试验共设 3个处理:对照(CK)、只接种病原菌(P)、同时接种病原菌和生防木霉TD-MM(P+B),每个处理各重复8次。选取姜花、蚕豆和辣椒长势健康的幼苗,使用灭菌针头刺伤植株根部,挑取病原菌菌丝接种在P组与P+B组植株的创伤处,对照CK组则接种无菌琼脂块,而后用润湿的无菌棉花包裹伤口。刮取PDA平板上的TD-MM菌丝,将其分散到0.1%吐温-80溶液,制成2.0×107cfu·mL-1的孢子悬液。用无菌刀片划出创伤面,针对P+B组的植株注射10 mL生防菌株TD-MM的孢子液,CK组和P组则注射无菌水。将接种后的姜花、蚕豆以及辣椒栽培至无菌土壤中,使用无菌水对植株进行浇灌,接种40 d后挖取植株并清洗根部,参照齐素敏等[25]的方法将发病程度分为6级,观察记录发病程度,测定其鲜重、根重和株高,评定植株的病情指数以及菌株TD-MM的防效。

1.7 数据分析
使用Excel 2016进行数据处理,采用DPS 2005软件Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 菌株TD-MM鉴定
2.1.1菌株TD-MM的形态特征 菌落在PDA平板上生长快,菌丝丛茂密。菌落有不规则轮纹,初期呈白色,最终变为深绿色。显微镜观察可见其瓶颈短,基部变细,中间膨大;孢子梗丛束疏松,环状排列;分生孢子梗从菌丝的侧枝上长出,主分枝呈树状,其上次级分枝多,分枝直角突出或向顶呈放射状;产孢丰富,分生孢子球形或近球形,大小为(3.1~4.2)μm×(2.9~4.0)μm(图1)。根据菌株TD-MM的培养特性和形态特征,初步鉴定该菌株为木霉属(Trichodermaspp.)真菌。

图1 菌株TD-MM的形态特征Fig.1 Morphological characteristics of strain TD-MM注:A为PDA培养基上菌落形态;B为分生孢子梗形态;C为分生孢子形态Note:Panel A displays colony morphology on PDA plate;Panel B conidiophore;Panel C conidia
2.1.2菌株分子序列分析 提取菌株的DNA,对ITS,EF,RPB和LSU基因序列进行PCR扩增,获得的片段大小分别为593,532,1 065和1 306 bp。序列提交至GenBank,获得的登陆号分别为OK445673,OK501223,OK501222,OK445501。ITS序列(OK445673)与哈茨木霉VRU-Th137(KJ000320),G360(MH651386)以及CTCCSJ-G-HB40547(KY750324)的同源性均为100%。EF序列(OK501223)与哈茨木霉IMI 359823(AF348092),T139(MW803055)以及GJS 05-116(FJ463320)的同源性均为100%。RPB序列(OK501222)与哈茨木霉T11(KX632543),GJS 05-107(FJ442708)和T35(KX632561)的同源性分别为99.81%,99.81%和99.72%。LSU序列(OK445501)与MF13025(KC809921),BCC
基于EF-1α序列(OK501223)与Trichoderma属的相关序列构建系统发育树,其与哈茨木霉T11(KX632600),Thaum14(MT081434),DAOM242937(KX463434)和96E(MT732942)聚于同一分支,亲缘关系最近(图2)。结合形态学特征,明确菌株TD-MM为哈茨木霉(T.harzianum)。
2.2 菌株TD-MM对植物病原菌的抑菌活性
平板对峙培养的结果表明,内生木霉TD-MM对6种植物病原菌均有较好的抑制作用。菌株TD-MM对丝核双核菌、立枯丝核菌和辣椒疫霉的抑菌效果最为突出(图3),培养7天后抑菌率高达100%,拮抗等级达到I;对尖孢镰刀菌、胶孢炭疽菌、交链格孢的抑菌效果明显,7天时抑菌率分别为85.11%,78.86%和67.56%,拮抗等级达到II(表2)。

图2 基于EF-1α序列构建菌株TD-MM及其相关菌株的系统发育树Fig.2 Phylogentic tree of isolate TD-MM and other related isolates based on EF-1α sequences
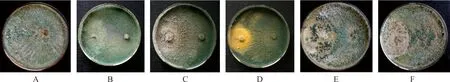
图3 菌株TD-MM与多种病原菌的对峙实验Fig.3 Strain TD-MM confronted against different pathogenic fungi注:A为菌株TD-MM对峙双核丝核菌;B为菌株TD-MM对峙立枯丝核菌;C为菌株TD-MM对峙辣椒疫霉;D为菌株TD-MM对峙尖孢镰刀菌;E为菌株TD-MM对峙胶孢炭疽菌;F为菌株TD-MM对峙交链格孢Note:Panel A shows TD-MM against binucleate Rhizoctonia;Panel B TD-MM against R. solani;Panel C TD-MM against P. capsici;Panel D TD-MM against F. oxysporum;Panel E TD-MM against C. gloeosporioides;Panel F TD-MM against A. alternata

表2 菌株TD-MM对植物病原菌生长的拮抗效果Table 2 Inhibititory effects of strain TD-MM on the growth of plant pathogens

续表2
基于显微镜检的结果,推测哈茨木霉菌株TD-MM通过空间竞争和重寄生抑制6种植物病原菌的生长(图4)。菌株TD-MM与病原菌接触后,能够迅速占领其生长空间,从而取得竞争优势。而后TD-MM菌丝攀附、缠绕病原菌的菌丝,呈现螺旋状的结构。该生防菌能够浓缩病原菌菌丝的原生质,逐渐消解病原菌的菌丝,使其缢缩或断裂,从而实现重寄生作用。

图4 菌株TD-MM对病原菌菌丝生长的影响Fig.4 Effects of strain TD-MM on the hyphae growth of pathogens注:A为TD-MM缠绕丝核双核菌;B为TD-MM使丝核双核菌细胞原生质浓缩;C为TD-MM使交链格孢菌细胞原生质浓缩Note:Panel A displays TD-MM twined binucleate Rhizoctonia;Panel B TD-MM made binucleate Rhizoctonia protoplasm become blighted;Panel C TD-MM made Alternaria alternata protoplasm become blighted
2.3 哈茨木霉菌株TD-MM的生物学特性
2.3.1培养基对菌株TD-MM生长和产孢量的影响 菌株TD-MM在RBC和PDA平板上生长较快,培养2天平均菌落直径分别达到5.42 cm和4.91 cm,3 d即长满培养基;在OA,MEA和PCA平板上,培养4 d便达到9.00 cm;在PSA培养基上生长最慢。菌株在RBC培养基和PDA培养基上产孢量最大,为3.5×108个·mL-1和3.2×108个·mL-1;在PSA培养基上产孢量最低(表3)。
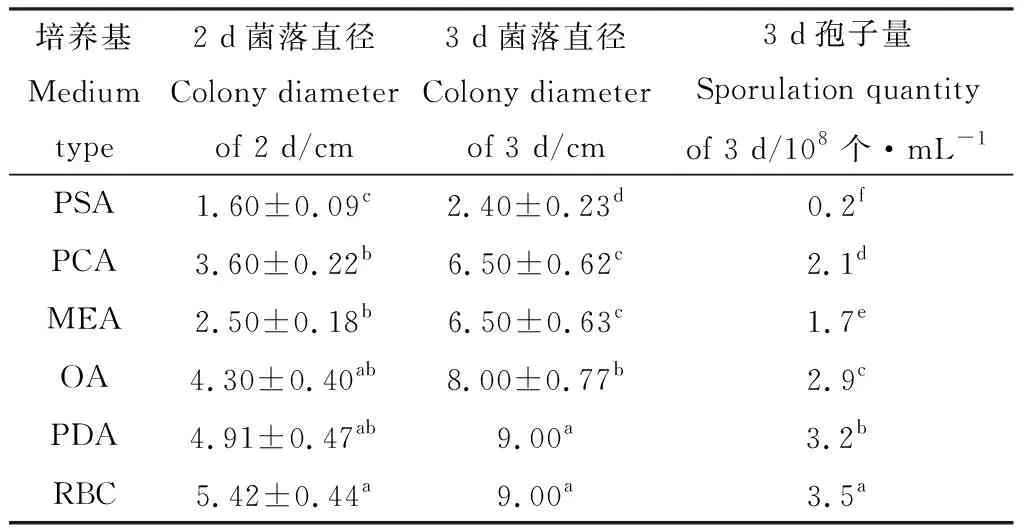
表3 培养基对菌株TD-MM生长和产孢的影响Table 3 Effects of medium types on the growth and sporulation of strain TD-MM
2.3.2温度对菌株TD-MM生长和产孢量的影响 菌株TD-MM最适生长温度和最适产孢温度均为30℃,培养2 d平均菌落直径达到6.72 cm,培养3 d即可长满培养基,产孢量达3.7×108个·mL-1。当温度低于20℃或者高于35℃时,菌丝生长速度和产孢数量明显下降(表4)。

表4 温度对菌株TD-MM生长和产孢的影响Table 4 Effects of temperature on the growth and sporulation of strain TD-MM
2.3.3pH值对菌株TD-MM生长和产孢量的影响 菌株TD-MM在pH值为4~9范围内均可生长。在pH=5时菌丝生长较快,产孢量较多,培养2 d平均菌落直径达到6.79 cm,培养3 d即可长满培养基,产孢量达3.3×108个·mL-1(表5),表明该菌株生长和产孢更偏好弱酸性的环境。

表5 pH值对菌株TD-MM生长和产孢的影响Table 5 Effects of pH value on the growth and sporulation of strain TD-MM
2.3.4光照对菌株TD-MM生长和产孢量的影响 菌株TD-MM在光暗交替条件下生长最快,产孢最多,培养2 d平均菌落直径达到6.77 cm,3 d即长满培养基;在完全黑暗条件下,培养2 d平均菌落直径达到4.93 cm,其菌落生长速度和产孢量与连续光照条件下的菌落相近(表6)。
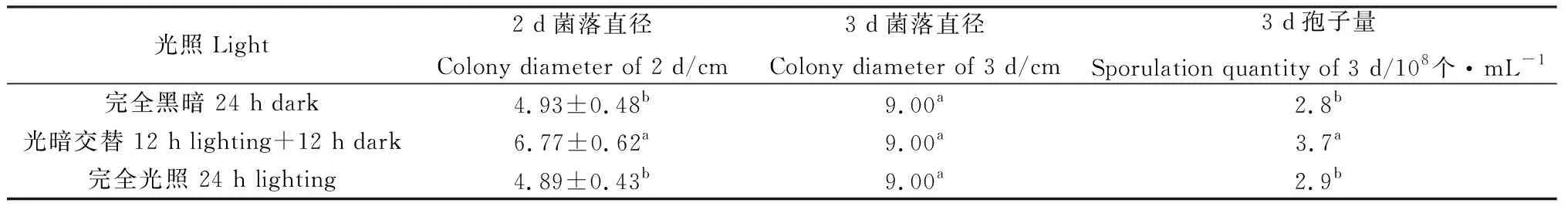
表6 光照对菌株TD-MM生长和产孢的影响Table 6 Effects of light conditions on the growth and sporulation of strain TD-MM
2.3.5菌株TD-MM致死温度测定 菌株TD-MM孢子悬液在60~70℃的温度处理10 min后,冷却转接到培养基上未观察到菌丝出现。当水浴锅温度控制在55~59℃时,可见有菌落形成;但在60℃的温度下未见有孢子萌发,由此确定分生孢子致死温度为60℃。
2.4 菌株TD-MM对姜花、蚕豆和辣椒根腐病的防效测定
如表7所示,姜花致病处理(P)病情指数高达92.5,蚕豆和辣椒致病处理则分别达到66.67和68.75,致病处理下3种植株的鲜重、根部鲜重以及植株高度均显著低于对照(CK)水平,其生长发育明显受到抑制。接种生防菌株TD-MM的处理(P+B)病情指数在23.61~27.08之间。其中,菌株TD-MM对姜花根腐病的防效达到74.32%,对蚕豆和辣椒根腐病的防效分别为59.38%和65.66%(表7)。经内生木霉TD-MM处理后,3种作物的株重和根重均较对照显著增加,表明菌株TD-MM具有促进根部生长的能力,有利于植物的生殖和发育。

表7 菌株TD-MM对姜花、蚕豆和辣椒根腐病的防效Table 7 The control effect of strain TD-MM against H. coronarium,V. faba and C. annuum root rot
3 讨论
本研究从重庆市荣昌区鸭茅叶片分离并筛选出一株强拮抗作用的生防菌株TD-MM,经形态特征与rDNA-ITS,EF-1α,LSU rDNA和RPB2序列分析,完成对生防木霉的鉴定。由于木霉中某些组的ITS序列相似度极高,EF-1α在识别木霉菌时更为可靠[26]。因此,本实验基于EF-1α序列构建了菌株TD-MM的系统发育树,结合形态学鉴定确定该菌株为哈茨木霉(T.harzianum)。
内生木霉TD-MM对双核丝核菌(binucleateRhizoctonia)、立枯丝核菌(R.solani)以及辣椒疫霉(P.capsici)拮抗效果高达100%,对尖孢镰刀菌(F.oxysporum)的抑制率达到85.11%,表现出极强的竞争力。这一结果说明菌株TD-MM对根腐病害的防治具有巨大的应用潜力。张建[27]研究表明,木霉NJAU4742能够覆盖6种病原真菌,显微镜下可观察到木霉菌丝缠绕病菌菌丝,呈现出较好的重寄生能力。本实验基于平板对峙以及显微镜检,观察到内生木霉TD-MM在抵御病原菌时能迅速扩展,包围病原菌菌落,侵占生存空间,并在后期完全覆盖或部分覆盖病原真菌,推测其拮抗机制主要为空间竞争和重寄生。防效测定结果也印证了菌株TD-MM对姜花、蚕豆和辣椒根腐病显著的防治能力。Rajani等[28]从药用植物分离筛选得到的内生木霉主要通过竞争、重寄生和产生挥发性有机化合物实现抑菌效果。挥发性有机化合物能够逸散到环境中,在抗真菌、促生和诱导抗性中起到举足轻重的作用[29-31]。关于菌株TD-MM分泌挥发性代谢物的种类、含量及其功能还有待深入研究。
木霉的促生机制是多种机制协同的效果[32]。一方面,木霉可直接参与植物重要生理过程[33];另一方面,木霉通过改善土壤环境,间接促进作物营养吸收与生长发育[34]。课题组在前期研究中发现,鸭茅根际木霉有利于植株干物质、粗灰分、粗蛋白、粗脂肪及钙、磷含量的增长,明显提高鸭茅的营养品质[35]。此外,鸭茅内生哈茨木霉可通过分泌IAA、溶磷、固氮、解钾来促进作物增产[36]。相关研究指出,木霉能够刺激主根的生长以及侧根和根毛的形成[37]。本文防效试验表明,同时接种病原菌和生防木霉TD-MM后,姜花、蚕豆和辣椒的株高相较于空白对照分别增长了7.09%,4.99%和8.56%,根重则分别提高了9.42%,9.04%和11.39%。未来可对鸭茅叶片相关生理生化指标进行测定,如可溶性蛋白含量、可溶性糖含量与抗氧化酶活性等,以进一步探明菌株TD-MM的促生机理。
明确优良生防菌株的最佳培养条件,可为菌剂开发和生产应用提供数据支撑。内生木霉TD-MM在虎红琼脂(RBC)培养基上生长速度最快,产孢量最大,推测造成该结果的主要因素是培养基成分中的硫酸镁。镁元素作为生物体内的大量元素,不仅是细胞内一般分子成分,还可作为酶的激活剂调节微生物的生理过程。郭成等[38]的研究表明,以葡萄糖为碳源的培养基对短密木霉菌株GAS1-1的菌落生长和产孢效果最好,而蔗糖效果最差。本实验中,相比起马铃薯蔗糖琼脂(PSA)培养基,马铃薯葡萄糖琼脂(PDA)培养基更有利于木霉菌株的营养生长和产孢,印证了上述结论。原因可能在于葡萄糖是单糖,更容易被微生物吸收、分解与利用。曾华兰[39]从四川省简阳市丹参根际土壤分离筛选获得哈茨木霉T23。其研究结果表明,T23菌丝生长和产孢的最适温度为25~30℃,最适pH值为5~7,光暗交替条件下菌丝生长最好、产孢量最多,与本课题分离自重庆市荣昌区的TD-MM结果相近。考虑到四川、重庆比邻而居,气候相近,因此,来自川渝地区的菌株在生物学特性上可能存在一定的相似性。综上,菌株TD-MM具有较好的环境适应能力,能广泛应用于土传病害的防治。田间环境条件较为复杂,易受自然气候等因素的影响,尽管本文的活体接种实验取得较好的防治效果,但距离大规模的应用还存在一定的差距。后续研究可优化筛选木霉TD-MM菌剂发酵条件,并对其定殖能力和生物安全性作评估。
4 结论
本研究从鸭茅上分离筛选到一株哈茨木霉TD-MM,其生长速度快,产孢量大,生态适应性较强,对不同植物病原菌具有较强的抑制效果,生防价值高。推测哈茨木霉TD-MM通过生长空间竞争和重寄生作用抑制植物病原真菌。内生木霉TD-MM对姜花、蚕豆以及辣椒的根腐病防效较好,且有利于提高作物的生长性能。深入挖掘、利用我国的内生菌资源,能够为生防菌剂的开发奠定新条件,为农牧产业的发展提供新思路。
