定向微孔镁掺杂羟基磷灰石生物陶瓷降解及其生物学性能研究
2023-03-04赵雪妮刘一佛王鹏飞魏森森刘明玥
赵雪妮,刘一佛,王鹏飞,魏森森,刘明玥,杨 智
(陕西科技大学 机电工程学院,陕西 西安 710021)
0 引言
人体骨骼具有很强的自我再生和重塑(旧骨吸收和新骨沉积)的能力,可以在受损后自发恢复其功能和结构.对于退行性骨疾病或较大的缺损,骨再生的要求超过了骨自发的自愈潜能,因此需要骨移植或骨替代材料来支持骨组织的再生[1,2].
理想的骨组织工程材料应具有的特性是[3-5]:(1)具有良好的生物相容性和诱导成骨的能力,以支持细胞粘附、迁移和增殖,不产生免疫排斥作用;(2)具有生物活性,与宿主骨组织之间产生特殊的生物、化学反应,形成良好化学键合;(3)具有可控生物降解性,为了最终被宿主组织取代,支架需要在体内降解为无毒产物,降解速度与植入部位的新组织生长速度相当;(4)具有类似松质骨的高度互连的孔隙形态和结构,允许蛋白质吸附,氧气、营养物质、信号分子的有效运输和代谢废物的移除,促进新骨组织向孔隙内部长入.
孔隙的大小和形状是决定骨缺损愈合的关键因素.研究发现:孔径尺寸为15≤d≤40 μm,允许纤维组织长入;孔径为40≤d≤100 μm,允许非矿物类骨组织长入;d>100 μm,允许细胞穿透、血管和骨组织长入[6,7].微孔(d<10 μm)可以提供有效的营养物质和成骨相关的信号分子,促进细胞和移植体之间的相互作用[8,9].因此获得高度相似天然骨的孔隙结构,能够在人体骨缺损修复中发挥重要作用.
本研究是在之前以CF(碳纤维)为造孔剂,制备微孔CF增强Mg掺杂HA(CF/Mg-HA)复合材料[10,11],为使材料更好地用于骨修复中,研究微孔Mg-HA材料体外生物相容性、降解性能,以及深入分析探讨植入动物体内后宿主骨组织的相互作用以及成骨机理.
1 实验部分
1.1 实验原料
直径5~7 μm的CF购自日本东邦泰纳克斯有限公司,六水硝酸镁(Mg(NO3)2·6H2O)、四水硝酸钙(Ca(NO3)2·4H2O)和磷酸氢二铵(NH4)2HPO4、氨水(NH4OH)国药集团化学试剂有限公司,盐酸(HCl)、浓硫酸(H2SO4)、浓硝酸(HNO3)购自国药集团化学试剂有限公司.
1.2 Mg-HA粉体的制备
配置浓度为0.167 mol/L Ca(NO3)2·4H2O、0.05 mol/L Mg(NO3)2·6H2O和0.1 mol/L的(NH4)2HPO4水溶液.量取16.67 mL的Mg(NO3)2倒入到90 mL Ca(NO3)2溶液中,搅拌混合3~5 min,混合均匀后称取100 mL的(NH4)2HPO4溶液逐滴加入混合溶液中.混合溶液pH稳定后,加入氨水将PH值调整到10±0.02.将所得溶液倒入反应釜中,在170 ℃下水热反应24 h至自然冷却.随后将反应物溶液水洗三次,在80 ℃干燥4 h后,研磨得到Mg-HA粉体并干燥储存.
1.3 CF/Mg-HA坯体的制备
连续CF分散成具有不同CF数量的纤维束(每束2根CF),CF束纵、横交错(正交)分布固定在铜版纸的指定位置.相邻纤维束的距离设定为400 μm,获得连续CF层.根据实验所需的CF层数(10层)将的Mg-HA粉体和连续CF层铜版纸交替放置到模具中,获得CF/Mg-HA坯体.
1.4 微孔Mg-HA生物陶瓷的制备
烧结工艺如图1所示.具体过程为:将1.3节得到的连续CF/Mg-HA坯体放置到热压炉内致密化烧结,升温至500 ℃开始施加30 MPa压力,温度900 ℃保温30 min,然后降温至500 ℃后,撤压、随炉冷却,升温和降温速率均为10 ℃/min,获得CF/Mg-HA复合材料.将连续CF/Mg-HA复合材料放置在微型箱式炉中,在600 ℃热处理180 min,得到致密/微孔Mg-HA生物陶瓷
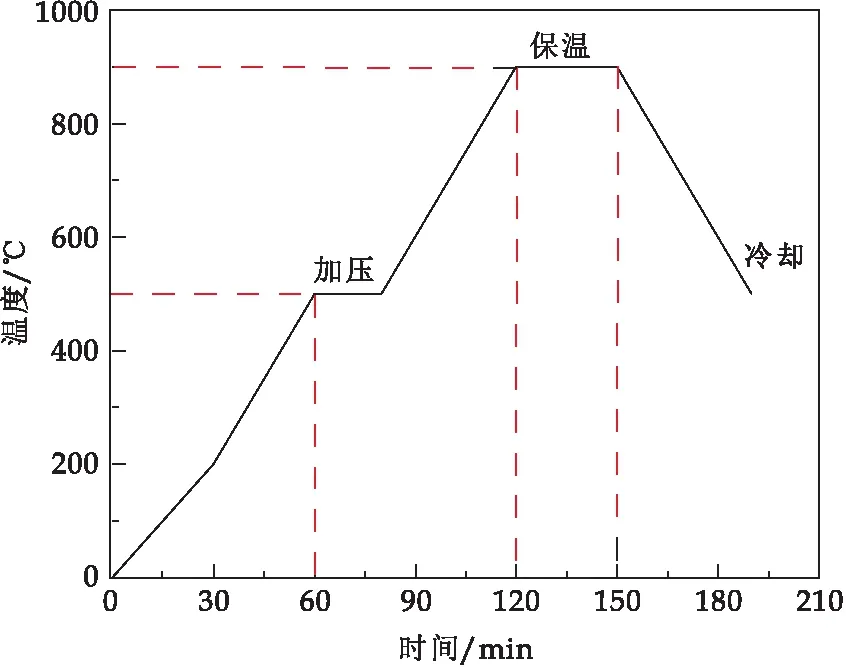
图1 烧结工艺
1.5 表征与性能测试
1.5.1 体外降解性能测试
采用Tris-HCl(三羟甲基氨基甲烷盐酸盐)降解液浸泡法对HA、致密Mg-HA和微孔Mg-HA的降解性能进行表征.将试样在37 ℃、pH=7.4的降解液中浸泡7~14天.随后,取出试样,用蒸馏水洗涤并在室温下干燥.记录浸泡前后试样的质量变化.采用扫描电子显微镜(SEM;AJEOL,JSM-6460)观察HA、致密Mg-HA和微孔Mg-HA试样在Trils-HCl缓冲液中浸泡7、14、28和56天的表面降解情况.提取浸泡后的上清液,检测溶液pH值变化.通过ICP(电感耦合等离子体发射光谱仪)检测滤液中离子释放的浓度.
1.5.2 体内成骨性能
选取体重为350±50 g的健康雄性大鼠10只作为实验动物,对其进行麻醉和消毒处理.取后肢外侧进行切口处理,切开皮肤、剥离骨膜,露出胫骨表面.用钻头(直径:3 mm)垂直钻出深度为3 mm的孔并植入材料,盐水冲洗缺损部位逐层缝合,保持相同条件饲养.
1.5.3 组织形态学分析
采用Micro-CT(Y.Cheetah,YXLON国际股份有限公司,德国)扫描胫骨标本,观察骨组织-生物材料界面及生物材料周围新生骨的生长情况.采用VG Studio2.1V分析骨体积密度(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)和骨小梁间距(Tb.Sp).对带有植入物的胫骨组织标本在甲醛溶液中浸泡24 h进行固定,依次使用80%无水乙醇、丙酮和95%无水乙醇,进行脱水.处理后采用甲基丙烯酸甲酯(PMMA)进行包埋.用硬组织切片机(Leica SP1600)沿着样品最大截面处(移植体轴向)切割组织标本,切片厚度约50~80 μm.将切片在研磨机上用砂纸打磨,得到大约30 μm的硬组织切片,进行Picric acid酸性复红(Van Gieson,VG)和苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,用光学显微镜(OLYPUS,IX73)观察并采集染色后图像.
2 结果与讨论
2.1 HA、致密/微孔Mg-HA陶瓷的体外降解性能
不同材料的质量变化如图2(a)显示,三种材料在浸泡期间都逐渐降解,HA的质量在浸泡7~28天内几乎没有显著改变,直至浸泡56天后,HA的质量减少了0.59%.而致密Mg-HA和微孔Mg-HA在开始浸泡的7~14天内质量也无显著变化,在浸泡28天的质量分别减少了0.59%和1.096%,微孔Mg-HA的质量损失是致密Mg-HA的2倍左右,是HA质量损失的856.25%.随着浸泡时间的延长(至56天后),微孔Mg-HA的质量减少提高到2.74%,分别比致密Mg-HA和HA质量损失率提高了43.3%和364.41%,呈现出最快的降解速率.

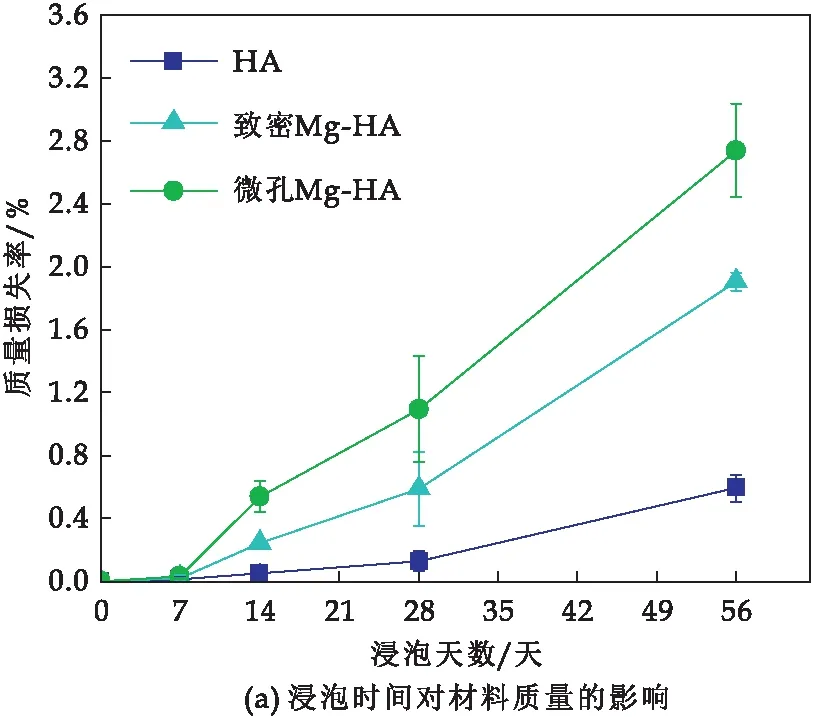
图2 微孔Mg-HA、致密Mg-HA和HA在Trils-HCl中浸泡不同时间的质量变化(a)及离子变化(b-c)
2.2 微观形貌分析
HA、致密Mg-HA、和微孔Mg-HA浸泡7、14、28和56天后的表面微观形貌如图3~6所示.如图所示,所有样品都不同程度的降解.HA在浸泡0~28天材料表面可以观察到轻微的降解.由于材料的溶解,在其表面形成大片微小的凹痕.随着浸泡时间的延长,表面变得更加粗糙,到56天后HA表面可见一些分散的碎片,降解加剧.而致密Mg-HA和微孔Mg-HA在浸泡14天时材料表面就观察到明显的凹坑和缝隙,微孔Mg-HA的孔隙区域(黄色箭头)溶解速率明显快于基体区域.随着浸泡时间的延长材料降解越明显,直到56天后微孔Mg-HA的孔壁和基体区域都可以观察到一些降解后的小碎屑.

图3 Trils-HCl溶液中浸泡7天的SEM图

图4 Trils-HCl溶液中浸泡14天的SEM图

图5 Trils-HCl溶液中浸泡28天的SEM图

图6 Trils-HCl溶液中浸泡56天的SEM图
2.3 HA、致密/微孔Mg-HA陶瓷的体内降解性能


图7 植入大鼠胫骨缺损部位8周后试样的Micro-CT三维重建图
2.4 HA、致密/微孔Mg-HA陶瓷的体内成骨性能
植入大鼠胫骨8周后的三维重建和位矢图如图8~10所示.材料牢固的固定在胫骨内,没有松动和脱出的现象产生,图中白色区域是φ3×3 mm的试样,黄色区域代表新生骨组织(选择的感兴趣区域为:样品表面100 μm以内).各实验组的骨缺损区域可明显观察到更均匀致密的一层黄色新生骨,且新生骨组织与移植体骨界面紧密结合.从三种样品(去除材料和骨组织)新生骨的位矢图中可以看出微孔Mg-HA的新生骨量明显高于致密Mg-HA组和HA组,而HA组黄色区较稀薄,新生骨量最低.微孔Mg-HA组和致密Mg-HA组的新生骨量之间没有显著差异,但明显高于HA组,这表明8周之后骨愈合程度显著.

图8 HA植入大鼠胫骨缺损部位8周后的Micro-CT三维重建图

图9 致密Mg-HA植入大鼠胫骨缺损部位8周后的Micro-CT三维重建图

图10 微孔Mg-HA植入大鼠胫骨缺损部位8周后的Micro-CT三维重建图
植入胫骨8周后骨缺损区的3D重建形态计量学分析结果如图11所示.HA、致密Mg-HA和微孔Mg-HA植入8周后的骨体积密度(BV/TV)分别为27.55%、32.5%和40.5%,微孔Mg-HA和致密Mg-HA的骨体积密度分别比HA高23.18%和40.14%.表明Mg2+的掺杂以及微孔道的引入明显提高了材料的成骨能力,且植入8周后微孔Mg-HA显示出最好的成骨愈合情况.营养物质和成骨诱导因子等可以通过的微孔(5~14 μm)有效地输送到新骨生长的缺损区域[15,16].因此,微孔Mg-HA的成骨诱导效果优于致密Mg-HA和HA.三种材料的骨小梁数目(Tb.N)没有显著变化,而微孔Mg-HA的骨小梁间距(Tb.Th)是低于HA和致密Mg-HA.
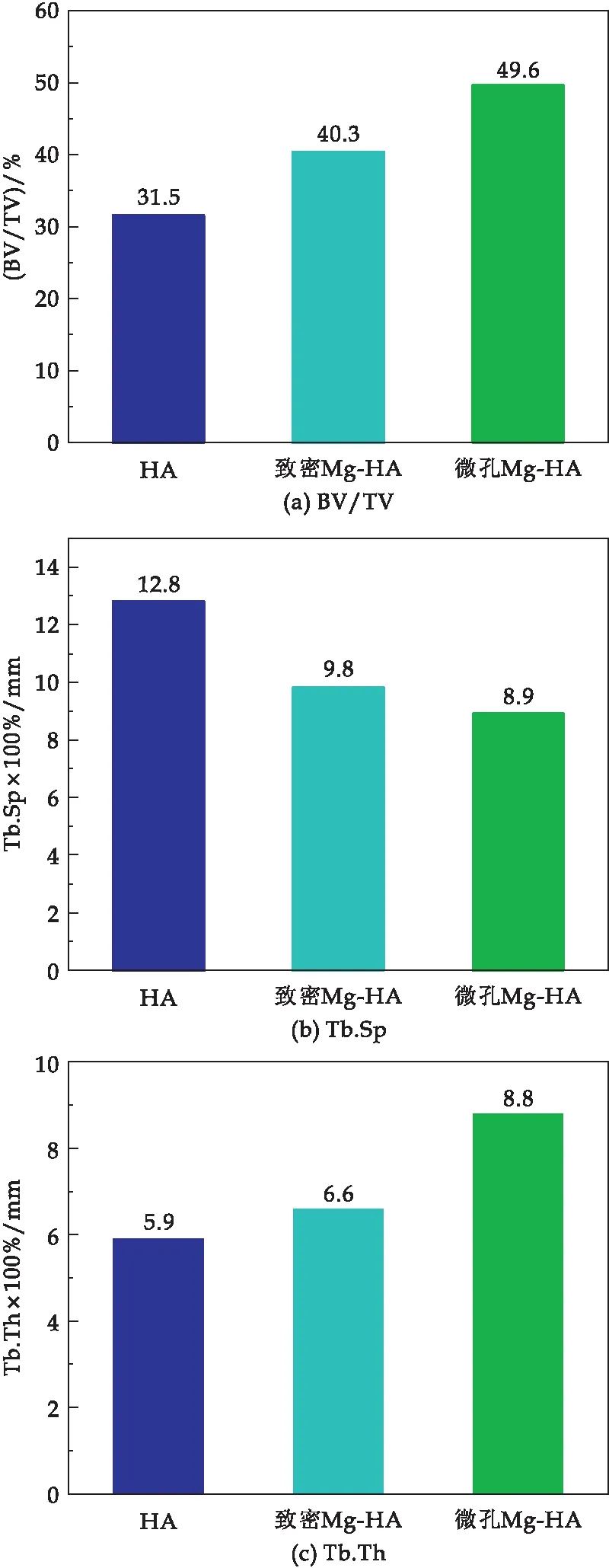
图11 骨缺损区的3D重建形态计量学分析结果
2.5 组织形态学分析
植入大鼠胫骨缺损部位8周的HA、致密Mg-HA、微孔Mg-HA的切片进行HE染色,结果如图12所示.HA植入体与骨组织之间有明显的间隙存在,而致密Mg-HA的间隙明显比HA小,微孔Mg-HA植入体与宿主骨结合紧密.放大图中,对于致密Mg-HA和微孔Mg-HA,可见清晰纤维组织和新生骨组织沿着材料周围生长,而HA的宿主骨组织附近观察到较少新生骨的形成.

图12 HA、致密Mg-HA、微孔Mg-HA植入8周的HE染色图
VG染色如图13所示,可以观察到新生骨的形态及植入体与骨组织的界面与HE染色图片结果相似,HA在植入8周后与宿主骨组织之间观察到较大的间隙,而致密Mg-HA和微孔Mg-HA与新骨组织紧密结合,沿着植入体表面生长着红色的新骨组织,其中微孔Mg-HA周围新生骨组织较其它两组最多.在植入体-宿主骨界面没有观察到炎症细胞和慢性炎症反应,骨愈合情况良好.
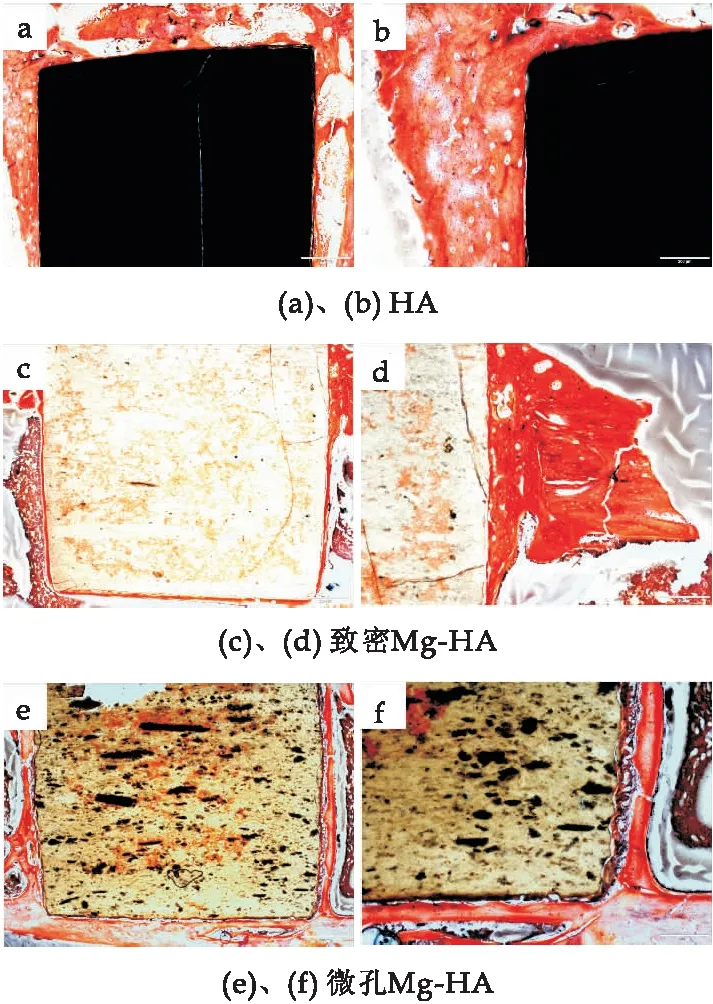
图13 HA、致密Mg-HA、微孔Mg-HA植入8周的VG染色图
综合考虑阳性细胞百分率和阳性染色程度等评价阳性表达的两个因素,运用Image-Pro Plus图像处理软件计算HA、致密/微孔Mg-HA积分光密度(IOD)和图像面积.推导阳性水平指数(positive level index,PLI)的计算公式,即阳性水平指数(PLI)=阳性细胞百分率×平均光密度(AOD),作为定量分析的指标[17,18].
通过表1、表2对比发现,阳性水平指数 PLI 的大小排序如下:HA <致密Mg-HA<微孔Mg-HA,这与实际的Micro-CT三维重建结果基本相吻合.个别染色出现的偏差是由于PLI参数的计算取决于很多因素,着色程度不仅取决于样本的含量和分布密度,还与样本的敏感性、切片厚度、显色时间等多种技术因素有关[19,20].
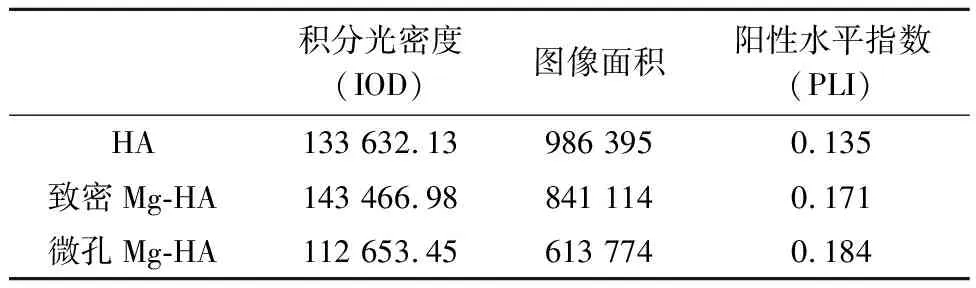
表1 HE染色基于组合参数的分析结果

表2 VG染色基于组合参数的分析结果
2.6 成骨机制
微孔道对骨修复和骨重塑的影响机制如图14所示.在骨修复和重建过程中,生理液体中有关的各种细胞(破骨细胞、成骨细胞等)、内源性骨诱导生物分子、其他生物因子和一些营养物质(蛋白质、维生素等)在微孔的毛细作用力下被动迁移渗透到微孔中,通过连通的孔道运输到受损伤部位[21,22].微孔道也可以为各种生物分子和生长因子提供出储存空间,事实上,虽然人们普遍认为骨只能在100 μm或更大的大孔中生长,然而研究表明,在材料的微孔中也存在骨成分,即胶原、类骨质、细胞或骨矿物质[23].此外,在重建阶段,当移植体被破骨细胞和相关细胞因子降解时会释放大量镁、钙和磷酸盐离子,这些离子不仅为新骨的生成提供原料,也可以调节成骨细胞表型,促进骨桥蛋白的表达,刺激局部新骨形成.

图14 微孔Mg-HA中微孔道的成骨机制
3 结论
本研究通过热压烧结结合造孔热处理工艺实现定向微孔Mg-HA生物陶瓷的制备,依次研究体内外降解性能、体内成骨性能及成骨机制,结论如下:
(1)微孔Mg-HA在大鼠体内植入8周后,材料发生了明显降解,表面的凹坑数目显著增加.在体外Trils-HCl缓冲液中浸泡28天后,微孔Mg-HA的质量损失是致密Mg-HA的2倍左右,是HA质量损失率的856.25%.浸泡56天后,微孔Mg-HA的质量减少量显著提高,分别比致密Mg-HA和HA质量损失率提高了43.3%和364.41%,含有微孔道的Mg-HA呈现出最快的降解速率.
(2)微孔Mg-HA和致密Mg-HA的骨体积密度分别比HA高23.18%和40.14%,具有微孔通道的Mg-HA呈现出最好的成骨能力.
(3)微孔Mg-HA生物陶瓷植入动物骨缺损部位后,骨组织与植入体紧密结合,无间隙并沿着材料表面生长,表明该材料具有较好的成骨性能,作为骨修复材料具有广阔的应用前景.
