基于TMT蛋白组学的硝酸铀酰诱导CHO-K1细胞损伤研究
2023-03-04尹晶晶王志鹏李建华李建国
尹晶晶,刘 欢,高 洁,王志鹏,袁 慧,李建华,李建国
(中国辐射防护研究院 放射医学与环境医学研究所 药物毒理与放射损伤药物山西省重点实验室 中核集团放射毒理与放射性药物临床前评价重点实验室,山西 太原 030006)
0 引言
铀在自然界天然存在[1],铀溶液中主要以铀酰离子为主要形式[2].铀具有放射和化学双重毒性,人们对铀毒性的关注主要是作为重金属元素的铀的化学毒性而非放射毒性[3,4].铀可通过吸入、皮肤破损、水和食物链等方式进入人体,对人体组织和器官造成损伤[5].研究发现,铀进入体内可在肾脏[6]、骨骼[7]、肝脏、生殖系统[8]等多个器官富集,造成器官损伤,增加癌症的发病率[9].文献中报道的铀的毒性作用机制研究主要集中在氧化应激、DNA损伤、蛋白结合与功能异常、炎症及凋亡和自噬等[10-14],但铀的毒性作用机制仍不清楚.
蛋白表达水平与生物学功能表型特征最相关,随着色谱和质谱技术的飞速发展,蛋白组学研究得到飞速发展,通过检测蛋白的表达水平,建立蛋白相互作用网络,实现了在蛋白水平对作用机制的深入研究.应用蛋白组学在细胞层面进行铀毒性研究较少.
因此,本研究应用串联质谱标签(Tandem Mass Tag,TMT)标记蛋白组学技术筛选硝酸铀酰染毒后CHO-K1细胞中差异表达的蛋白,并对差异表达的蛋白进行功能富集分析,筛选出关键靶蛋白和信号通路,以期进一步探索硝酸铀酰染毒对CHO-K1细胞损伤潜在的分子机制.
1 材料与方法
1.1 实验材料与仪器
1.1.1 主要材料
CHO-K1细胞,购于中国科学院典型培养物保藏委员会细胞库.
硝酸铀酰(美国Sigma公司);F-12K培养基(美国Gibco公司);胎牛血清(美国Gibco公司);SDS裂解液(上海碧云天公司);BCA蛋白定量试剂盒(美国ThermoScientific公司);PMSF(美国Amresco公司);TMT标记试剂盒(美国ThermoFisher公司);质谱级乙腈(美国ThermoScientific公司);羟胺(美国Sigma公司);质谱级水(美国ThermoScientific公司).
1.1.2 主要仪器
CO2培养箱(美国ThermoScientific公司);十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳仪(北京市六一仪器厂);酶标仪(上海科华实验系统有限公司);全自动数码凝胶图像分析系统(上海天能科技有限公司);Q Exactive plus质谱仪(美国ThermoFisher公司);高pH分离液相色谱仪(美国Agilent公司).
1.2 实验方法
1.2.1 细胞培养
CHO-K1细胞培养于含10% 胎牛血清的F-12K培养基中,置于37 ℃,5% CO2培养箱中培养.
1.2.2 细胞存活率测定
采用Cell Counting Kit-8(CCK-8)法测定细胞存活率.分别加入0 μmol/L、50 μmol/L、100 μmol/L、300 μmol/L和500 μmol/L 硝酸铀酰,在37 ℃,5% CO2培养箱孵育12 h、24 h、48 h和72 h后,去除培养基,每孔加入100 μl空白培养基和10 μl CCK-8溶液,于37 ℃孵育2.5 h,使用酶标仪检测450 nm波长处的OD值,实验重复3次.细胞存活率=(染毒孔-空白孔)/(对照孔-空白孔)× 100%.
1.2.3 TMT标记及蛋白组学检测
实验分为对照组和硝酸铀酰染毒组.对照组细胞为正常CHO-K1细胞,硝酸铀酰染毒组染毒浓度为500 μmol/L,染毒时间24 h.加入裂解液和蛋白酶抑制剂PMSF,取对照组和染毒组CHO-K1细胞提取总蛋白.
提取出的总蛋白用胰蛋白酶酶解后,加入TEAB缓冲液,用TMT试剂盒进行肽段标记,加入TMT试剂,涡旋混匀后室温放置1 h,加入5%羟胺反应15 min,-80 ℃保存备用.
反相色谱分离,色谱条件:流动相ACN-H2O,流速300 μL/min.收集样品后真空冷冻干燥抽干,进行色谱-质谱联用分析.
1.2.4 数据处理
应用Proteome DiscovererTM 2.4(美国ThermoFisher公司)软件进行数据分析,使用的数据库为Uniprot,检索条件为FDR < 0.01.以差异倍数FC > 1.5,且差异显著性P-value < 0.05为标准筛选差异表达蛋白.
1.2.5 生物信息学分析
对筛选出的差异表达蛋白进行基因本体(Gene Ontology,GO)功能注释分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析及蛋白相互作用网络分析.
2 结果与讨论
2.1 细胞存活率测定结果
CHO-K1细胞经0 μmol/L、50 μmol/L、100 μmol/L、300 μmol/L、500 μmol/L 硝酸铀酰染毒12 h、24 h、48 h和72 h,细胞存活率测定结果如图1所示.由图1可知,随着硝酸铀酰浓度的升高,细胞存活率逐渐降低,且随着作用时间的增加,细胞存活率也呈下降趋势.染毒12 h后50 μmol/L染毒组细胞存活率较对照组显著降低(P<0.05),100 μmol/L、300 μmol/L和500 μmol/L染毒组细胞存活率显著降低(P<0.01);染毒24 h后50 μmol/L、100 μmol/L、300 μmol/L和500 μmol/L染毒组细胞存活率显著降低(P<0.01);染毒48 h后50 μmol/L、100 μmol/L、300 μmol/L和500 μmol/L染毒组细胞存活率显著降低(P<0.01);染毒72 h后50 μmol/L和300 μmol/L染毒组细胞存活率显著降低(P<0.05),100 μmol/L和500 μmol/L染毒组细胞存活率显著降低(P<0.01).
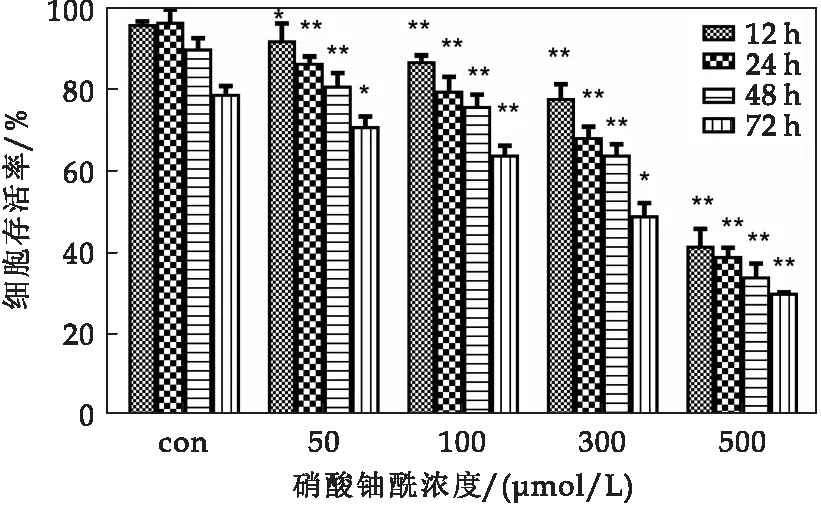
图1 不同浓度硝酸铀酰染毒不同时间CHO-K1细胞存活率
2.2 蛋白鉴定结果
CHO-K1细胞经500 μmol/L硝酸铀酰染毒24 h,提取蛋白质,经胰蛋白酶消化和TMT标记,利用液质联用技术进行分析,分析后进行数据库检索,共获得蛋白谱图42 401张,肽段数量23 553条,鉴定出蛋白4 772个.
2.3 硝酸铀酰染毒诱导的CHO-K1细胞差异蛋白筛选结果
以差异倍数大于1.5倍,P<0.05为差异显著性标准,如图2所示,染毒组与对照组相比筛选出差异表达蛋白309个,其中164个蛋白上调表达,145个蛋白下调表达.

图2 染毒组CHO-K1细胞差异表达蛋白数量
以log2(差异倍数)为横坐标,-log10(P-value)为纵坐标,绘制差异表达蛋白火山图,如图3所示,红色的点为上调差异表达蛋白,蓝色的点表示下调差异表达蛋白,灰色的点为非显著差异表达蛋白,距离0点越远表示差异越大,可以显示染毒组与对照组蛋白的具体差异.

图3 差异表达蛋白火山图
2.4 差异蛋白表达水平聚类分析
如图4所示,以热图形式显示差异表达蛋白的聚类分析,红色表示高表达蛋白,蓝色表示低表达蛋白,每行表示每个蛋白在不同组中的表达量情况,每列表示每个组中所有差异蛋白的表达量情况.同组蛋白特征相似的聚在一起,不同组蛋白相似率越低,样本间距离越远,表明对照组和染毒组样本具有明显差异.

图4 差异蛋白表达水平聚类分析图
2.5 差异表达蛋白GO富集分析结果
通过GO富集分析对筛选出的309个差异表达蛋白进行生物过程(Biological Process)、细胞成分(Cellular Component)和分子功能(Molecular Function)三方面的分析,研究差异表达蛋白在功能上的分布.通过GO分析结果显示309个差异表达蛋白富集于1 086种生物过程,282种细胞成分和377类分子功能.图5显示了生物过程、细胞成分和分子功能三类富集分析差异显著性前十的条目.

图5 染毒组差异蛋白GO富集分析结果
生物过程分析如表1所示.差异表达蛋白主要涉及翻译、核糖体小亚基生物发生、rRNA加工、β-淀粉样蛋白的形成、锌离子跨膜输入、透明质酸代谢过程、受体活性的正向调节、维生素D受体信号通路的调节、肌肉结构发展及核糖体小亚基组装.
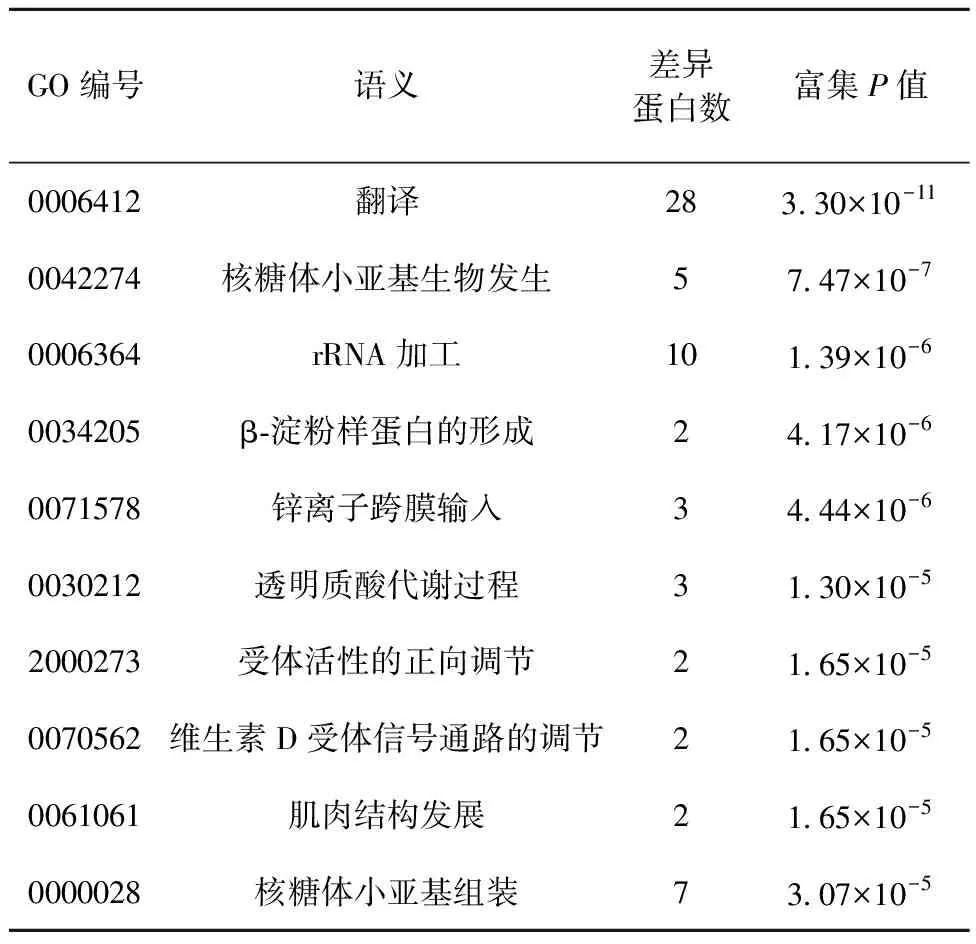
表1 差异表达蛋白的主要生物过程分析
细胞成分分析如表2所示.差异表达蛋白主要涉及细胞质小核糖体亚基、细胞核、染色体、小核糖体亚基、外泌体、核小体、血红蛋白复合体、小亚基加工体、U2型剪接前体及颗粒组分.

表2 差异表达蛋白的主要细胞成分分析
分子功能分析如表3所示.差异表达蛋白主要涉及poly(A)RNA结合、核糖体的结构成分、线粒体靶向序列结合、氧运输活性、甘露糖结合、维生素D受体结合、维甲酸受体结合、氧气结合、锌离子跨膜转运体活性及酶激活活性.

表3 差异表达蛋白的主要分子功能分析
2.6 差异表达蛋白KEGG富集分析结果
KEGG通路分析结果显示,本研究筛选出的309个差异表达蛋白涉及197条信号转导通路,其中差异显著(P<0.05)的通路有40条.差异显著性排前20的通路如图6所示,主要包括核糖体生物合成、核糖体、真核生物中的核糖体生物合成、疟疾、剪接体、分泌系统、RNA运输、辅因子代谢、Notch信号通路、吞噬体、染色体及相关蛋白、蛋白质外排、全身性红斑狼疮、生理节律、IL-17信号通路、类脂物代谢.气泡越大的通路包含的差异蛋白数目越多,气泡颜色与富集程度有关,P值越小,显著程度越大.

图6 染毒组差异蛋白KEGG富集Top20气泡图
差异表达蛋白在KEGG通路中的分布如图7所示.主要分布在这几类信号通路中:蛋白家族:遗传信息处理;蛋白家族:信号传导和细胞过程;翻译;蛋白家族:代谢;信号转导.

图7 染毒组差异蛋白KEGG分布
2.7 差异表达蛋白相互作用分析
使用STRING数据库对差异表达蛋白进行分析,获得差异表达蛋白的互作关系如图8所示.关联度最高的是G3HKG8和G3ICY6,G3HKG8是核糖体蛋白质S3A(ribosomal protein S3A,RPS3A),G3ICY6是核糖体蛋白质S17(ribosomal protein S17,RPS17).RPS3A和RPS17属于核糖体蛋白家族,RPS3A位于40S核糖体亚基的外层,是核糖体与18S rRNA、mRNA、起始因子eIF-2和eIF-3、延伸因子EF-1和EF-2连接的位置,因此RPS3A在核糖体翻译功能启动中起关键作用[15].研究发现RPS3A表达水平的变化,影响了核糖体翻译功能的启动,影响了蛋白质的合成,蛋白质合成作为生命活动中的重要过程,其合成受到抑制将导致细胞发生凋亡[16].RPS17蛋白也位于40S核糖体亚基,作用于翻译起始密码子,影响蛋白的生物合成[17].目前研究报道的铀的毒性作用机制主要有氧化胁迫、DNA损伤、蛋白结合和功能异常、炎症激活及凋亡和自噬[18].研究结果表明硝酸铀酰暴露可能诱导CHO-K1细胞发生凋亡和蛋白功能异常.
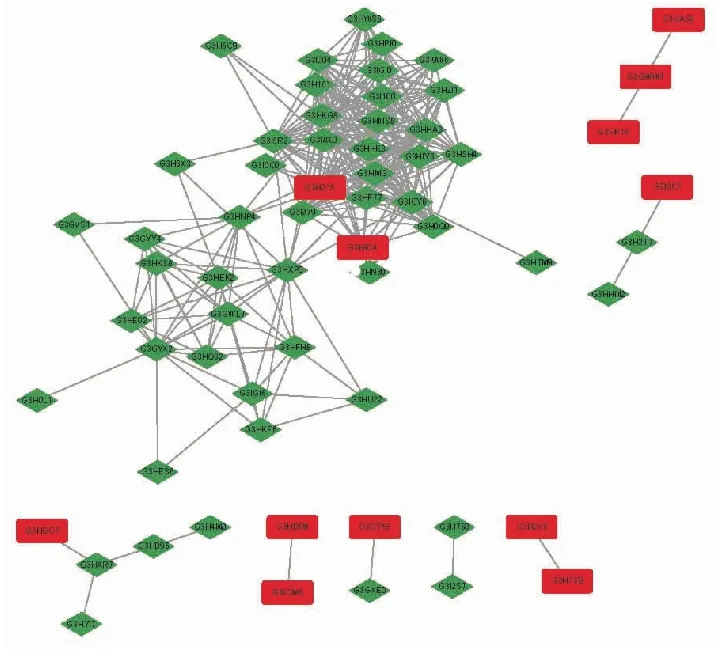
图8 差异蛋白相互作用网络分析结果
3 结论
近年来TMT体外标记技术广泛用于差异表达蛋白质分析研究,具有通量高、重复性好且定量准确、分辨率高、数据丰富和自动化程度高的优点.本研究采用TMT标记蛋白技术对硝酸铀酰暴露的CHO-K1细胞蛋白进行鉴定,共鉴定获得肽段数量23 553条,鉴定出蛋白4 772个.
本研究应用TMT标记蛋白组学技术对硝酸铀酰暴露致CHO-K1细胞损伤的蛋白进行筛选,筛选出差异表达1.5倍以上的蛋白309个,其中164个表达上调,145个表达下调.
GO分析表明差异表达的蛋白主要参与1 086种生物过程,282种细胞成分以及377类分子功能,生物过程中翻译、β-淀粉样蛋白的形成、锌离子跨膜输入、透明质酸代谢过程、受体活性的正向调节、肌肉结构发展和核糖体小亚基组装表达上调,核糖体小亚基生物发生、rRNA加工和维生素D受体信号通路的调节表达下调;细胞成分中细胞质小核糖体亚基、细胞核、染色体、小核糖体亚基、外泌体、核小体、颗粒组分和血红蛋白复合体表达上调,小亚基加工体和U2型剪接前体表达下调;分子功能中poly(A)RNA结合、核糖体的结构成分、线粒体靶向序列结合、氧运输活性、甘露糖结合、维甲酸受体结合、氧气结合、锌离子跨膜转运体活性和酶激活活性表达上调,维生素D受体结合表达下调.
KEGG通路分析表明差异蛋白富集于40条信号转导通路.主要参与核糖体生物合成、RNA运输、辅因子代谢、Notch信号通路、吞噬体、染色体及相关蛋白、蛋白质外排、生理节律、IL-17信号通路、类脂物代谢等信号通路.GO功能富集分析和KEGG信号通路分析结果为进一步探索硝酸铀酰染毒对CHO-K1细胞损伤的影响及潜在的分子机制提供数据.
对差异表达蛋白进行互作网络分析,关联度最高的是RPS3A和RPS17.下一步RPS3A和RPS17可作为硝酸铀酰暴露致CHO-K1细胞损伤的潜在生物标志物进行研究.
