植物-微生物燃料电池对土壤中纳米氧化锌及锌离子扩散的阻截效应
2023-03-04王曼婷张亚文张春平马靓琛李亚娟
朱 超,王曼婷,张亚文,张春平,马靓琛,李亚娟
(1.陕西科技大学 环境科学与工程学院,陕西 西安 710021;2.中国建筑材料工业建设西安工程有限公司,陕西 西安 710065;3.上海工程技术大学 化学与化工学院,上海 201600)
0 引言
由于纳米材料被广泛应用于商业用途,在纳米材料和纳米产品的生产、使用和处理过程中,纳米材料难免会通过各种途径进入环境,导致了潜在的重金属离子污染风险,尤其是对土壤生态有显著的影响.金属离子释放是金属氧化物工程纳米材料生态风险的主要贡献者之一,为了控制金属离子的释放转运,寻求一种经济简便的控制或修复技术来解决金属纳米颗粒暴露带来的一系列土壤生态问题对于环保和可持续发展具有重要意义.
纳米氧化锌是广泛流行在土壤系统对环境和人体健康最有毒的重金属之一.它对细菌细胞、植物细胞及人体细胞有一定的毒性效应,ZnO-NPs进入细胞体内后,可使胞内代谢系统发生紊乱、生物化学成分发生改变,使菌死亡[1-4].在土壤修复领域去除纳米氧化锌颗粒是一个重大的挑战[5].
植物微生物燃料电池(P-MFC,Plant Microbial Fuel Cell)是一项通过植物生理作用强化MFC的技术[6].植物通过光合作用将空气中的二氧化碳转化成有机物,其中大部分有机物由植物根系分泌至根际环境中.这些物质包括糖类、有机酸、酶和一些其他细胞物质,以及乙烯和二氧化碳等气态物.在胞外电子呼吸菌的作用下,这些物质被转化为电子、质子和二氧化碳,阳极生物膜的微生物可通过多种方式将电子跨细胞膜传到体外,而电子通过导线传递至阴极.由此,阴阳两极之间形成电位差,并产生电流和电场[7-9].多数P-MFC相关研究侧重于提高阳极和阴极传输效率或降低P-MFC的内部电阻从废水中收获更多的能量或营养物质,关于利用P-MFC作为土壤重金属污染修复应用的信息极为有限[10].有研究表明植物通过根系释放的分泌物可以作为MFC的电子供体,提高电流产量,进而利用电化学还原将六价铬转化为三价铬是土壤和沉积物中六价铬去除的主要机制[11].但对于利用P-MFC在土壤中形成的微电场阻控金属离子的流转迁移和纳米金属氧化物的离子释放还缺少系统深入的研究.故本研究提出将P-MFC应用于金属氧化物工程纳米颗粒源金属离子的控制,对于P-MFC在环境重金属污染治理方面提供更多理论和技术依据.
1 实验部分
1.1 实验材料
1.1.1 土壤
本试验所用土壤取自西安市长安区西留村水稻种植地,是典型的单季稻和双季稻种植地.土壤取自0~20 cm的表层土壤,经自然风干后,去除杂质,过2 mm筛,备用.
1.1.2 植物
本研究选择根系发达的水生草本植物白鹤芋为供试植株,进行P-MFC的搭建.
1.1.3 实验药品
本实验主要药品有纳米氧化锌,1∶1硫酸、2,3,5-三苯基四氮唑氯化物(TTC)、65%~68%硝酸、(羟甲基)氨基甲烷,购自于西安拉卡仪器设备有限公司,均为分析纯.
1.2 实验方法
1.2.1 P-MFC搭建
试验反应器如图1所示.纳米氧化锌污染土壤P-MFC装置其主体部分采用内径15 cm,高度15 cm的透明玻璃圆桶,阳极和阴极都选用高纯耐高温石墨毡,阳极尺寸大小10 cm×10 cm×0.5 cm,阴极尺寸大小3 cm×10 cm×0.5 cm.用筛选的土壤进行MFC的搭建,在圆桶底层覆土4 cm,将阳极用铜导线穿好,使用去离子水润湿后放入圆桶紧贴土壤表面,然后覆土2 cm,将阴极用铜导线穿好紧贴土壤表层,种植3棵健康状况良好、单株生物量相近的白鹤芋,最后利用铜导线将阴阳两极连接起来,外接 1 000 Ω大小的电阻.每天保持上覆去离子水1~2 cm保证阴极湿润,外端接电压采集器,采集P-MFC的电压数据.

图1 P-MFC系统搭建和作用机制示意图
本次试验共设五组不同处理装置进行对比,如图2所示.1号为简单的模拟无植物土地,2号为天然白鹤芋种植地,3号为单阳极植物-微生物燃料电池,4号为双阳极植物-微生物燃料电池,5号为微生物燃料电池,没有植物的参与.
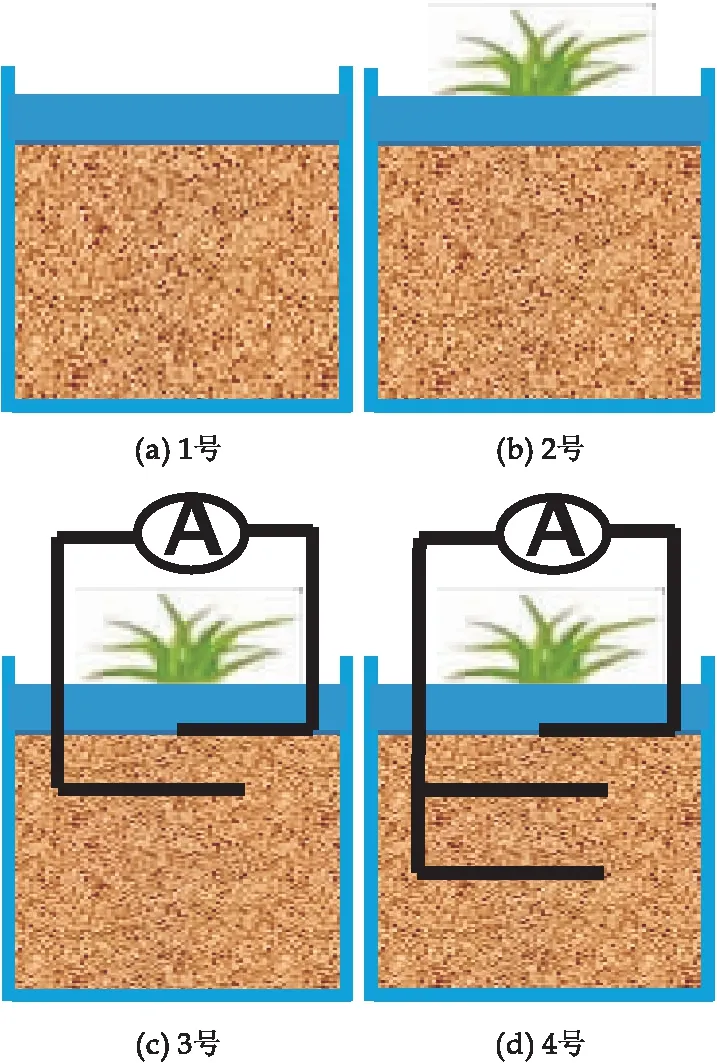
图2 五组不同处理装置对比图
1.2.2 装置的运行
将五个装置置于生物培养箱中,保持土壤表面始终淹水1~2 cm,温度控制在26±1 ℃,灯光照射控制在十个小时左右,每天对电流、电压、内阻、室温、湿度及pH进行测量和记录.实验进行十天后,电流增长并稳定在50 mA左右表示P-MFC启动,即可以进行暴露实验.
1.2.3 纳米氧化锌暴露设置
P-MFC启动后,给每个装置加入700 mg/kg的纳米氧化锌,准确称量五份纳米氧化锌,溶于水后,使用变幅杆超声发生器进行充分混匀,以喷淋的方式,一次性加入各装置中.
1.2.4 土壤pH的测定
使用土壤pH计酸碱度测试仪测定待测土壤的pH值,型号为ZD-06,测定前,先用研磨布或清洁棉擦拭金属探头的部位,以防影响测定值,将仪器的金属探头顺时针垂直插入土样中下部进行测定,待读数稳定5~10 s后进行读数.
1.2.5 土壤微生物代谢活性测定
采取氧化锌工程纳米颗粒暴露前五天的土样以及氧化锌工程纳米颗粒暴露五天后的土样,过2 mm孔筛,选择两种对土壤生化过程有重要作用并且可能对ZnO-NPs敏感的酶,两种酶为荧光素二乙酸酯水解酶(Luciferin diacetate hydrolase FDAH)和脱氢酶(Dehydrogenase DH),每种测定做三个平行,采用比色法测定FDAH 活性和DH活性[10].
1.2.6 植物生物量和抗氧化酶活性测定
将植株连带栽培土壤整体取出花盆浸入水中,洗净植物表面及根下部,用去离子水清洗植物三次,滤纸擦干.每个处理装置取3株植物,做三次平行,将植物分为根、茎叶两个部分分别装于信封中在105 ℃下杀青30 min,将杀青后的植物于65 ℃下烘干至恒重,并称取各部分重量即为干重[12].
本研究选取的抗氧化酶活性(Antioxidant Enzyme Activity,AEA)评价系统由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)构成,均采用基于比色法的试剂盒(南京建成公司A001-3、A007-1、A084-1)进行测定.
1.2.7 锌元素分布测定
(1)土壤淋滤液的制备
本次实验用两种浸提液做对比,一种为水,模拟正常雨水的淋滤,一种为弱酸溶液,模拟酸雨成分制备,分别进行24 h的湿沉降.以水为淋滤液制备土壤浸提液的方法:准确称量5 g干燥的土壤样品,放入100 mL干燥的锥形瓶中,加入95 mL蒸馏水,剧烈震荡2 h,静置24 h,上清液即为土壤浸提液.以弱酸为淋滤液制备土壤浸提液的方法只需将蒸馏水换成酸溶液(20 mL的硫酸、4 mL的柠檬酸、1.44 mL的硝酸混合,加水调节pH到4),上清液为土壤弱酸浸提液.
(2)ICP-AES测土壤中的锌浓度
将制备好的土壤浸提液取15 mL稀释到30 mL进行超速离心(离心前要将浸提液进行恒重),另取10 mL未离心浸提液,将离心后的和未离心的溶液用0.45 μm滤膜过滤,过膜后,用ICP-AES测锌元素浓度,并记录两次冲洗Zn2025、Zn2062、Zn2132的平均值.
2 结果与讨论
2.1 P-MFC启动分析
图3和图4为燃料电池电流分析图和电压分析图.0~15天为启动期,及阳极生物膜形成阶段[11],在此阶段,电流和电压大幅度上升且各系统电压变化幅度较大,3号处理的输出电流从6 mA提升到35 mA,4号和5号从2 mA提升到22 mA,三个处理的输出电压分别从3 V、1.5 V、1.5 V提升到11 V、10 V、8 V;电位上升可能是因为闭合回路的形成使得阳极产电菌不断富集,分解土壤中已有的有机质,导致土壤中有机质含量降低,阳极电位升高[13].
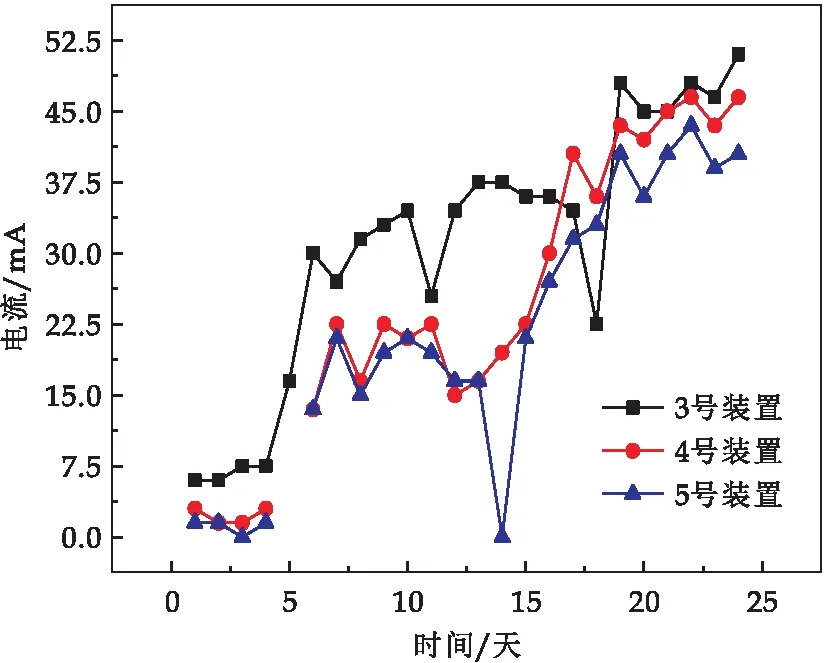
图3 不同P-MFC处理的电流输出比较

图4 不同P-MFC处理的电压输出比较
随着系统运行时间的增加,阳极周边的有机质易于被微生物消耗完全,而底泥传质随时间具有不确定性,所以导致电压变化幅度较大[14],图5为启动前后阳极石墨毡表面的生物膜生长情况.15~20天电流和电压小幅度上涨,3、4、5号处理组电流从35 mA、22 mA、22 mA提升到48 mA、46.5 mA、41 mA,电压从11 V、10 V、8 V提升到17.5 V、17 V、16 V,20天之后电流电压值保持稳定.这与通过构建MFC来修复受重金属污染土壤的电流电压变化趋势相一致[15].从整体运行水平来看,3、4、5号处理组最大电流密度分别为230.4 mW/m2、220.9 mW/m2、168.1 mW/m2,表1为不同植物用作P-MFC所产生的最高功率密度之间的对比,可以得到以白鹤芋为植株所搭建的P-MFC产生的电流密度居于中等偏上水平[16].

表1 不同植物用作燃料电池的功率密度
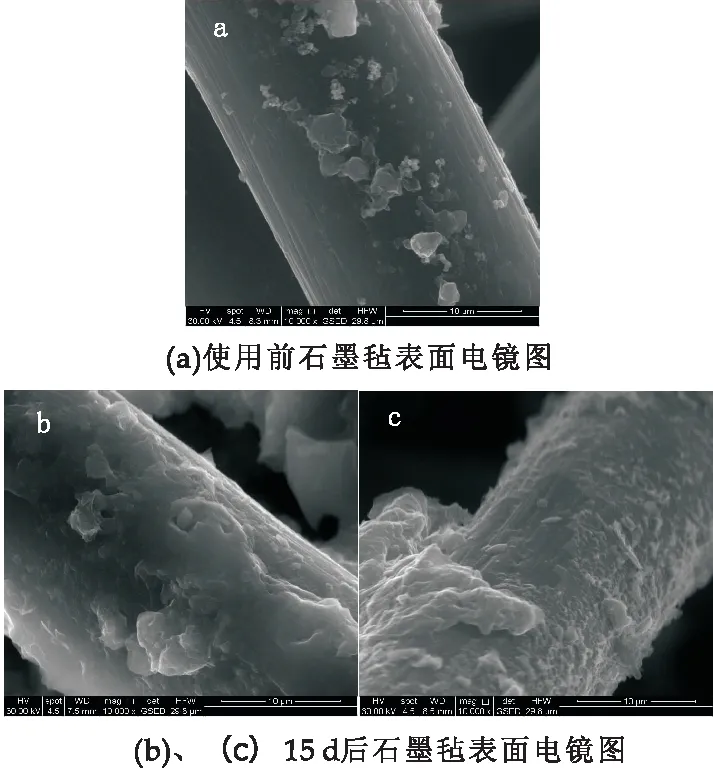
图5 使用前后的阳极石墨毡表面照片
对三个处理组的电流和电压进行显著分析得出,3号和4号处理组输出电流和电压显著高于5号处理组,这证明植物的引入对提高电池产电效能有一定的促进作用.也有相关研究表明有植物的MFC比没植物的MFC有更强的功率和产电性能[17].3号、4号产电水平相当,说明4号设置两层阳极对产电效果并无影响.采样后对白鹤芋根系进行了测量,根系长度大多在10 cm左右.有电极的植物与普通花盆里种植的植物并无差别,这表明在土壤中搭建植物-微生物燃料电池并不影响植物的生长状况.
2.2 P-MFC运行对土壤基本性质的影响
2.2.1 对土壤pH的影响
P-MFC启动后,每天对土壤pH进行测定,纳米氧化锌暴露前5天和暴露后5天的土壤pH基本无变化,土壤pH一直保持在6.3~6.8之间,P-MFC运行阶段土壤始终保持1~2 cm淹水面,在加纯水后pH会有小的波动,其原因有可能是因为纯水的加入增大了土壤环境中H+的浓度,H+通过离子交换膜从阳极室迁移到阴极室,纳米氧化锌在阴极被还原为锌单质,导致阴极室pH增大,由于电极间距较小,H+的传质距离较短,传质受到限制较小,使pH波动范围依旧在6.3~6.8之间.
2.2.2 对土壤酶活性的影响
土壤的微生物生态功能是衡量土壤基本性质的一个重要方面[22],土壤酶活性可以被用作土壤生态胁迫或土壤生态恢复等早期的敏感性指示[23,24].本研究选取FDAH和DH活性.FDAH与总碳、总氮和总磷等土壤养分指标关系密切,能够很好地反映系统间有机质的转化及土壤中微生物的活性[25].DH存在于微生物细胞内,是典型的胞内酶,其活性的大小直接反映土壤微生物的数量和活性[26].
图6和图7分别显示不同处理土壤在ZnO-NPs暴露后的FDAH和DH活性的变化.由图6、7可知,在ZnO-NPs暴露前体系下,五种不同处理组的FDAH活性和DH活性大小无特大差异,2号有植物无电极装置的FDAH和DH活性都略低于3号和4号有植物有电极装置.在ZnO-NPs暴露后,3号单阳极P-MFC的FDAH活性最高,4号双阳极P-MFC的DH活性最高,二者活性都高于5号无植物MFC.1号和5号无植物装置的FDAH活性在ZnO-NPs暴露后分别降低约24%、19%,DH活性降低约42%、31%,二者活性在ZnO-NPs暴露后有显著性差异;2、3号有植物装置的FDAH活性在ZnO-NPs暴露后分别升高约0.2%、0.48%,4号装置的DH活性升高约0.52%,这证明植物的存在能够显著提高纳米氧化锌胁迫下土壤的酶活性.植物根系巨大的比表面积为微生物提供了良好的生长环境,促进了根际环境微生物的多样性与活性[27].这与现有研究表明的P-MFC比MFC有更高的酶活性相一致[28].
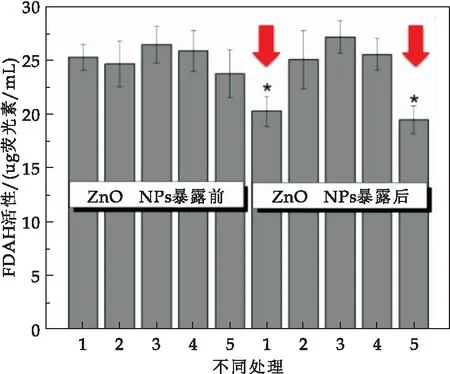
图6 ZnO-NPs暴露后不同设置土壤的FDAH活性比较

图7 ZnO-NPs暴露后不同设置土壤的DH活性比较(“*”表示暴露前后的差异显著性(p<0.5))
2.2.3 P-MFC对暴露于ZnO-NPs下植物生长的影响
不同处理ZnO-NPs暴露前5天和暴露5天后植物生物量比较如图8所示.可以看出,ZnO-NPs暴露前后植物根茎叶占比无显著差异.实验结束后,不同P-MFC处理组白鹤芋植株干重平均为10.52±1.37 g,在各个不同处理之间没有显著差异.其中产电最为活跃的3号单层阳极的P-MFC白鹤芋植株重10.67±1.37 g,4号双层阳极的P-MFC白鹤芋植株重10.13±1.37 g,自然生长的白鹤芋植株干重为10.43±1.37 g.白鹤芋穿过第二层石墨毡的根系相对第一层较少.在整个装置运行阶段,并未观察到产电过程对白鹤芋生长,叶片颜色、大小及根系的长度有显著影响,表明在土壤中构建微生物燃料电池不会影响现有作物的生长,石墨毡电极和导线保持了物理化学稳定性,这与现有研究保持一致[29].
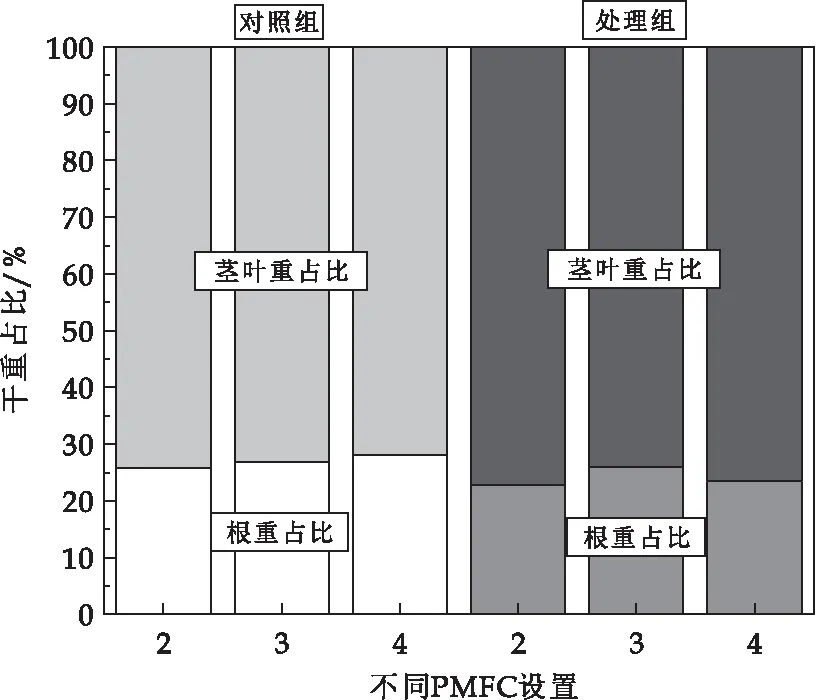
图8 纳米氧化锌暴露前后不同PMFC处理下植物生物量比较
图9为不同P-MFC处理下植株的抗氧化酶系变化情况.植株通过超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等各抗氧化酶的协同作用,可把环境胁迫下细胞内产生的具有很强氧化活性的活性氧如H2O2、OH·等直接或间接地清除,防止了活性氧的级联放大作用[30,31],在植物生命活动中起着举足轻重的作用,同时可作为环境胁迫强度的衡量指标.
由图9可以看出,运行体系的植株样本的AEA值显著高于对照,且都表现为“先升后降”.这是由于在超出细胞承受能力后细胞膜脂过氧化程度加深,细胞受到的伤害增强,影响了细胞内蛋白质等物质的合成,因此抗氧化酶活性下降[32,33].SOD的活性较CAT和POD活性高出很多,这一方面由于SOD是歧化超氧自由基的催化酶,之后CAT和POD才将歧化产生的H2O2转化为H2O和O2.同时说明SOD在白鹤芋耐受ZnO-NPs胁迫中起主要作用.在无P-MFC设置土壤中,SOD和CAT的活性都有显著增加,反映了植株对ZnO-NPs暴露所表现的氧化应激作用,而在P-MFC设置中的根部区域土层中,AEA体系并未发生明显变化,证实P-MFC处理能够有效弱化纳米氧化锌对土壤植物的氧化胁迫效应,当然,较之对照,ZnO-NPs暴露还是造成了植株AEA体系活性水平的上升,说明该情境下的ZnO-NPs暴露对于植株有确定的低剂量刺激效应[34],再次印证了P-MFC在弱化纳米金属颗粒土壤暴露对植株毒性效应方面的作用.

图9 不同P-MFC处理下植株的AEA变化
2.3 P-MFC对于ZnO-NPs土壤行为的影响
通过ICP-AES测定在浓度为700 mg/L的ZnO-NPs暴露下各P-MFC的土壤浸提液中的Zn2+浓度,结合不同土层中的微生物生长情况,分析ZnO-NPs颗粒在不同处理中的扩散情况.不同处理中各层土壤锌元素浓度有所差异,淋滤液经过超速离心后,以ZnO-NPs形态存在的Zn元素被沉在离心管底部,用ICP-AES测上清液中Zn元素浓度,所得数值即为暴露在土壤中的纳米氧化锌转化为离子形态的浓度.
图10为在水淋滤和弱酸淋滤处理下不同装置Zn元素在不同土壤层分布的情况.由图10(a)可知,五个处理组在离心和未离心的水淋滤液以及弱酸淋滤液中的Zn元素浓度在1 cm土层最高,且随着土层的加深,Zn元素浓度越低.其中,3号单层阳极P-MFC和4号双层阳极P-MFC表层土壤中Zn2+浓度与其它三组处理相比,浓度高出2倍以上,但到上层4 cm处单层阳极和双层阳极P-MFC的Zn2+浓度均低于其它三组处理,图10(b)的3、4号处理在1 cm土壤层Zn元素浓度可达180 mg/L、140 mg/L,在4 cm两者只有约5 mg/L,1、2、5号处理在1 cm土壤层Zn元素浓度可达30 mg/L、70 mg/L、80 mg/L,在4 cm处达25 mg/L、30 mg/L、10 mg/L,在7 cm处Zn元素浓度几乎为零.与4 cm土壤层相比,其单阳极及双阳极P-MFC的Zn元素浓度有96.8%被截留在1 cm土壤上层,无植物无电极的处理装置Zn元素浓度有16.7%、被截留在1 cm土壤上层,其截留率较之对照提升了82.7%,这说明设置P-MFC的处理可以将部分纳米氧化锌工程颗粒的Zn2+阻截在土壤层,而未设置植物的MFC和只有植物无电极以及无植物无电极的处理中Zn2+相对向下扩散,阻截效应相比P-MFC不够明显.
图10(c)为离心后水淋滤液中Zn2+浓度,大多数暴露的纳米氧化锌颗粒被阻截在土壤表层中.图10(d)为离心后弱酸淋滤液中锌元素浓度分析图,与图10(c)相比,对暴露在土壤表层中的纳米氧化锌转化成的离子态锌的阻截效应更加明显,图10(d)的单阳极和双阳极P-MFC在阴极附近的Zn元素浓度相比上层4 cm处,其截留率约为98%,只有植物无电极以及无植物无电极的P-MFC截留率约83%,可以得到P-MFC有显著降低Zn2+向下层土壤迁移释放的作用.
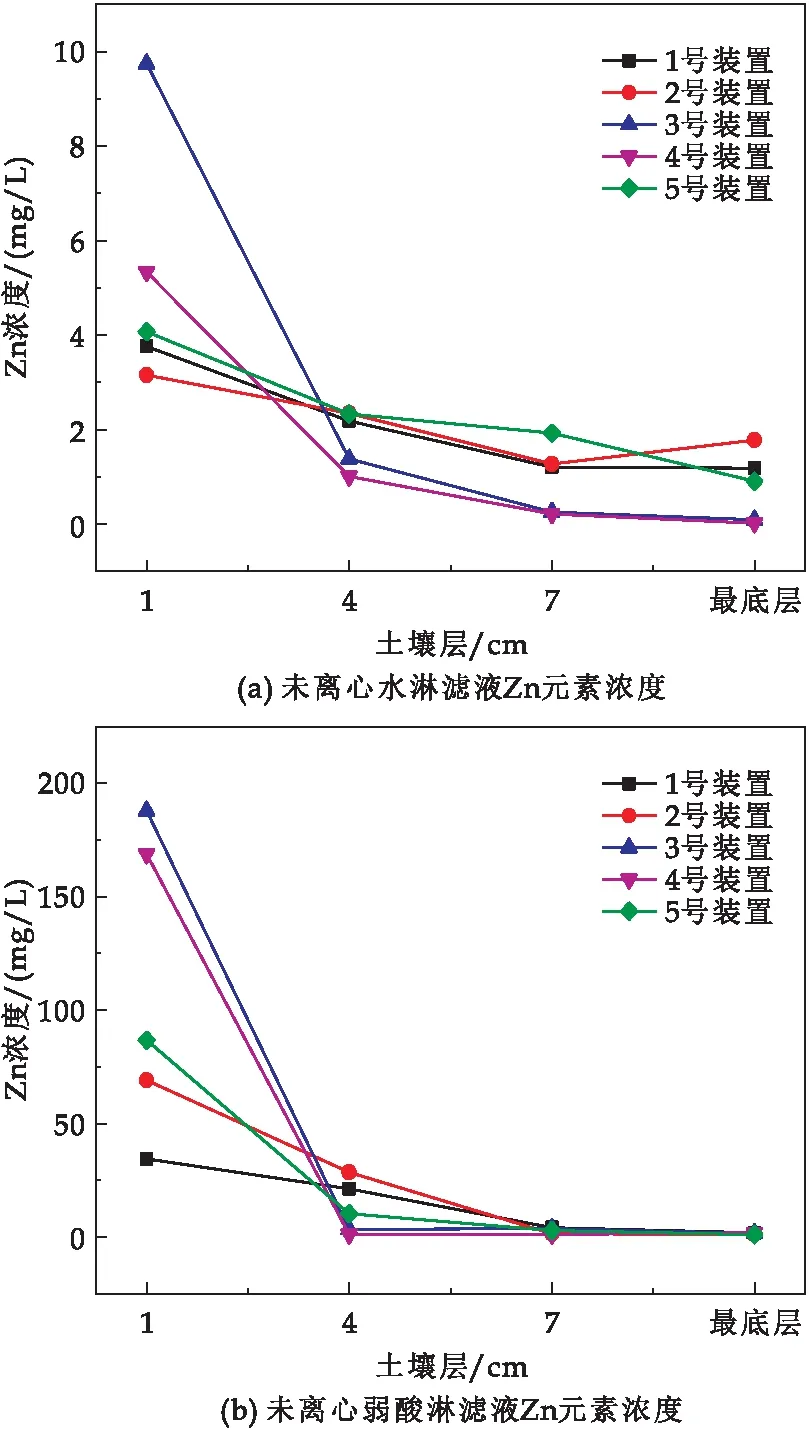
图10 水淋滤和弱酸淋滤处理下土壤层不同装置Zn元素分布
图11为各处理装置每层土壤Zn元素浓度对比分析图.其中,黄色深浅代表Zn元素含量的大小,红色下方土壤中Zn元素含量与无植物无电极的1号土壤Zn元素含量基本相同.单阳极和双阳极P-MFC处理的Zn元素明显被阻截在上层土壤,Zn元素集中在水和土壤的交界面阴极层中,靠近阴极的地方集中最多Zn元素,而其它装置ZnO-NPs不同程度的扩散到下层土壤.这说明在P-MFC上阳极产生的电子相对而言更易被土壤中的金属离子这些电子受体接收,从而达到固化土壤中的金属离子的作用,将土壤中的纳米氧化锌阻截在阴极附近[27].

图11 各土壤层不同装置Zn元素分布
3 结论
为了探究P-MFC对土壤中金属颗粒的阻截效应,以及P-MFC产电的可利用价值,本论文分别构建了双层阳极P-MFC、单层阳极P-MFC、MFC、普通白鹤芋种植及无植物种植装置,经过试验得出以下结论:
(1)在系统运行的20天内,单阳极P-MFC、双阳极P-MFC以及无植物MFC处理组均能维持较稳定的产电,在整个运行阶段输出电压整体稳定在15~18 V,电流稳定在50 mA左右,植物的引入可以提升MFC的产电性能且P-MFC的搭建对植株的正常生长不产生影响.
(2)植物的存在和电池的通入能够显著提高ZnO-NPs胁迫下土壤的FDAH和DH活性及弱化土壤中纳米金属颗粒对植株的毒性效应.
(3)P-MFC可在24 h的运行周期下将湿沉降暴露的ZnO-NPs颗粒截留在1 cm土层处,4 cm处Zn2+浓度相比1 cm降低96.8%,7 cm土层以下Zn2+浓度为零,P-MFC对Zn2+的截留率较之对照组增加了82.7%,P-MFC对土壤中暴露的ZnO-NPs颗粒向下层土壤的迁移释放起到一定的阻截效应.
