基于适配体的荧光生物传感器对Hg2+的检测技术研究
2023-03-03马莉萍马生龙李云霞聂莹莹左显维
马莉萍,马生龙,李云霞,聂莹莹,左显维
(1.甘肃省科学院传感技术研究所,甘肃 兰州 730000; 2.甘肃省传感器与传感技术重点实验室,甘肃 兰州 730000)
汞(Hg)是一种重金属元素,生活中的汞污染主要源自化工、电子、冶金、医药、轻工等行业,Hg2+浓度低至20 nmol/L时便可产生毒性,长期饮用含有微量Hg2+的水会引起蓄积性中毒,严重危害人体的神经系统,因此许多国家及组织都制定了饮用水中Hg2+的最高限量标准[1-2],发展灵敏度高、选择性好的Hg2+检测方法具有重要意义。传统的微量Hg2+检测方法有原子吸收法[3]、荧光法[4]、质谱法[5]和电化学方法[6]等,但这些检测方法对实验人员的技术专业性要求较高且耗时长,且检测设备庞大不便携,无法对突发重金属污染事件做出快速响应。随着重金属污染情况的发展及其严重危害性的不断显现,除了要从源头避免重金属污染,发展快速、便携、低成本的重金属检测技术也显得尤为重要。
随着各学科的不断发展,检测技术也逐渐变得多元化,学科间的相互结合逐渐被应用到检测中。如利用生物酶、核酸适配体、抗原抗体构建的生物传感器,均成功实现了水中Hg2+的检测。核酸适配体是通过SELEX技术从随机的寡核苷酸库中筛选得到的寡核苷酸单链,由20~60个核苷酸组成。与传统的抗原-抗体相比,核酸适配体不仅具有良好的亲和性和选择性,而且易于化学合成和功能化修饰,为构建新型传感器提供了新的思路和平台。目前核酸适配体技术已经广泛应用于核酸[7]、蛋白质[8]、金属离子检测[9]、靶向和生物成像[10-11]等相关领域。
有研究表明,Hg2+与胸腺嘧啶(T)共价结合形成稳定的 T-Hg2+-T配位结构[12-13],T-Hg2+-T结构的发现为深入研究Hg2+检测技术提供了新的思路。基于这种特殊的T-Hg2+-T配位作用,科研工作者们发展了多种新型生物传感器以用于Hg2+高灵敏度和特异性的检测,其中包括电化学生物传感器[14-17]、荧光生物传感器[18-19]、光纤生物传感器[20]等。这些方法都具有便捷、高灵敏、低成本等显著优点,在Hg2+快速检测中被广泛应用。
研究利用 Hg2+与T形成 T-Hg2+-T 结构这一特性,采用无标记的适配体荧光生物传感器检测Hg2+。该方法操作简便,并为Hg2+的快速、高灵敏检测提供了新思路。
1 实验
1.1 材料
(1) 试剂 Hg2+适配体链ssDNA Ⅰ(5’-TTC TTT TCT CGC TTG TTT GTT TTT-3’),Hg2+适配体互补链ssDNA Ⅱ(5’-AAA AAC AAA CAA GCG AGA GAA GAA-3’)均由上海生工生物科技有限公司合成。荧光染料10 000×SYBR Green Ⅰ(SGⅠ),购自北京美莱博医学有限公司。汞标准溶液,购自北京北方伟业计量技术研究院。Tris、AgNO3、CaCl2、CuSO4、FeSO4均购自美国Sigma公司,实验用水为超纯水。核苷酸储备液和缓冲溶液在使用前均在4 ℃冰箱储藏柜中保存,所有溶液和缓冲液均用超纯水配制。
1×SGⅠ溶液:将10 000×SGⅠ用Tris缓冲液(0.02 mol/L,pH值7.6 )溶液稀释至100×SGⅠ作为储存液,-20 ℃下避光保存。再用超纯水将其逐级稀释为1×SGⅠ溶液备用。
100 μmol/L Hg2+溶液:取1 003 μL Hg单元素溶液标准物质(100 μg/mL),用超纯水稀释定容至5 mL,即得100 μmol/L Hg2+溶液作为储备液,后续根据实验需求进行稀释。
(2) 仪器 FS5荧光光谱仪(爱丁堡公司,英国);pH计(上海仪电科学仪器,上海);H1850 离心机(湘仪,湖南);超纯水:Barnstead,NANOpureDlamond,≥18.2 MΩ·cm。
1.2 Hg2+检测原理
SGⅠ是高灵敏的核酸荧光染料,其与双链DNA(dsDNA)的亲和力非常高,结合dsDNA后荧光会显著增强,其与dsDNA结合时发出的荧光强度是其与单链DNA(ssDNA)结合时荧光强度的800~1 000倍,并且荧光信号稳定,不会明显受到pH值、温度及作用时间等因素的影响。据此,实验设计了一种基于SGⅠ和适配体技术的新型荧光生物传感器,其检测Hg2+的原理如图1所示。由图1可知,当体系中没有Hg2+时,适配体ssDNA Ⅰ与其特异的互补链ssDNA Ⅱ杂交形成双链结构,加入SGⅠ后发出较强荧光;当体系中存在Hg2+时,适配体ssDNA Ⅰ能被Hg2+竞争结合形成复配结构,ssDNA Ⅰ的构象由无规则卷曲状态到发卡结构,随后加入适配体互补链ssDNA Ⅱ和SG I,由于ssDNA Ⅰ不能和ssDNA Ⅱ杂交形成双链,导致荧光值低。因此,荧光强度与Hg2+的浓度呈负相关,通过测量SGⅠ的荧光值强度的变化可定量分析Hg2+浓度。
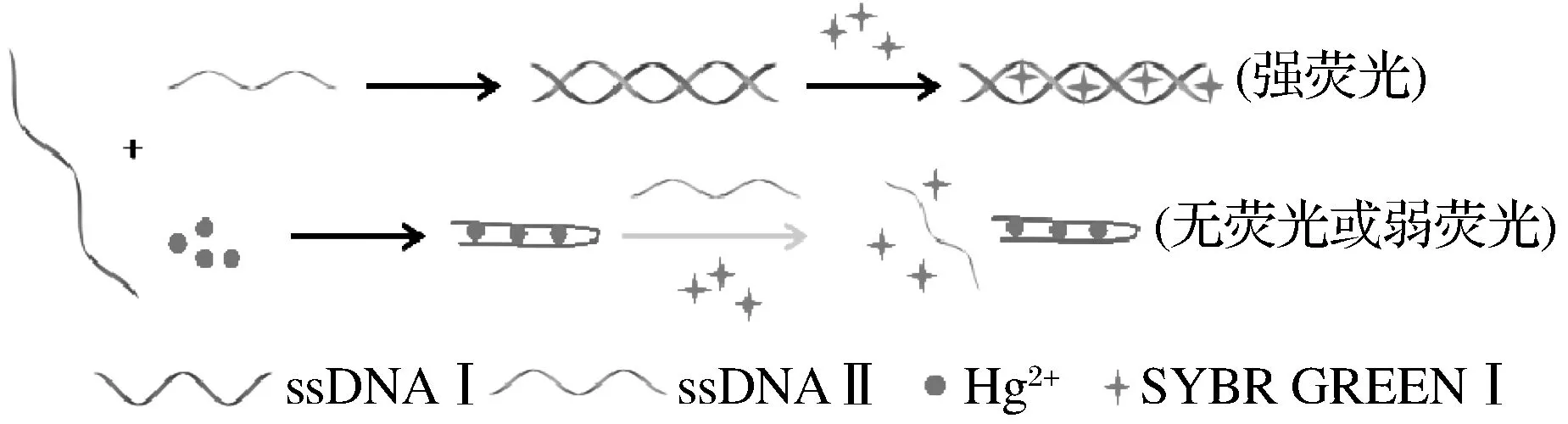
图1 适配体荧光传感器对Hg2+的检测原理Fig.1 Detection principle of label-free aptamer biosensor for Hg2+
1.3 实验方法
(1) 荧光发射光谱表征 分别考察在SGⅠ体系和ssDNA Ⅰ+ssDNA Ⅱ体系下加入不同浓度Hg2+的荧光强度。
(2) Hg2+适配体生物传感器SGⅠ用量研究 取10 μL浓度为1 μmol/L的 ssDNA Ⅰ与等体积浓度为1 μmol/L的ssDNA Ⅱ 避光反应10 min,随后加入不同体积的1×SGⅠ荧光染料,避光反应15 min。最后加入超纯水定容至500 μL,进行荧光测量。
(3) Hg2+的定量检测 在最优实验条件下,取10 μL浓度为1 μmol/L的ssDNA Ⅰ与不同浓度(1.2 μmol/L、1 μmol/L,800 nmol/L、600 nmol/L、400 nmol/L、200 nmol/L、100 nmol/L、10 nmol/L、1 nmol/L)的Hg2+溶液反应,避光反应10 min,然后加入10 μL浓度为1 μmol/L的ssDNAⅡ和10 μL 1×SGⅠ的避光反应15 min,最后加入超纯水定容至500 μL,对照组不加Hg2+,进行荧光检测,建立Hg2+检测标准曲线。
(4) 特异性研究 保持优化好的反应条件不变,分别以500 nmol/L Ca2+、Fe2+、Cu2+、Ni2+、Ag+等金属离子替代Hg2+,检测各金属离子的荧光强度,以相同浓度Hg2+荧光强度为对照,考察该传感器对Hg2+检测的特异性。
(5) Hg2+的加标回收试验 用自来水配制100~800 nmol/L不同浓度梯度的Hg2+样品溶液,检测加入Hg2+后自来水样品的荧光强度,检测结果与标准曲线的荧光值进行对比,计算样品加标回收率。
(6) 荧光测量 荧光光谱测量条件为:激发波长和发射波长分别为:492 nm、525 nm,狭缝宽度为1.5 nm,扫描范围505~600 nm。上述所有实验均在室温下进行。
2 结果与讨论
2.1 荧光发射光谱表征
为验证该实验设计的合理性,考察了各体系的荧光信号,荧光强度检测如图2所示。图2中曲线a为体系中只存在SGⅠ,荧光信号非常弱;曲线b为体系中没有Hg2+存在,适配体ssDNA Ⅰ与其互补链ssDNA Ⅱ 结合形成双螺旋结构,加入SGⅠ后,dsDNA与SGⅠ结合,荧光信号迅速增强;曲线c、d为体系中分别加入200 nmol/L Hg2+和600 nmol/L Hg2+,Hg2+能竞争结合在ssDNA Ⅰ上形成复合体,阻碍了ssDNA Ⅰ与其互补链的杂交,此时在体系中加入适配体互补链ssDNA Ⅱ和SGⅠ后,随着Hg2+浓度的增加荧光强度逐渐减小。这表明Hg2+能够与本次实验设计的ssDNA Ⅰ结合,形成局部配位结构,减弱了适配体与其互补链之间的结合,导致形成的双链DNA减少,从而使体系的荧光强度变弱,并且随着加入的Hg2+浓度越高,荧光强度越弱,证明了检测Hg2+的可行性。
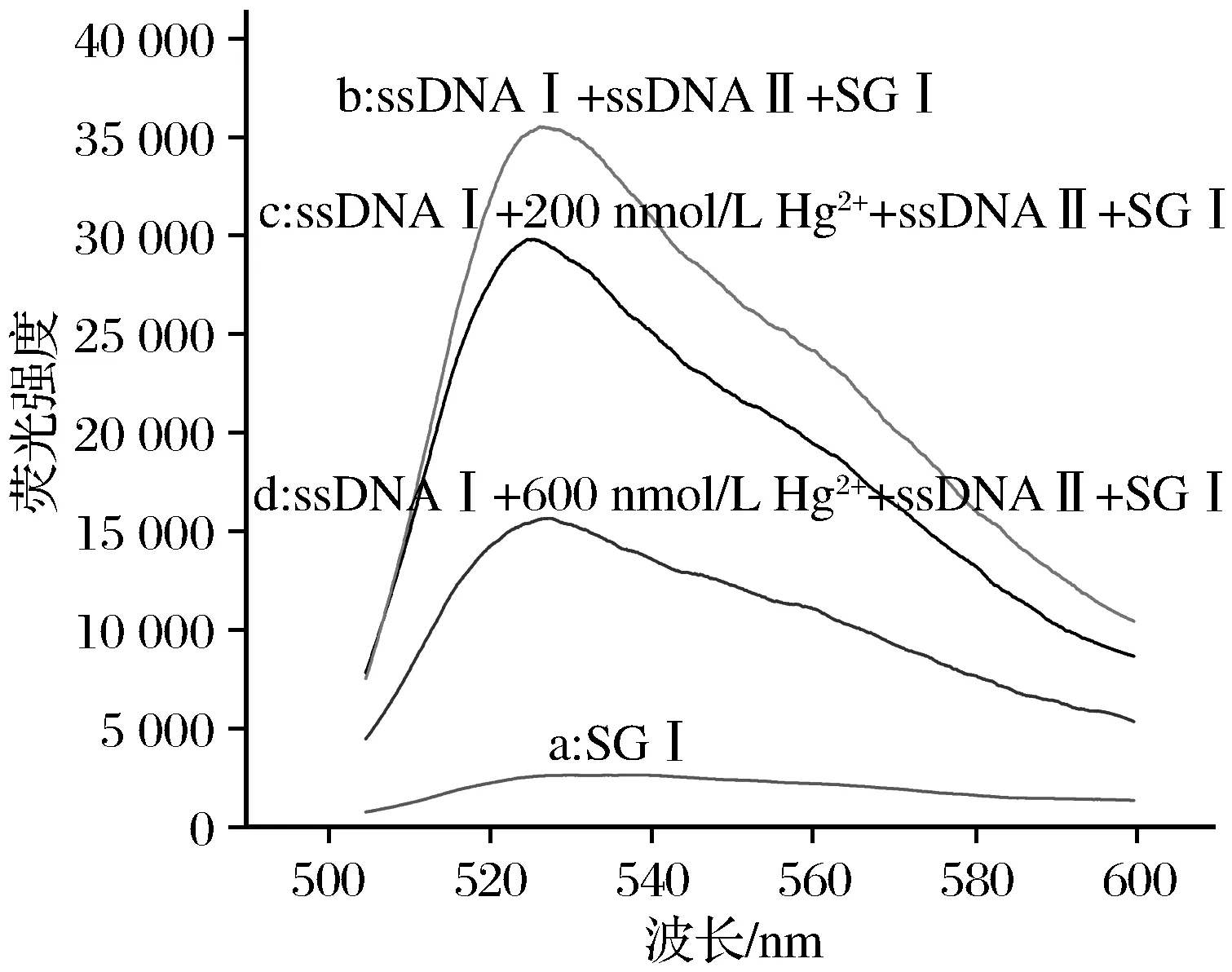
图2 荧光发射光谱表征Fig.2 Phenogram of fluorescence spectra of solution inthe presence and absence of Hg2+
2.2 Hg2+检测条件的优化
(1) Hg2+适配体生物传感器SGⅠ用量研究 SGⅠ荧光染料用量的优化结果如图3所示。由图3可知,在适配体及其互补链浓度恒定不变的情况下,加入不同体积的1×SGⅠ荧光染料,随着SGⅠ 加入量的增加,荧光强度也不断增加,当加入8 μL的SGⅠ时体系荧光强度达到最高,此后,随着SGⅠ的增加,荧光强度增加较小,因此后续研究选择8 μL为最优1×SGⅠ量。
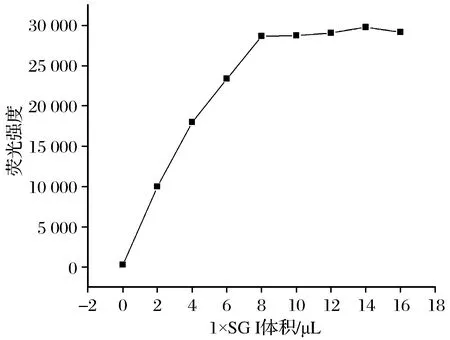
图3 SGⅠ用量与荧光强度变化Fig.3 Variation diagram of fluorescence intensitywith the volumes of SGⅠ
(2) 检测体系pH值优化 缓冲液pH值是决定体系荧光强度的一个重要因素,对检测的灵敏度和重现性具有显著影响。实验分别考察了不同pH值的Tris缓冲溶液对500 nmol/L Hg2+检测荧光强度的影响(见图4),结果表明pH值为7.6的Tris缓冲液检测效果最佳。
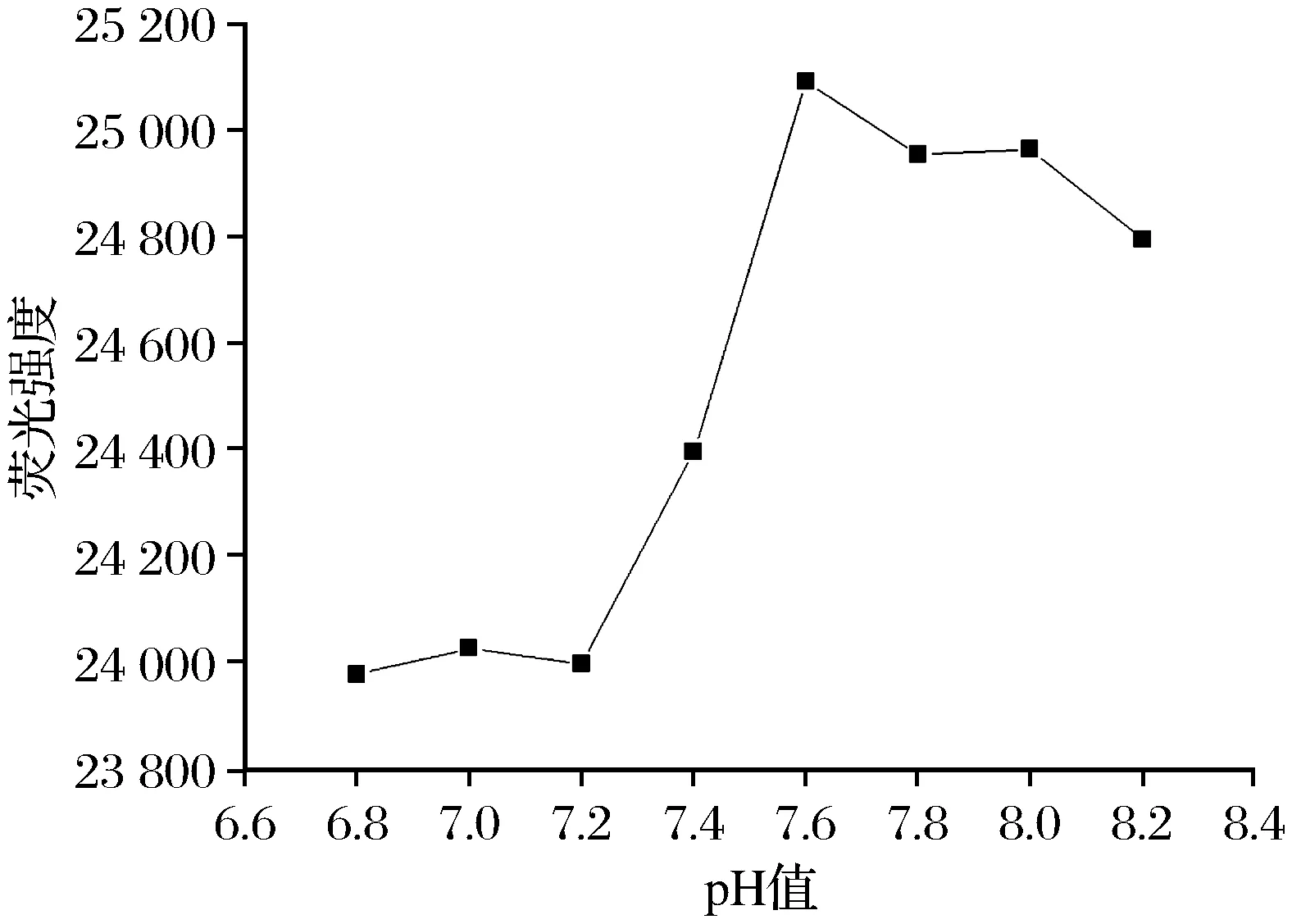
图4 不同pH值对500 nmol/L Hg2+荧光检测信号的影响Fig.4 Effect of pH value on Hg2+ fluorescence intensityof solution in the presence of 500nmol/L
2.3 Hg2+的定量检测
研究了该适配体生物传感器对Hg2+检测的线性范围,在最优的实验条件下,向体系中加入不同浓度的Hg2+,荧光强度检测如图5所示。随着Hg2+浓度的增加,与Hg2+结合的适配体ssDNA Ⅰ就越多,导致与ssDNA Ⅱ互补识别的ssDNA Ⅰ减少,因此荧光强度逐渐变弱。
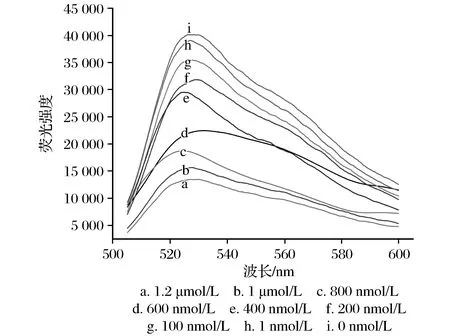
图5 不同浓度Hg2+的荧光光谱Fig.5 Fluorescence spectra of different concentrations of Hg2+
在10 nmol/L~1 μmol/L范围内,Hg2+浓度与荧光强度比值(F/F0)呈线性关系(见图6),其线性方程为y=-0.000 446 8x+0.881 5,相关系数(R2)为0.99,Hg2+的检出限为1 nmol/L。
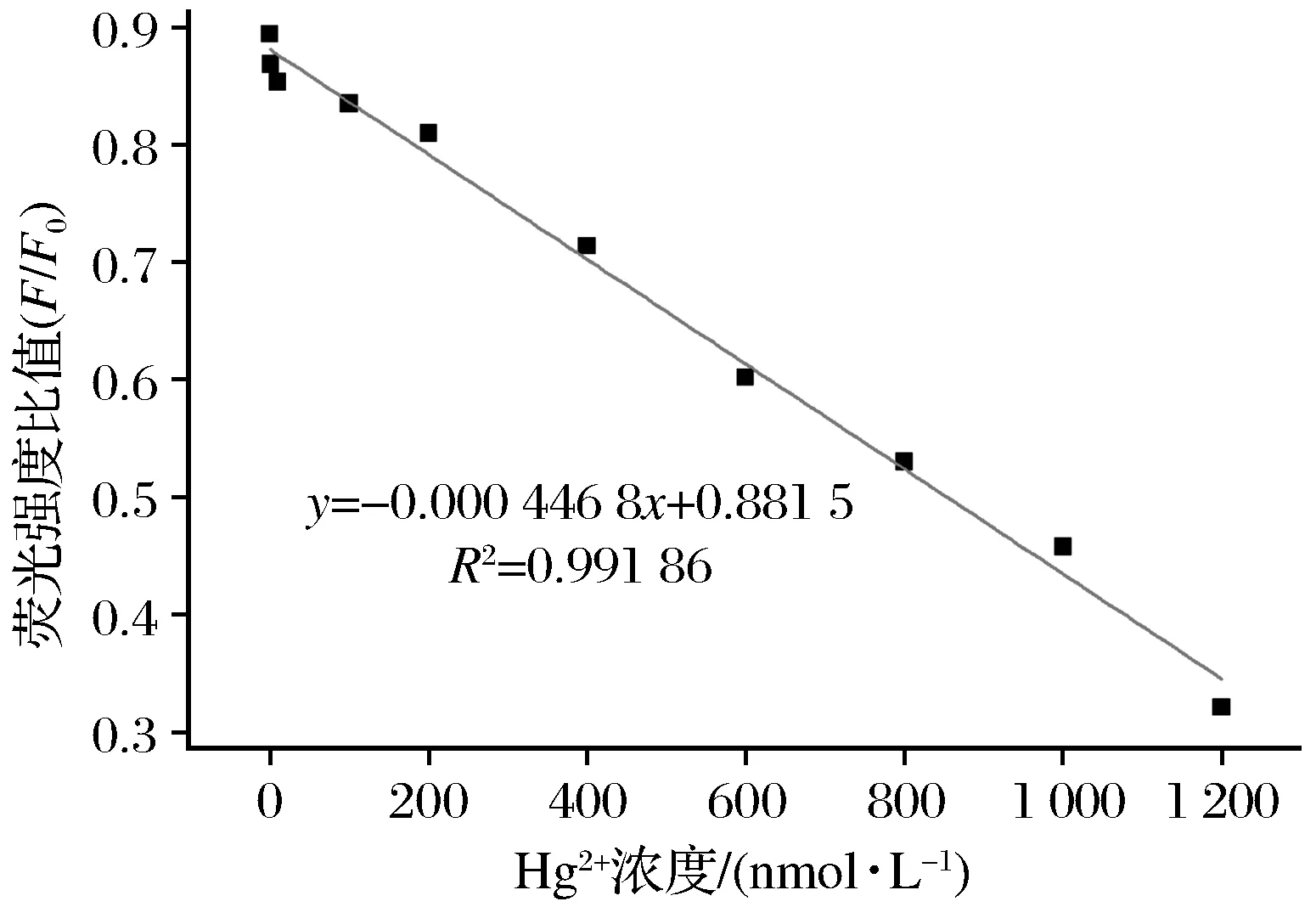
图6 荧光信号与Hg2+浓度的线性关系Fig.6 Linear relationship between fluorescence intensityand Hg2+concentrations
2.4 特异性研究
为了证实传感器对 Hg2+检测的特异性,测定了其他离子的干扰实验。在其他试剂和反应条件不变的条件下,以100 nmol/L Hg2+作为对照组,向样品溶液中分别加入500 nmol/L Ca2+、Fe2+、Cu2+、Ni2+、Ag+、Hg2+,检测不同金属离子的荧光强度,并与对照组进行比较,结果如图7所示。图7显示:加入Hg2+的体系荧光强度比值(F/F0)最小,而加入其他金属离子的体系F/F0变化不大,表明传感器对Hg2+测定有较好的特异性。
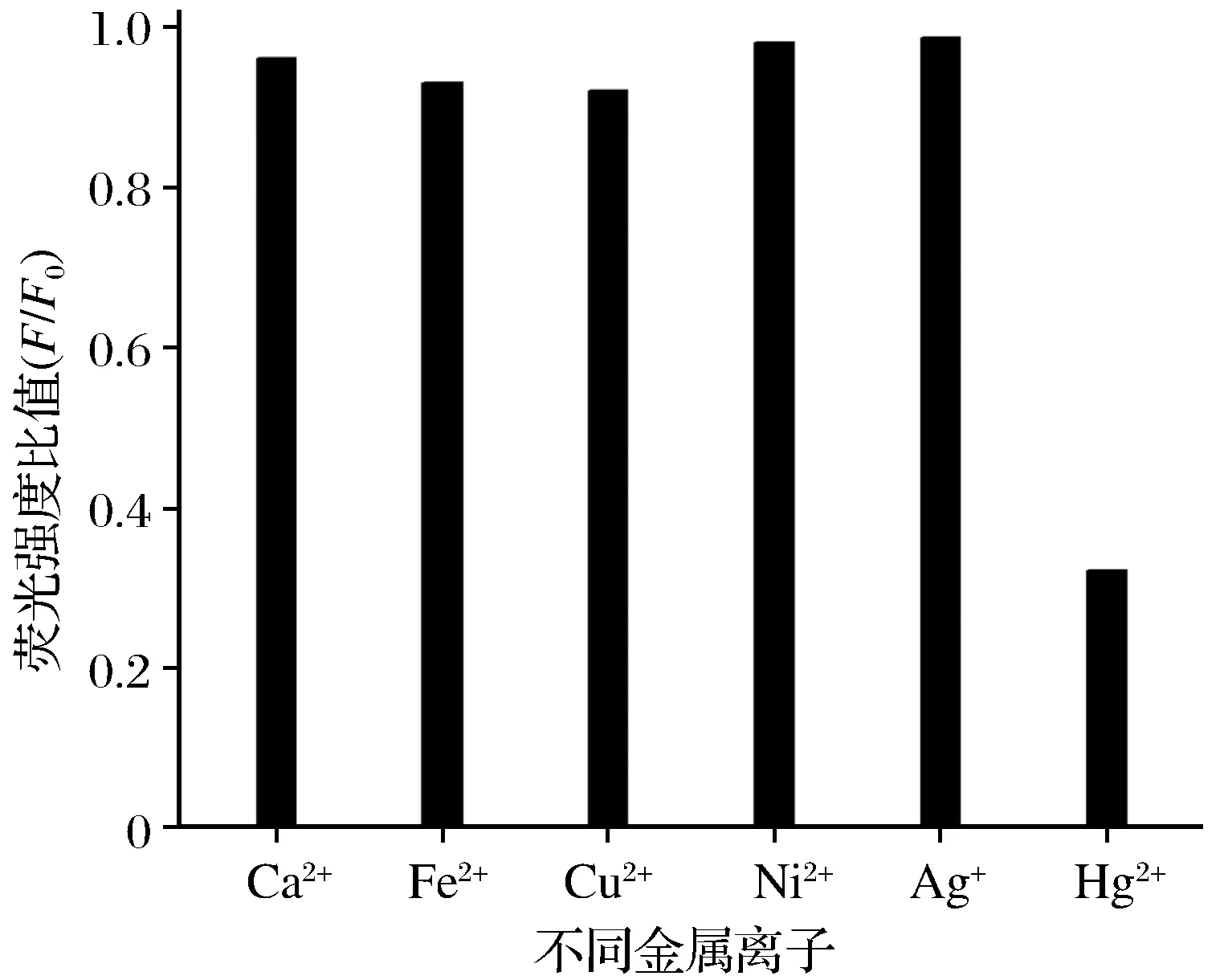
图7 传感器检测Hg2+特异性实验结果Fig.7 Specific experiment results of Hg2+detected by sensor
2.5 样品Hg2+加标回收检测
为验证该方法在实际样品检测中的可行性,利用该传感器检测自来水样品中Hg2+。向自来水样中分别加入不同浓度(200 nmol/L、400 nmol/L、600 nmol/L)的Hg2+,对比荧光检测结果与标准曲线的荧光信号,结果见表1。由表1可知,Hg2+在自来水样品中的回收率分别为87.74%、100.68%、99.05%,平均回收率为95.8%,结果表明该方法可用于实际样品分析。
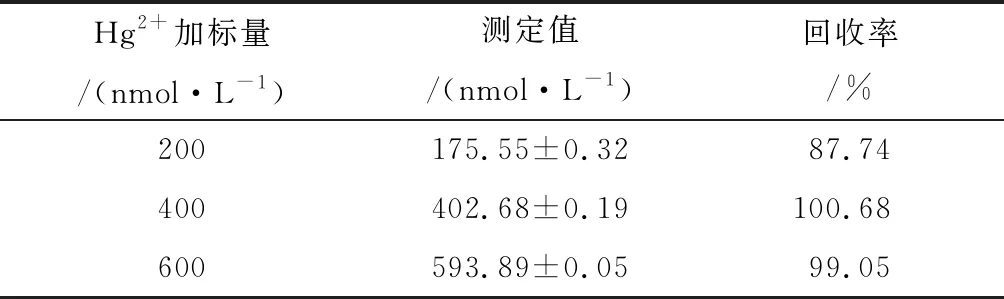
表1 自来水中不同浓度Hg2+的检测结果Table 1 Detection results of different concentrations of Hg2+ in tap water
3 结论
基于核酸适配体错配结合Hg2+的原理,结合特异性双链荧光染料SGⅠ,构建了一种基于SGⅠ的新型适配体荧光生物传感器,以此建立了高灵敏度、快速、便携的Hg2+荧光检测方法。该方法的检测灵敏度可达1 nmol/L,检测Hg2+的线性范围为10 nmol/L~1 μmol/L。在自来水样的Hg2+加标回收检测中,Hg2+平均回收率达到95.8%。与传统的检测方法相比,其具有操作简便、灵敏度高、特异性好的优点,在水体Hg2+含量的检测中具有较好的应用前景。
