普鲁兰多糖-明胶复合膜对大菱鲆的保鲜
2023-03-03刘恒睿于钰洁孟锦涛刘春娥
刘恒睿,于钰洁,孟锦涛,刘春娥
中国农业大学烟台研究院(烟台 264670)
大菱鲆(Scophthalmus maximus)是菱鲆属鱼类[1],含有丰富的氨基酸、多不饱和脂肪酸及维生素[2]。水产品死后易腐败,延长其货架期一直是研究的热点。可食膜保鲜具有操作简单、效果好、无污染等特点,被逐步应用于水产品的保鲜[3-4]。根据使用的基材不同,可食膜可分为多糖类、蛋白类、脂质类及复合类[5]。复合膜中多糖、蛋白质的种类、含量不同,膜的性质也不同,可满足不同食品的保鲜需要。
普鲁兰多糖具有耐酸碱性、吸附性、黏稠性、可降解性、成膜性和膜不透性[6-7]。Chen等[8]以2%~3%的普鲁兰多糖处理冷藏下的尼罗鱼片,结果发现鱼片的感官评价有所改善。明胶具有可降解性,可抑制褐变,防止吸潮,保持食品风味。Antoniewski等[9]使用20%的明胶保鲜4 ℃下贮藏的鲑鱼,结果发现其汁液损失率显著降低。明胶与多糖的相容性优良,与二者的单膜相比,复合膜的抗氧化性、抑菌性和阻隔性能均得到了改善[10]。董汝月等[4]使用6%的明胶和2%壳聚糖溶液制作成膜液,结果发现其可延缓4 ℃下南美白对虾的黑变。
此次试验研究了普鲁兰多糖-明胶复合膜对低温下大菱鲆鱼片的保鲜效果,通过测定鱼片的感官评价、pH、持水力、TBA值、TVB-N含量、菌落总数和优势菌,分析保鲜剂在延缓冷藏下大菱鲆鱼片腐败的作用,为大菱鲆的保鲜提供研究基础。
1 材料与方法
1.1 材料与试剂
新鲜大菱鲆(烟台市高新区渔窝窝海鲜超市),每条质量1±0.2 kg,30 min内带水活运至实验室。
食品级普鲁兰多糖、食用明胶(河南万邦实业有限公司);PCA琼脂培养基(杭州微生物试剂有限公司);硼酸(AR)、丙三醇(AR)、碳酸钾(AR)、乙二酸四乙酸二钠(AR)、无水乙醇(AR)、2-硫代巴比妥酸(AR)、三氯乙酸(AR)、1, 1, 3, 3-四乙氧基丙烷(AR):国药集团化学试剂有限公司;0.01 mol/L盐酸标准滴定液、甲基红-溴甲酚绿混合指示剂(广州和为医药科技有限公司);生理氯化钠溶液(安徽丰原药业股份有限公司)。
1.2 仪器与设备
PHS-3C型pH计(上海仪电科学仪器股份有限公司);TGL-16G型台式离心机(上海安亭科学仪器厂);UV754N型紫外可见分光光度计(上海佑科仪器仪表有限公司);DH209D型电热恒温培养箱(天津市泰斯特仪器有限公司);BHS-6型数显恒温水浴锅(江阴市保利科研器械有限公司);BL-388型冷藏展示柜(青岛英迪菲电器有限公司);MGC-100型光照培养箱(上海一恒科学仪器有限公司)。
1.3 方法
1.3.1 涂膜保鲜液的制备
配制3种保鲜液,分别为0.1%的普鲁兰多糖溶液,1.5%的明胶溶液和0.1%普鲁兰多糖+1.5%明胶混合溶液,各500 mL,置于4 ℃冰箱中备用。
1.3.2 大菱鲆鱼片的制备
鲜活大菱鲆剖杀后去头、尾及内脏,将背部新鲜鱼肉去皮后切成3 cm×3 cm×1 cm的鱼片,用生理氯化钠溶液冲洗干净,沥水。
1.3.3 涂膜处理
试验设四个组别,即空白组、多糖组、明胶组和复合组。将鱼片随机分组,浸泡于对应涂膜液中,5 min后取出,置于洁净干燥的封口袋中于4 ℃冰箱中保存。
1.3.4 指标测定
以样品处理当天为第0天,分别于第0,第2,第4,第6,第8,第10,第12和第14天测定各组pH、TVB-N含量、TBA值并进行感官评价,于第0,第2,第4,第6和第8天测定各组持水力及菌落总数。
1.3.4.1 感官评价
感官评定由5名有感官评定经验的人员进行,分值由低到高为1~5分。从色泽、气味、质地和纹理等方面分别对各组鱼片进行评分,具体评分标准见表1。

表1 大菱鲆鱼片综合感官评价表
1.3.4.2 pH测定
参照 GB/T 9695.5—2008《肉与肉制品pH测定》[11]对各组鱼片的pH进行测定。
1.3.4.3 持水力的测定
称取1 g(精确到0.001 g)鱼肉,用脱脂棉包好,放入5 mL离心管中,在9 000 r/min下离心10 min。取出样品,除去脱脂棉,称肉样重。按式(1)计算持水力。式中:W1为离心前样品的质量,m;W2为离心后样品的质量,m。
1.3.4.4 TVB-N含量的测定
参照 GB 5009.228—2016《食品中挥发性盐基氮的测定》[12]测定各组TVB-N含量。
1.3.4.5 TBA值的测定
参照GB 5009.181—2016《食品中丙二醛的测定》[13]测定各组TBA值。
1.3.4.6 菌落总数的测定
参照 GB 4789.2—2016《食品微生物学检验 菌落总数的测定》[14]测定各组菌落总数。
1.3.4.7 优势菌的测定
选取空白组第3天的样品、多糖组和明胶组第4天的样品、复合组第6天的样品进行优势菌的测定。
从1.3.4.6小节中选择菌落数为30~300的平板,挑取优势菌落,采用2216E培养基分离纯化,培养基配方见表2。

表2 2216E培养基的配方(1 L)
使用Tris饱和酚-氯仿法[15]提取纯化后的细菌DNA并检测浓度。PCR扩增采用细菌通用引物27F、1492R(由生物公司合成)。PCR反应体系见表3。

表3 50 μL的PCR扩增反应体系
PCR反应程序:94 ℃,预变性5 min;94 ℃,变性0.5 min;55 ℃,退火0.5 min;72 ℃,复性1.5 min;72 ℃延伸10 min;重复以上步骤35次。
进行1%的琼脂糖凝胶电泳及成像分析。将扩增后的DNA送往生物公司测序,将结果与NCBI数据库中的序列进行对比,确定优势菌属。
1.3.5 数据处理与分析
每组设置3个平行,使用SPSS 23.0软件统计分析,使用Origin 9.8和Adobe Illustrator 2022软件作图。
2 结果与分析
2.1 感官评价
图1为各组在保鲜过程中的感官评分变化。随保鲜时间延长,各组感官评分均降低(图1)。具体表现为鱼肉变黄,失去光泽,产生腥臭味,肌肉松散,肌纤维模糊,这是由于腐败菌及酶分解了鱼肉中的营养物质,导致肌肉组织破坏。0~14 d期间,复合组的评分均优于其他三组,这说明复合膜处理能更好地改善鱼片的感官评价,这一结果与董汝月等[4]明胶-壳聚糖复合膜的结论相符。普鲁兰多糖和明胶间具有较强的分子作用力和优良的相容性,使复合膜具有较高致密性和拉伸强度,从而使复合膜的氧气透过率低于二者的单膜,且多糖可抑制活性氧自由基的生成,终止自由基链的发生[16],从而抑制营养物质的氧化,使鱼片的感官评价维持在较高水平。

图1 大菱鲆鱼片保鲜过程中感官评分的变化
2.2 pH
鱼片初始pH为7.1~7.3,随时间的延长,各组均呈现先降低后升高的趋势(图2)。0~4 d期间,处理组pH均低于空白组,这可能是由于涂膜液的包覆制造了无氧环境,促进了厌氧菌的无氧呼吸,较空白组产生了更多的酸性物质。6~14 d期间,多糖组、明胶组及复合组的pH变化均较空白组缓慢,这与Jiang[17]的研究结果一致,这表明涂膜处理可有效降低氧气与鱼肉的接触,从而降低鱼肉中的微生物数量,延缓蛋白质的分解[18],且多糖可与鱼体内某些酶的活性中心外的氨基酸残基结合,从而抑制酶的活性[16]。

图2 大菱鲆鱼片保鲜过程中pH值的变化
2.3 持水力变化
随保鲜时间的延长,各组持水力均呈下降趋势(图3)。保鲜8 d后,空白组、多糖组、明胶组及复合组的持水力分别下降了11.30%,9.60%,6.97%和4.37%。8 d时,多糖组持水力显著低于明胶组及复合组(P<0.05),这可能是由于多糖内部的分子作用力使多糖单膜具有一定的孔隙,隔绝氧气和水的能力较差[16],鱼肉内微生物活性较强,肌原纤维蛋白降解较快,产生大量碱性物质,在使鱼肉pH上升的同时降低了鱼肉的持水力。8 d时,复合组持水力显著高于其他组别(P<0.05),说明复合膜在鱼片表面形成了更为致密的保护层,延缓了鱼片表面微生物对鱼肉蛋白质的降解[19],且多糖能够抑制蛋白酶的活性,从而保持肌球蛋白的结构,使持水力维持在较高水平。

图3 大菱鲆鱼片保鲜过程中持水力的变化
2.4 TVB-N含量变化
图4为贮藏期间各组TVB-N含量的变化,以30 mg/100 g作为限值。初始时各组TVB-N含量均为2 mg/100 g左右。0~4 d期间,各组TVB-N含量增长缓慢,4 d后空白组增长迅速,在第6天时达到28.2 mg/100 g,在第8天超过限值,且显著高于其他三组(P<0.05)。复合组在第12天超过限值,此时多糖组和明胶组TVB-N含量分别为29.4和28.0 mg/100 g,接近限值,与复合组差异不显著(P>0.05)。覆膜处理可抑制TVB-N的产生,延缓菌落总数的增加,这是由于两种保鲜剂均具有较为优良的阻氧性,可抑制酶和细菌的生物活性[20-21],同时多糖具有一定的抑菌性[22],能够破坏细菌的细胞壁和细胞膜并分解细菌成分,使菌落总数下降,减弱细菌分解鱼体肌肉的能力[23],延缓蛋白质的降解,抑制TVB-N的增加。

图4 大菱鲆保鲜过程中TVB-N含量的变化
2.5 TBA值变化
TBA值可以指示水产品的脂肪酸败程度[24]。一般认为TBA值达到2 mg/kg时,鱼体脂肪氧化严重,已不适合食用[25]。图5为贮藏期间各组TBA值的变化。各组初始值均在0.6~1.0 mg/kg,随贮藏时间的延长,各组TBA值均上升。其中:空白组TBA值增加最快,于第2天超过2 mg/kg,显著高于其他处理组(P<0.05);多糖组于第4天超过2 mg/kg,显著高于复合组(P<0.05);明胶组和复合组于第6天接近2 mg/kg,于第7~第8天超标。试验结果表明,涂膜处理可抑制TBA的增加,这是由于多糖和明胶均具有良好的成膜性[14-26],可阻止氧气与鱼肉的接触,减缓鱼体的褐变,抑制TBA值增加,使鱼肉保持较为良好的色泽。复合组TBA值低于其他三组,说明复合膜阻氧性更强[27-28],且能够延缓鱼肉中活性氧自由基和丙二醛的产生,从而提高鱼肉的抗氧化性[29]。试验中明胶组保鲜效果优于多糖组,这与楚银凤等[30]的试验结果一致,这是由于明胶中脯氨酸的氨基和羟脯氨酸的羟基可与其他氨基酸及水分子形成氢键,利于维持其类三螺旋结构,从而使明胶的阻氧性能优于普鲁兰多糖。

图5 大菱鲆保鲜过程中TBA含量的变化
2.6 菌落总数变化
菌落总数可反映肉制品受污染的程度,是评价保鲜效果的重要指标。各组菌落总数变化如图6所示,以6 lg CFU/g为限值。随保鲜时间的延长,各组别菌落总数均呈增长趋势。其中,空白组在第4天已明显超过限值,且显著高于其他三组(P<0.05),明胶组与多糖组菌落总数在第4天已接近限值,复合组于第6天已接近限值。相比于单膜处理,复合膜处理可有效抑制菌落的生长,这可能归因于多糖可破坏致病菌的分子结构,阻碍细菌的能量代谢,从而起到杀菌的作用[31],且明胶可抑制褐变,防止食品吸潮并阻止微生物的侵入[32]。

图6 大菱鲆保鲜过程中菌落总数的变化
2.7 优势腐败菌的鉴定
以纯化后的优势菌DNA为模板进行PCR扩增,将扩增后的基因片段进行琼脂糖凝胶电泳,所得图谱如图7所示。电泳获得的四条条带大小均在1 500~1 700 bp之间,说明优势菌基因组总DNA片段大小合适,DNA降解较少,完整性较好。

图7 菌株的PCR扩增产物电泳图

表5 多糖组腐败菌16S rDNA鉴定结果

表6 明胶组腐败菌16S rDNA鉴定结果
各组腐败菌16S rDNA鉴定结果如表4~表7所示。空白组优势菌属为芽孢杆菌(Bacillus),多糖组及明胶组优势菌属均为嗜冷杆菌(Psychrobacter),复合组优势菌属为希瓦氏菌属(Shewanella),以上结果置信度均达到98.80%以上。地衣芽孢杆菌为革兰氏阳性菌,为一种普遍存在的兼性好氧菌,能以内孢子的形式存在于水生动物的肠道内[33];嗜冷杆菌属于好氧菌,可在-10~42 ℃的范围内生长,在多种水产品中均有检出[34],程三红等[35]发现鲐鱼体表的特定腐败菌是嗜冷杆菌属;希瓦氏菌属革兰氏阴性菌,是水产品主要的优势腐败菌,可在缺氧条件下快速繁殖,并将三甲胺-N-氧化物还原为三甲胺,水解蛋白质和脂肪,产生鱼腥味。
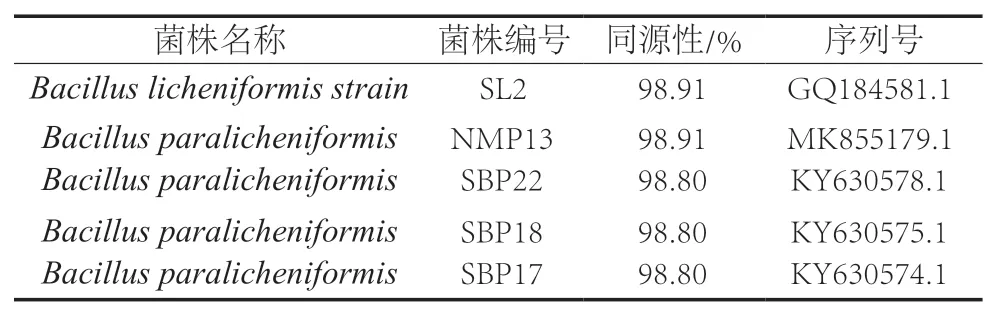
表4 空白组腐败菌16S rDNA鉴定结果

表7 复合组腐败菌16S rDNA鉴定结果
蓝蔚青等[36]发现带鱼经10 g/L壳聚糖保鲜液涂膜处理后在低温下贮藏,菌相逐渐单一,嗜冷杆菌的生长受到抑制,这与试验结果不同,可能是由于试验中多糖组的浓度偏低导致的抑菌效果不明显。预试验表明,普鲁兰多糖溶液浓度过高会影响鱼片感官,且溶解速度较慢,因此选择0.1%的多糖浓度。相比于单膜处理,混合后的多糖和明胶形成了均一的体系,明胶与多糖分子间的相互作用破坏了二者的自聚力,因而具有较好的相容性[37],提高复合膜的机械性能。此外复合膜内部分子间有较强的氢键和分子间作用力,使氧气不易通过,可有效抑制芽孢杆菌及嗜冷杆菌等需氧菌的生长[38]。刘剑侠[39]发现在多糖中加入茶多酚可以有效抑制希瓦氏菌的腐败,多糖和茶多酚的协同作用使复合膜的抑菌效果更加优良,这也为我们今后的试验设计提供思路。
3 结论
研究以普鲁兰多糖和食用明胶为原料,在4 ℃下探究普鲁兰多糖-明胶复合膜对大菱鲆鱼片品质的影响。结果表明:复合膜具有良好的阻氧性,在维持鱼肉的感官评价、保持鱼体肌肉结构、降低脂肪的氧化速率、抑制微生物生长等方面具有协同增效作用,能够使大菱鲆鱼片的冷藏货架期由3~4 d延长至6~7 d,有着广阔的应用前景。
