外周血细胞炎症标志物与PCOS患者性激素水平和胰岛素抵抗的关系*
2023-03-03杨羞花张慧青
杨羞花,张慧青
(桂林市妇幼保健院 妇科,广西 桂林 541001)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种以月经紊乱、雄激素过多、长期无排卵与卵巢多囊形态改变为主要特征的代谢紊乱性疾病,在育龄妇女中发病率约为5%~20%[1]。PCOS 患者常表现为月经失调、痤疮、多毛、不孕等,多伴有肥胖、胰岛素抵抗,长期可并发糖尿病、子宫内膜癌、心血管疾病等[2-3]。研究发现,慢性炎症与胰岛素抵抗、高雄激素血症、肥胖、排卵障碍等有关[4]。PCOS 属于亚临床炎症,虽不存在发热、局部红肿热痛等全身性表现,但可释放白细胞介素(Interleukin,IL)、C 反应蛋白(C reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子,导致代谢功能紊乱与机体防御能力减弱[5-6]。外周血细胞炎症标志物是基于血常规的衍生炎症指标,可客观反映患者免疫反应、炎症反应的平衡状态,其中中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)等已被证实可用于疾病早期诊断、判断病情程度、评估预后[7]。但目前国内外研究关于外周血细胞炎症标志物水平与PCOS 关系的报道较少。本研究采用病例对照试验,分析PCOS 患者外周血细胞炎症标志物表达及与性激素水平、胰岛素抵抗的相关性,旨在为临床诊断、评估PCOS 病情提供指导。
1 资料与方法
1.1 一般资料
选取2021年8月—2022年8月就诊于桂林市妇幼保健院的200 例PCOS 患者为PCOS 组。其中,年龄23~35 岁,平均(27.96±2.32)岁;体质量指数(BMI)21.9~29.2 kg/m2,平均(25.68±2.21)kg/m2;月经紊乱时间7~20 个月,平均(14.38±2.97)个月。另选取同期年龄匹配的健康体检女性为对照组。年龄24~33 岁,平均(26.86±2.54)岁;BMI 22.1~28.6 kg/m2,平均(25.13±2.34)kg/m2。两组的年龄、BMI 比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准
纳入标准:①PCOS 组。符合《妇产科学》[8]与《荷兰鹿特丹PCOS 会议修订的诊断标准》[9]的PCOS诊断标准:血清总睾酮(T)≥ 0.7 μg/L 或伴有痤疮、多毛症等高雄激素临床表现;月经稀发或延迟;超声表现为同一切面上直径2~9 mm 的卵泡个数≥12 个,或卵巢容积≥ 10 mL。具备至少2 项则诊断为PCOS。已婚女性,性生活正常,有生育要求;男方生殖功能正常;自愿签署知情同意书。②对照组。血激素水平、基础体温双相、月经周期正常;双侧输卵管通畅;B 超显示子宫与双侧附件均未见明显异常。排除标准:入组前3 个月内接受激素类药物、免疫抑制剂、糖皮质激素、避孕药、降糖类药物治疗;产生高雄激素的其他内分泌疾病,包括卵巢或肾上腺肿瘤、先天性肾上腺皮质增生症、库欣综合征等;有系统性红斑狼疮、类风湿关节炎、溃疡性结肠炎等炎症性疾病;有血液系统疾病;重要脏器功能严重不全;有凝血功能障碍。
1.3 方法
1.3.1 血标本采集采集两组研究对象月经周期第2~4 天(闭经者则于B 超未见优势卵泡时采集)的3 mL 空腹外周血,3 000 r/min 离心10 min(离心半径为6 cm),取上清液。
1.3.2 外周血细胞炎症标志物检测将采集的血标本在2 h 内利用迈瑞Mindray 全自动血液细胞分析仪6000(南京贝登医疗股份有限公司)测定白细胞计数、淋巴细胞计数、中性粒细胞计数、单核细胞计数、血小板计数,并计算NLR、衍生中性粒细胞与淋巴细胞比值[dNLR,dNLR=中性粒细胞计数/(白细胞计数-中性粒细胞计数)]、PLR、淋巴细胞与单核细胞比值(LMR)、系统免疫炎症指数(SII,SII=血小板计数×中性粒细胞计数/淋巴细胞计数)。
1.3.3 性激素水平检测通过放射免疫法(试剂盒购自深圳市健竹科技有限公司)测定黄体生成素(LH)、卵泡刺激素(FSH)、T 水平,均通过美国雅培i2000 发光全自动免疫分析系统检测。
1.3.4 胰岛素抵抗指标检测利用美国雅培i6000 全自动生化分析仪测定空腹胰岛素水平与血糖水平,计算稳态模型胰岛素抵抗指数(HOMA-IR)=空腹血糖×空腹胰岛素/22.5,胰岛素敏感指数(ISI)=1/(空腹血糖×空腹胰岛素)。
1.4 统计学方法
数据分析采用SPSS 24.0 统计软件,计量资料以均数±标准差(±s)表示,比较用t检验;相关分析用Pearson 法;绘制ROC 曲线;影响因素的分析采用多因素Logistic 逐步回归分析模型。P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血细胞炎症标志物指标比较
两组研究对象的白细胞计数、淋巴细胞计数、中性粒细胞计数、单核细胞计数、血小板计数、NLR、dNLR、PLR、LMR、SII 比较,经t检验,差异有统计学意义(P<0.05),PCOS 组均高于对照组。见表1。
表1 两组外周血细胞炎症标志物指标比较 (±s)

表1 两组外周血细胞炎症标志物指标比较 (±s)
组别对照组PCOS组t 值P 值n 100 200白细胞计数/×109/L 5.13±1.32 7.35±1.65 11.708 0.000淋巴细胞计数/×109/L 2.03±0.32 2.75±0.41 5.866 0.000中性粒细胞计数/×109/L 3.65±1.32 4.06±1.08 2.873 0.004单核细胞计数/×109/L 0.39±0.15 0.49±0.22 4.093 0.000血小板计数/×109/L 225.62±18.56 274.62±24.65 17.541 0.000组别对照组PCOS组t 值P 值NLR/%1.11±0.27 1.47±0.40 7.467 0.000 dNLR/%1.00±0.26 1.41±0.30 10.462 0.000 PLR/%112.13±12.07 132.38±12.08 11.857 0.000 LMR/%2.57±0.30 2.82±0.29 5.916 0.000 SII/%169.31±14.90 198.89±18.13 12.602 0.000
2.2 两组的性激素与胰岛素抵抗指标比较
两组研究对象的LH、FSH、T、HOMA-IR、ISI 比较,经t检验,差异均有统计学意义(P<0.05),PCOS 组LH、T、HOMA-IR 均高于对照组,FSH、ISI 均低于对照组。见表2。
表2 两组的性激素水平与胰岛素抵抗指标比较 (±s)

表2 两组的性激素水平与胰岛素抵抗指标比较 (±s)
组别对照组PCOS组t值P值n 100 200 FSH/(mIU/mL)7.02±1.32 5.15±0.98 13.822 0.000 LH/(mIU/mL)7.82±2.67 12.74±3.35 12.792 0.000 T/(ng/mL)0.35±0.15 0.83±0.12 13.097 0.000 HOMA-IR 2.18±0.39 4.16±0.51 34.141 0.000 ISI-2.02±0.41-3.46±0.49 25.288 0.000
2.3 两组外周血细胞炎症标志物与性激素、胰岛素抵抗的相关性分析
Pearson 相关性显示,外周血NLR、dNLR、PLR、LMR、SII 与LH(r=0.385、0.425、0.483、0.231 和0.494)、T(r=0.435、0.479、0.539、0.349 和0.501)、HOMA-IR(r=0.452、0.561、0.580、0.361 和0.632)呈正相关(P<0.05),与FSH(r=-0.340、-0.463、-0.621、-0.378 和-0.533)、ISI(r=-0.512、-0.546、-0.732、-0.462 和-0.638)呈负相关(P<0.05)。见表3。

表3 外周血细胞炎症标志物与性激素、胰岛素抵抗的相关性分析参数
2.4 外周血细胞炎症标志物对PCOS 发生的预测效能
将PCOS 是否发生作为状态变量(未发生 = 0,发生 = 1)绘制ROC 曲线,结果显示,NLR、dNLR、PLR、LMR、SII 及联合预测PCOS 发生的敏感性分别为68.9%(95% CI:0.593,0.782)、72.6%(95% CI:0.652,0.796)、75.1%(95% CI:0.683,0.818)、64.2%(95% CI:0.528,0.721)、76.2%(95% CI:0.699,0.842)、82.1%(95% CI:0.782,0.896),特异性分别为76.2%(95% CI:0.693,0.832)、84.3%(95% CI:0.793,0.902)、87.9%(95% CI:0.816,0.921)、75.3%(95% CI:0.673,0.828)、90.2%(95% CI:0.834,0.953)、96.7%(95% CI:0.893,0.986)。见表4和图1。

图1 外周血细胞炎症标志物预测PCOS发生的ROC曲线

表4 外周血细胞炎症标志物预测PCOS发生的效能分析
2.5 影响PCOS发生的危险因素
将PCOS 是否发生作为因变量(未发生 =0,发生 =1),将NLR、dNLR、PLR、LMR、SII 作为自变量(均为连续变量),纳入多因素Logistic 逐步回归分析模型(α入=0.05,α出=0.10),结果显示,为PCOS 发生的危险因素(P<0.05)。见表5。
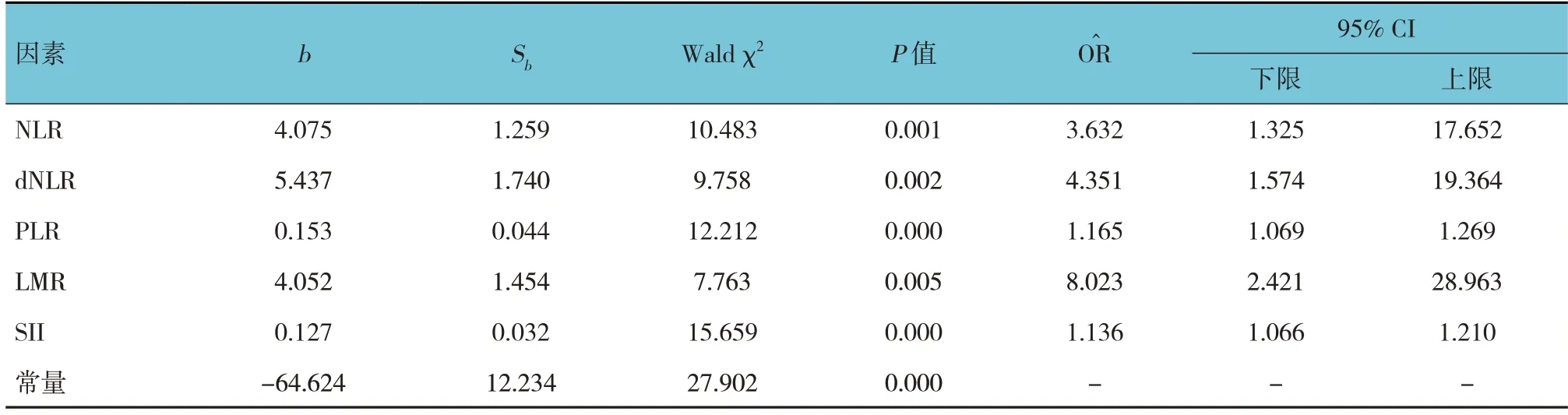
表5 影响PCOS发生危险因素的多因素Logistic逐步回归分析参数
3 讨论
大部分PCOS 患者体内存在慢性低度炎症反应,且与胰岛素抵抗、雄激素分泌过多、动脉粥样硬化、腹型肥胖等因素相关[10-11]。但由于PCOS属于一个涉及代谢、内分泌、生殖等多系统的疾病,关于炎症与PCOS 的机制尚未完全阐明。ROSTAMTABAR 等[12]研究显示,炎症复合物介导的IL-18、IL-1β 的产生可能参与PCOS 的发生、发展过程中。BANNIGIDA 等[13]研究报道,PCOS 女性血清炎症因子升高,存在明显的炎症反应。同时HERMAN 等[14]通过检测炎症通路基因证实,炎症通路中的遗传变异可对葡萄糖稳态、PCOS 发生风险产生影响。由此可见,探寻PCOS 发病机制中的炎症过程与相应介质,再进一步明确PCOS 病理生理学机制,通过控制相关通路治疗中尤为关键。
3.1 PCOS患者外周血细胞炎症标志物水平升高
LIU 等[15]在一项回顾性病例对照研究中报道,PCOS 组NLR、HOMA-IR 高于健康对照组,且NLR、HOMA-IR 与BMI 指数呈正相关。黄哲人等[16]研究发现,PCOS 患者NLR 异常升高,且与血脂代谢异常密切相关。但KAŁUŻNA 等[17]却提出不一样的结果,该研究发现PCOS 患者与健康受试者的NLR、LMR 未见明显差异。由此可见,目前临床上关于外周血细胞炎症标志物水平与PCOS 的关系尚存在一定争议,且细胞炎症标志物的研究多集中于NLR、 LMR 等。 本研究中,PCOS 组NLR、dNLR、PLR、LMR 与SII 较对照组高,表示PCOS患者免疫、炎症途径激活,上述外周血细胞炎症标志物水平升高往往表示PCOS 患者体内炎症、免疫平衡状态被打破,从而造成慢性炎症反应与免疫功能紊乱。分析原因在于:①中性粒细胞可产生细胞外陷阱(NET),影响高迁移率组蛋白B1/晚期糖基化终末产物受体/白细胞介素-8(HMGB1/RAGE/IL-8)轴表达,从而在启动与调节炎症过程中发挥重要作用。同时,中性粒细胞吞噬能力强,可在病变处分泌基质金属蛋白酶、趋化因子与细胞因子等物质,进而造成免疫细胞浸润与组织损伤,诱发慢性炎症[18-19]。②淋巴细胞具有分泌抗体、调节免疫等功能,可分泌TNF-α、ɤ-干扰素(ɤ-IFN)等诸多细胞因子,加剧炎症反应。③脂肪组织与白细胞分泌的细胞因子作用于细胞的糖脂代谢,导致体内炎症反应被激活,加重慢性炎症反应。④单核细胞进入组织中可成为巨噬细胞,而巨噬细胞在脂肪组织中的累积与肥胖有关。脂肪组织分泌巨噬细胞炎症蛋白-1α 与单核细胞化学趋化蛋白-1,诱导胰岛素抵抗、巨噬细胞浸润至脂肪组织。⑤血小板可视为与白细胞结合的特异性炎症标志物,血小板活化时释放的组织因子与组织的炎症、损伤有关,且可刺激中性粒细胞等其他细胞,进一步导致炎症因子大量分泌。而炎症反应、免疫功能受损可直接作用于卵巢,造成排卵异常或阻碍卵泡正常发育;或通过诸多机制诱导高雄激素血症、胰岛素抵抗或肥胖,进而加剧PCOS 的发生。本研究ROC 曲线分析结果显示,NLR、dNLR、PLR、LMR、SII 及联合预测PCOS 发生的AUC 分别为0.752、0.835、0.869、0.709、0.889 和0.961,且NLR、dNLR、PLR、LMR 与SII 均可能是PCOS 发生的危险因素,再次证实外周血细胞炎症标志物水平与PCOS 的发生、发展密切相关,且提示临床应警惕NLR、dNLR、PLR、LMR 与SII 同时升高的患者,以预防PCOS 的发生。
3.2 外周血细胞炎症标志物与PCOS 患者性激素、胰岛抵抗相关
本研究Pearson 相关性结果显示,NLR、dNLR、PLR、LMR、SII 均与LH、T、HOMA-IR 呈正相关,与FSH、ISI 呈负相关,可见PCOS 患者外周血细胞炎症标志物水平与性激素水平、胰岛素抵抗存在密切相关性,可指导临床合理诊治。分析具体原因包括:①高雄激素血症是PCOS 的特征之一,可加剧腹部脂肪沉积,进一步增加雄激素分泌与胰岛素抵抗。雄激素与雌激素受体相结合可激活活性氧自由基(ROS)系统与NF-κB 炎症通路,进而诱导诸多炎症因子产生,加剧炎症反应。而PCOS 体内炎症因子可通过诱导胰岛素抵抗而间接促进雄激素合成,引发性激素紊乱[20]。②随着PCOS 病情不断进展,单核细胞进入组织中形成巨噬细胞与淋巴细胞,炎性介质可改变胰岛素受体的亲和力与数量,干扰胰岛素受体信号传导,影响胰岛素受体磷酸化水平。同时,炎性介质存在一定氧化性,可诱发氧化损伤,减弱外周组织对胰岛素的敏感度,降低胰岛素细胞分泌功能,进而造成胰岛细胞分泌缺陷和/或胰岛素抵抗与糖耐量异常。而作为代谢紊乱的中心环节,胰岛素抵抗可直接介导炎症反应,经激活交感神经系统、抑制淋巴细胞传导等方式间接激活炎症反应,进而导致外周血NLR、dNLR、PLR 等增加,形成恶性循环。PERGIALIOTIS 等[21]研究发现,PCOS 患者PLR与孕酮呈负相关(r=-0.177,P=0.024),NLR 与FSH呈负相关(r=-0.204,P=0.007),与T 呈正相关(r=0.234,P=0.003),与本研究结果相似,再次证实外周血细胞炎症标志物与PCOS 患者性激素有关。
综上所述,PCOS 患者外周血NLR、dNLR、PLR、LMR、SII 呈高表达,与性激素水平、胰岛素抵抗密切相关,联合检测可有效预测PCOS 的发生
