LncRNA MALAT-1靶向microRNA-370-3p调节Akt通路对肺癌细胞生物学行为影响的机制研究*
2023-03-03李亮李建忠张丹杰马跃峰李少民
李亮,李建忠,张丹杰,马跃峰,李少民
(西安交通大学第二附属医院 胸外科,陕西 西安 710004)
肺癌是全世界范围内发病率最高的恶性肿瘤,其中85%的肺癌患者为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。肺癌的临床治疗以手术、放化疗、靶向治疗为主,这些方法虽然在一定程度上能延长患者的生存期,但肺癌患者的预后仍然不容乐观,文献报道其5年总生存率仅为15%左右[2],因此有必要对肺癌的发病机制进行深入研究并寻找新的靶点。长链非编码RNA(longnoncodingRNA,LncRNA)近年来被发现参与多种恶性肿瘤的增殖和转移,多个文献报道LncRNA 在乳腺癌[3]、肝癌[4]、胰腺癌[5]、肺癌[6]等多种癌组织中高表达,LncRNA 肺腺癌转移相关转录因子-1(metastasis associated lung adenocarcinoma transcript 1,MALAT-1)是肺癌的特异性标志物,LncRNA MALAT1 高表达是肺癌不良预后的预测因素之一[7]。微小RNA(microRNA,miR)是一种广泛存在于细胞中的非编码RNA,miR 是LncRNA MALAT1 的靶基因之一,LncRNA MALAT1 可以通过与有靶向结合位点的miR 靶基因相结合,调节其转录或翻译水平,进一步参与肿瘤的发生发展。已有相关研究[8]报道LncRNA 可以通过与下游miR 结合调控恶性肿瘤的发生、发展。Akt 激酶信号通路途径是影响肺癌细胞增殖、凋亡、迁移及侵袭的重要通路。目前关于LncRNA MALAT1 与miR-370-3p 在肺癌中是否存在相互作用尚不可知,本研究拟观察LncRNA MALAT1是否可以通过靶向结合miR-370-3p 影响肺癌细胞的生长与凋亡,并检测下游Akt 通路蛋白的表达变化,探究其是否对该通路存在影响作用,以期为肺癌的机制研究提供参考。
1 材料与方法
1.1 主要试剂和仪器
人肺癌细胞A549 由上海细胞资源中心提供,DMEM 培养液、胎牛血清(FBS)、胰蛋白酶购自美国Thermofisher 公司,荧光素酶检测试剂盒购自上海汉恒生物科技有限公司,LncRNA MALAT-1 siRNA(si-MALAT-1)及其阴性对照(si-MALAT-1-NC)、pcDNA-MALAT-1、miR-370-3p 模拟物(miR-370-3p mimic)和抑制剂(miR-370-3p inhibitor)及其阴性对照序列(miR-NC)购自美国Sigma-Alrdich 公司,转染试剂盒购自美国Thermo 公司,Akt 单克隆抗体、p-Akt 单克隆抗体、PI3K 单克隆抗体、p-PI3K 单克隆抗体购自美国Abcam 公司,辣根过氧化物酶购自北京中杉金桥公司,膜联蛋白(Annexin)V-FITC/碘化丙啶(PI)细胞凋亡试剂盒购自武汉伊莱瑞特生物科技股份有限公司。主要仪器:二氧化碳培养箱购自常州恒隆仪器有限公司,酶标仪购自美国Thermo 公司,BSC-1100IIA2-X 生物安全柜购自济南欧莱博科学仪器有限公司。
1.2 方法
1.2.1 细胞培养人肺癌细胞A549 培养于含有10% FBS 的DMEM 培养液中,置于37℃、5%二氧化碳恒温箱中,当细胞生长至融合度80%以上开始传代实验。收集对数期A549 细胞制成细胞悬液,并接种在24 板孔中。
1.2.2 分组①抑制LncRNA MALAT-1 或过表达miR-370-3p 对肺癌细胞增殖、迁移、凋亡及Akt 通路的影响:随机分为对照组(Control 组,不转染)、si-NC组(转染si-MALAT-1 NC)、si-MALAT-1 组(转染si-MALAT-1)、mi-NC 组(转染miR-NC)、miR-370-3p组(转染miR-370-3p mimic)。 ②抑制LncRNA MALAT-1 并干扰miR-370-3p 对肺癌细胞增殖、迁移、凋亡及Akt 通路的影响:随机分为对照组(Control 组,不转染)、si-NC 组(转染si-MALAT-1 NC)、si-MALAT-1 组(转染si-MALAT-1)、si-MALAT-1+anti-miR-NC 组(同时转染si-MALAT-1 和anti-miR-NC)、si-MALAT-1+anti-miR-370-3p 组(同时转染si-MALAT-1 和anti-miR-370-3p)。所有转染操作严格按照Lipofectmine 2000 说明书进行,各组细胞转染6 h 后更换新的含有青霉素/链霉素的10%FBS DMEM 培养液继续培养72 h,分别于24 h、48 h、72 h 进行细胞收集。
1.2.3 双荧光素酶报告基因检测首先使用预测软件TargetScan 和miRanda 进行靶基因预测,检查LncRNA MALAT-1 与miR-370-3p 是否存在结合位点,再分别构建MALAT-1 野生型(MALAT-1WT_1uc)与突变型(MALAT-1MUT_1uc)荧光素酶报告基因质粒。然后将培养的A549 细胞接种于24 孔板,继续培养过夜,待完全贴壁后采用脂质体转染法进行转染,分别将带有MALAT-1WT_luc、MALAT-1MUT_luc 双报告基因质粒和miR-370-3p、miR-NC 转染至A549细胞中,转染48 h 后检测萤火虫荧光素酶(Firefly)和海肾(Renilla)的荧光强度,以二者的比值(Firefly/Renilla)衡量相对活性,反映LncRNA MALAT-1 和miR-370-3p 的结合情况。
1.2.4 实时荧光定量聚合酶链反应(qRT-PCR)检测LncRNA MALAT-1、miR-370-3p 表达细胞培养液1 000 r/min 离心5 min,取下层细胞沉淀,加入1 mL TRIzol 液吹打均匀后移入EP 管,室温放置5 min,然后12 000 r/min 离心5 min,取上清液。测定纯度时加入Buffer 溶解,计算A260/A280 比值,比值处于1.6~1.8,最后调整RNA 浓度至100 μg/mL。按照试剂盒说明书配制总反应体系20 μL(2 μL 逆转录引物、2 μL 逆转录酶、2 μL dNTPs、0.5 μL RNA 酶抑制剂、4 μL RT Buffer、9.5 μL ddH2O)进行逆转录,逆转录条件:42℃逆转录30 min、85℃ 酶失活反应5 min,置入-20℃冰箱冷冻保存。再进行qRT-PCR,按照试剂盒说明书配制总反应体系20 μL(2 μL 正向引物、2 μL 反向引物、2 μL cDNA、10 μL PCR master mix、4 μL ddH2O),反应条件:95℃预变性2 min,95℃变性15 s,58℃退火30 s,58℃延伸30 s,共40 个循环。设置3 个重复孔,GAPDH 为内参对照,以2-ΔΔCt计算目的基因相对表达量。引物序列见表1。

表1 引物序列
1.2.5 Transwell实验检测细胞侵袭与迁移侵袭实验:采用含0.1% FBS 的DMEM 培养基培养细胞24 h,调整细胞浓度为1×106/mL,接种于含有基质胶的Transwell 小室的上室中,在下室中加入500 μL 含有10% FBS 的DMEM 培养基,37℃、5%二氧化碳培养箱中培养24 h,取出小室,弃去培养液,PBS 缓冲液冲洗3 遍,多聚甲醛固定30 min,0.1%结晶紫染色20 min,棉签擦去上层未迁移细胞,PBS 缓冲液冲洗3 遍,显微镜下随机选取10 个视野进行细胞计数。迁移实验:用不含FBS 的DMEM 培养基重悬制备细胞悬液,将其重悬后接种于Transwell 小室的上室中,其他操作与侵袭实验相同。
1.2.6 流式细胞术检测细胞凋亡取各组细胞加入0.25%胰蛋白酶消化并制成细胞悬液,以每管1×106个细胞加入流式离心管,培养48 h 后,加入10 μL Annexin V-FITC,混匀后在冰上避光孵育30 min,再加入5μL PI,涡旋混匀,冰上孵育5 min,流式细胞仪检测细胞凋亡情况。
1.2.7 MMT法检测细胞增殖活性取对数期细胞加入0.25%胰蛋白酶消化并制成单细胞悬液,调整细胞浓度为1×106/mL,接种于96 孔板(每孔100 μL),培养48 h 后于每孔中加入20 μL 的MTT 溶液(5 mg/mL),室温下孵育4 h,再加入150 μL 的DMSO,震荡10 min,用酶标仪读取490 nm 波长处各孔的光密度度值(OD)。 细胞存活率=(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)×100%。
1.2.8 Western blotting 法检测Akt、p-Akt、PI3K、p-PI3K 蛋白相对表达量Tris 法提取总蛋白,BCA法测定蛋白浓度,配置10% SDS-PAGE 凝胶,取20 μL 样品上样,120 V 垂直电泳60 min,转膜,5%脱脂牛奶室温封闭1 h,加入一抗,4℃过夜,洗膜,加入辣根过氧化物酶标记的二抗,室温孵育1 h,显影后进行曝光洗片,以β-actin 为内参,采用Image J 软件计算每个条带的光密度值,以目的蛋白的灰度值/GAPDH 灰度值表示蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,组间比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 抑制LncRNA MALAT-1或过表达miR-370-3p各组LncRNA MALAT-1mRNA、迁移细胞数、侵袭细胞数及细胞凋亡率的比较
qRT-PCR 结果显示,细胞迁移、侵袭及凋亡实验结果显示,Control 组、si-NC 组及si-MALAT-1组的LncRNA MALAT-1 mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05),与Control组和si-NC 组比较,si-MALAT-1 组的LncRNA MALAT-1 mRNA 相对表达量下降(P<0.05),见表1。细胞迁移、侵袭及凋亡实验结果显示,Control 组、si-NC 组、si-MALAT-1 组、miR-NC 组及miR-370-3p组的迁移细胞数、侵袭细胞数及细胞凋亡率比较,经方差分析,差异有统计学意义(P<0.05);与Control 组比较,si-MALAT-1 组和miR-370-3p 组迁移细胞数、侵袭细胞数减少(P<0.05),细胞凋亡率升高(P<0.05),与miR-NC 组比较,miR-370-3p组迁移细胞数、侵袭细胞数减少(P<0.05),细胞凋亡率升高(P<0.05)。见表2 和图1~3。

图1 各组A549细胞的迁移情况 (结晶紫染色×200)
表2 各组LncRNA MALAT-1mRNA、迁移细胞数、侵袭细胞数及细胞凋亡率的比较 (±s)

表2 各组LncRNA MALAT-1mRNA、迁移细胞数、侵袭细胞数及细胞凋亡率的比较 (±s)
注:①与Control组比较,P <0.05;②与si-NC组比较P <0.05;③与miR-NC组比较P <0.05。
组别Control组si-NC组si-MALAT-1组miR-NC组miR-370-3p组F 值P 值LncRNA MALAT-1 mRNA 1.00±0.02 0.98±0.03 0.42±0.06①②--9.206 0.021迁移细胞数/个156.39±5.41 150.67±6.52 64.36±4.73①②150.84±5.23 52.68±4.35①③22.015 0.001侵袭细胞数/个120.20±6.38 125.88±7.16 70.53±5.62①②130.99±6.81 60.77±5.06①③18.902 0.002细胞凋亡率/%4.08±0.33 4.03±0.17 12.92±0.21①②4.79±0.33 11.96±1.17①③12.569 0.009
2.2 各组不同时间点细胞增殖活性的比较
MMT 法检测结果显示,培养24 h、48 h、72 h 后,Control 组、si-NC 组、si-MALAT-1 组、miR-NC 组及miR-370-3p 组的细胞增殖活性比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞增殖活性有差异(F=9.308,P=0.020);②各组细胞增殖活性有差异(F=11.308,P=0.013);③各组细胞增殖活性变化趋势有差异(F=7.338,P=0.036)。见表3。
表3 各组不同时间点细胞增殖活性的比较 (±s)

表3 各组不同时间点细胞增殖活性的比较 (±s)
注:①与Control 组比较,P <0.05;②与si-NC 组比较P <0.05;③与miR-NC组比较,P <0.05。
组别Control组si-NC组si-MALAT-1组miR-NC组miR-370-3p组24 h 0.35±0.04 0.34±0.03 0.32±0.05 0.36±0.08 0.31±0.09①③48 h 0.67±0.07 0.64±0.07 0.44±0.06①②0.62±0.10 0.39±0.11①③72 h 1.33±0.16 1.29±0.15 0.75±0.11①②1.27±0.22 0.68±0.14①③

图2 各组A549细胞的侵袭情况 (结晶紫染色×200)

图3 各组A549细胞的凋亡情况
2.3 各组A549细胞的Akt通路相关蛋白表达比较
Western blotting 结果显示,Control 组、si-NC组、si-MALAT-1 组、miR-NC 组及miR-370-3p 组细胞p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);与Control 组比较,si-MALAT-1 组和miR-370-3p 组细胞的p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量降低(P<0.05),与miR-NC 组比较,miR-370-3p 组细胞的p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量降低(P<0.05)。见表4 和图4。
表4 各组p-Akt/Akt、p-PI3K/PI3K蛋白相对表达量的比较 (±s)

表4 各组p-Akt/Akt、p-PI3K/PI3K蛋白相对表达量的比较 (±s)
注:①与Control 组比较,P <0.05;②与si-NC 组比较P <0.05;③与miR-NC组比较,P <0.05。
组别Control组si-NC组si-MALAT-1组miR-NC组miR-370-3p组F 值P 值p-Akt/Akt 1.16±0.04 1.08±0.06 0.46±0.09①②0.99±0.02 0.28±0.07①③6.569 0.008 p-PI3K/PI3K 0.97±0.06 0.93±0.18 0.33±0.05①②0.88±0.09 0.25±0.04①③7.235 0.003

图4 各组A549细胞的Akt通路相关蛋白的表达
2.4 LncRNA MALAT-1对miR-370-3p的靶向调控作用
TargetScan 靶基因预测发现LncRNA MALAT-1与miR-370-3p 存在结合位点(见图5)。荧光素酶报告基因实验检测发现,MALAT-1WT_1uc+Control组、MALAT-1WT_1uc+miR NC 组、MALAT-1WT_1uc+miR-370-3p 组相对荧光强度分别为(1.00±0.12)、(0.98±0.11)、(0.35±0.09),经方差分析,差异有统计学意义(F=7.521,P=0.008);与MALAT-1WT_1uc+Control 组和MALAT-1WT_1uc+miR NC 组比较,LncRNA MALAT-1WT_1uc+miR-370-3p 组的相对荧光强度降低(P<0.05)。MALAT-1MUT_1uc+Control 组、MALAT-1MUT_1uc+ miR NC 组、 MALAT-1MUT_1uc+miR-370-3p 组相对荧光强度分别为(1.02±0.14)、(0.93±0.10)、(0.96±0.13),经方差分析,差异无统计学意义(F=1.013,P=0.092)。

图5 LncRNA MALAT-1与miR-370-3p的结合位点
进一步qRT-PCR 检测发现,Control 组、si-NC组、si-MALAT-1 组、si-MALAT-1+anti-miR-NC 组及si-MALAT-1+anti-miR-370-3p 组的miR-370-3p mRNA 相对表达量比较,经方差分析,差异有统计学意义(F=12.332,P=0.006);与Control 组比较,si-MALAT-1 组的miR-370-3p mRNA 相对表达量升高(P<0.05);与si-MALAT-1 组比较,si-MALAT-1+anti-miR-370-3p 组的miR-370-3p mRNA 相对表达量降低(P<0.05)。见表5。
表5 各组miR-370-3p mRNA、迁移细胞数、侵袭细胞数及细胞凋亡率的比较 (±s)
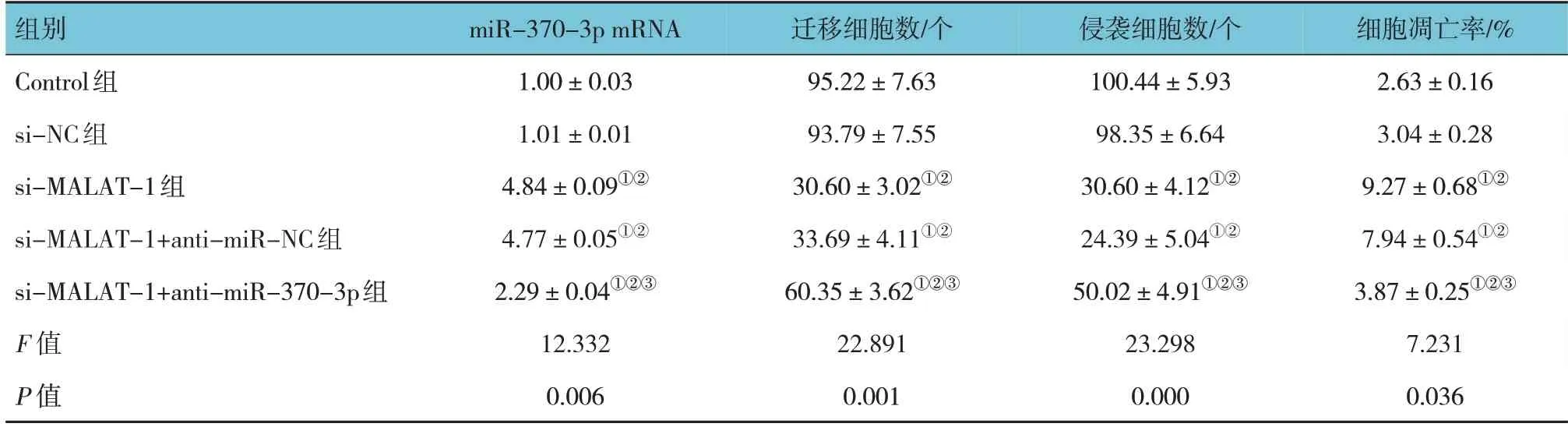
表5 各组miR-370-3p mRNA、迁移细胞数、侵袭细胞数及细胞凋亡率的比较 (±s)
注:①与Control组比较,P <0.05;②与si-NC组比较,P<0.05;③与si-MALAT-1组比较P <0.05。
组别Control组si-NC组si-MALAT-1组si-MALAT-1+anti-miR-NC组si-MALAT-1+anti-miR-370-3p组F 值P 值miR-370-3p mRNA 1.00±0.03 1.01±0.01 4.84±0.09①②4.77±0.05①②2.29±0.04①②③12.332 0.006迁移细胞数/个95.22±7.63 93.79±7.55 30.60±3.02①②33.69±4.11①②60.35±3.62①②③22.891 0.001侵袭细胞数/个100.44±5.93 98.35±6.64 30.60±4.12①②24.39±5.04①②50.02±4.91①②③23.298 0.000细胞凋亡率/%2.63±0.16 3.04±0.28 9.27±0.68①②7.94±0.54①②3.87±0.25①②③7.231 0.036
2.5 抑制LncRNA MALAT-1并干扰miR-370-3p各组miR-370-3p 表达、迁移细胞数、侵袭细胞数及细胞凋亡率的比较
细胞迁移、侵袭及凋亡实验结果显示,Control组、si-NC 组、si-MALAT-1 组、si-MALAT-1+antimiR-NC 组及si-MALAT-1+anti-miR-370-3p 组的迁移细胞数、侵袭细胞数及细胞凋亡率比较,经方差分析,差异有统计学意义(P<0.05);与Control组比较,si-MALAT-1 组迁移细胞数、侵袭细胞数减少(P<0.05),细胞凋亡率升高(P<0.05)。与si-MALAT-1 组比较,si-MALAT-1+anti-miR-370-3p组的迁移细胞数、侵袭细胞数增加(P<0.05),细胞凋亡率降低(P<0.05)。见表5 和图6~8。

图6 各组A549细胞的迁移情况 (结晶紫染色×200)
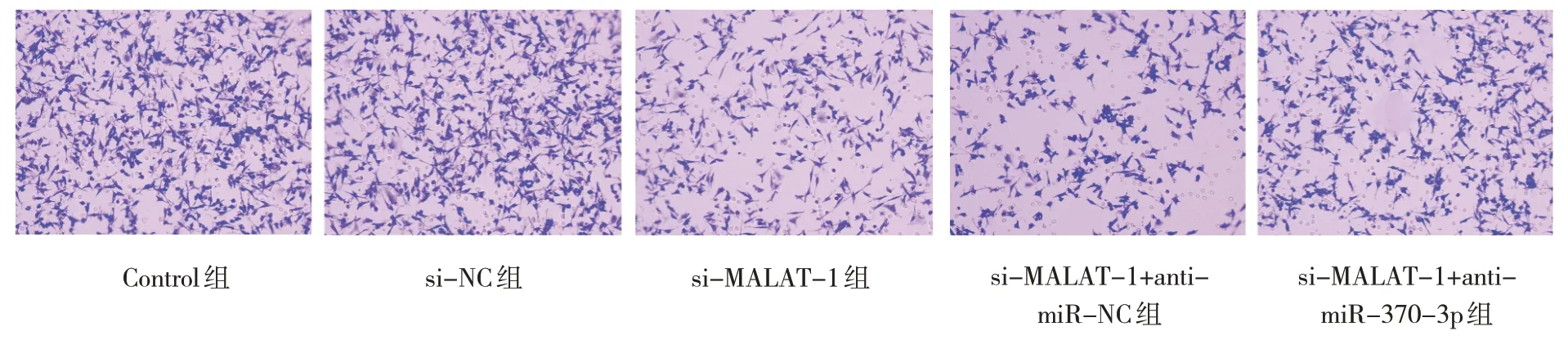
图7 各组A549细胞的侵袭情况 (结晶紫染色×200)
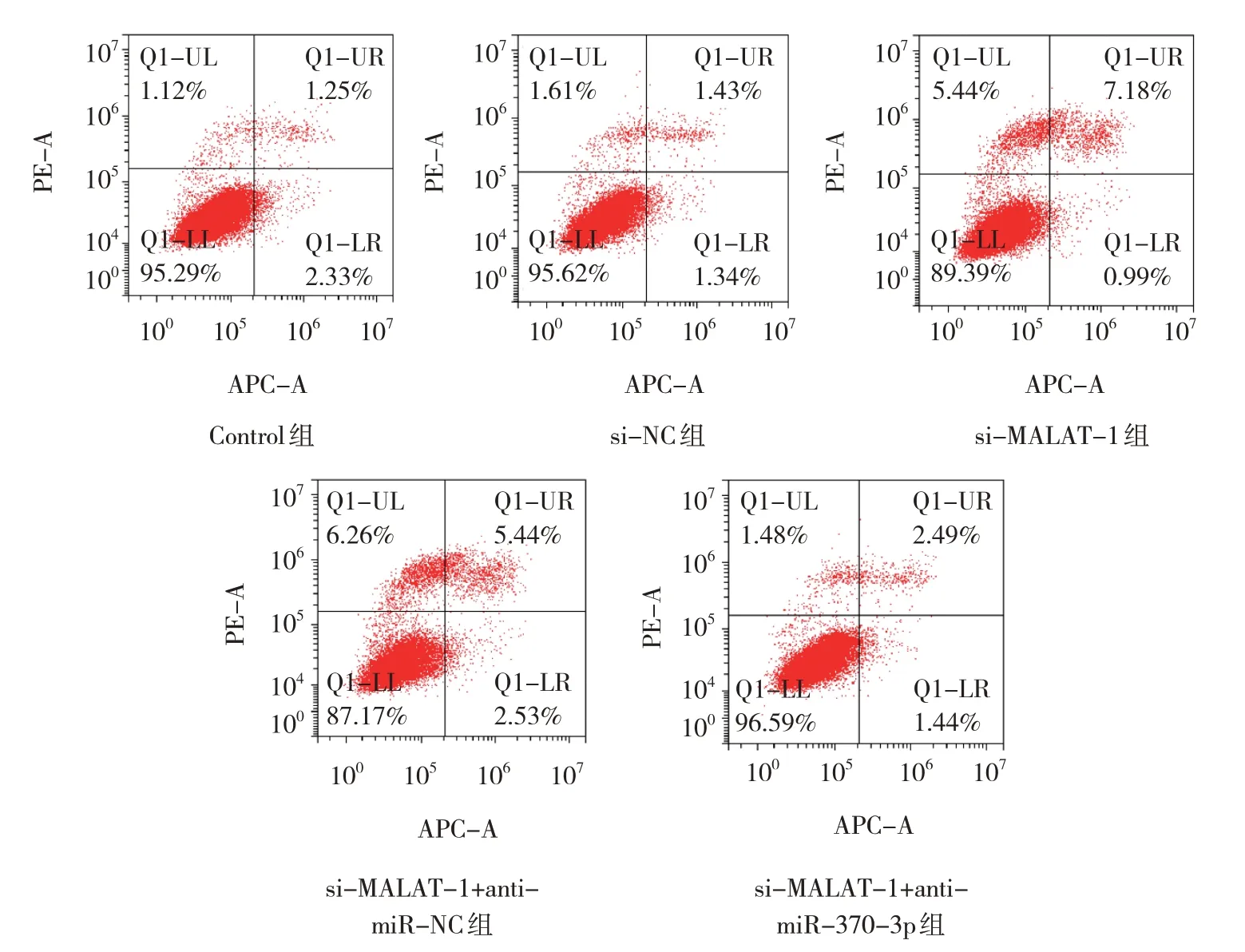
图8 各组A549细胞的凋亡情况
2.6 各组不同时间点细胞增殖活性的比较
培养24 h、48 h、72 h 后,Control 组、si-NC组、si-MALAT-1 组、si-MALAT-1+anti-miR-NC 组及si-MALAT-1+anti-miR-370-3p 组的细胞增殖活性比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞增殖活性有差异(F=8.137,P=0.027);②各组细胞增殖活性有差异(F=13.108,P=0.005);③各组细胞增殖活性变化趋势有差异(F=9.086,P=0.022)。见表6。
表6 各组不同时间点细胞活性比较 (±s)

表6 各组不同时间点细胞活性比较 (±s)
注:①与Control 组比较,P <0.05;②与si-NC 组比较,P <0.05;③与si-MALAT-1组比较,P <0.05。
组别Control组si-NC组si-MALAT-1组si-MALAT-1+antimiR-NC组si-MALAT-1+antimiR-370-3p组24 h 0.37±0.03 0.33±0.06 0.34±0.08 0.36±0.08 0.35±0.10 48 h 0.85±0.09 0.81±0.08 0.48±0.07①②0.52±0.11①②0.70±0.14①②③72 h 1.56±0.22 1.61±0.27 0.83±0.16①②0.80±0.20①②1.15±0.17①②③
2.7 各组A549细胞的Akt通路相关蛋白表达的比较
Western blotting 结果显示,Control 组、si-NC 组、si-MALAT-1 组、si-MALAT-1+anti-miR-NC 组及si-MALAT-1+anti-miR-370-3p 组的p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);与Control 组比较,si-MALAT-1组p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量降低(P<0.05)。与si-MALAT-1 组比较,si-MALAT-1+antimiR-370-3p 组的细胞p-Akt/Akt、p-PI3K/PI3K 蛋白相对表达量升高(P<0.05)。见表7 和图9。
表7 各组p-Akt/Akt、p-PI3K/PI3K蛋白相对表达量的比较 (±s)

表7 各组p-Akt/Akt、p-PI3K/PI3K蛋白相对表达量的比较 (±s)
注:①与Control 组比较,P <0.05;②与si-NC 组比较P <0.05;③与si-MALAT-1+anti-miR-370-3p组比较P <0.05。
组别Control组si-NC组si-MALAT-1组si-MALAT-1+anti-miR-NC组si-MALAT-1+anti-miR-370-3p组F 值P 值p-Akt/Akt 0.93±0.10 1.02±0.08 0.23±0.06①②0.26±0.04①②0.48±0.09①②③8.299 0.008 p-PI3K/PI3K 0.71±0.11 0.64±0.13 0.21±0.07①②0.23±0.09①②0.38±0.11①②③9.236 0.006

图9 各组A549细胞的Akt通路相关蛋白的表达
3 讨论
LncRNA 是一种非编码RNA,其长度大约为200 个核苷酸,研究[9]发现LncRNA 不仅参与人类的生长发育,还与肿瘤等多种疾病的发生、发展密切相关。肺癌是一种极其复杂的疾病,癌变过程涉及多种基因和蛋白的表达变化,这种变化不仅可以影响癌细胞的增殖和凋亡,还能影响其侵袭和迁移。越来越多的体外研究和临床研究均发现LncRNA 可以通过多通路、多水平、多机制、多联合等多种途径干预肿瘤细胞的生长、浸润、转移以及耐药性[10-12]。LncRNA-MALAT1 是一种广泛表达于真核生物的LncRNA,研究发现LncRNAMALAT1 在包括肺癌在内的多种癌症中呈高表达,被认为是一种促癌基因。非小细胞肺癌(NSCLC)是世界上发病率和病死率最高的最常见恶性肿瘤之一。张进儒等[13]经过临床研究发现LncRNAMALAT1 不仅与肺癌密切相关,其高表达还是NSCLC 不良预后的危险因素。MA 等[14]经过体外细胞培养发现A549 细胞可以高表达LncRNAMALAT1,以上研究都提示LncRNA-MALAT1 与肺癌密切相关。miR 是一种单链非编码RNA,现已有不少证据[15-16]表明LncRNA 可以通过靶向结合位点与多种miR 基因靶向结合,通过竞争性抑制降低miR 的表达,以此来调控下游靶基因的表达。但关于LncRNA-MALAT1 与miR-370-3p 之间是否存在靶向作用还不清楚。
WANG 等[17]通过体外细胞实验发现miR-370-3p参与了NSCLC 的进展,为了探究LncRNA-MALAT1、miR-370-3p 与肺癌之间的相互关系,本研究选取A549 NSCLC 细胞系进行体外实验,结果发现抑制LncRNA MALAT-1 或过表达miR-370-3p 都能抑制肺癌细胞的增殖、迁移和侵袭,同时增加癌细胞的凋亡,提示LncRNA MALAT-1 和miR-370-3p 都能影响肺癌细胞的生物学行为,这为肺癌的临床研究提供了新的靶点。但是关于LncRNA MALAT-1 和miR-370-3p之间的相互关系及具体的作用机制尚不清楚。通过靶基因预测笔者发现LncRNA MALAT-1 与miR-370-3p 存在结合位点,为了探究LncRNA MALAT-1是否对miR-370-3p 存在靶向调控作用,本研究进一步进行了荧光素酶报告基因实验,发现野生型LncRNA MALAT-1+miR-370-3p的荧光强度显著低于突变型,提示LncRNA MALAT-1 对miR-370-3p 有靶向负调控作用,RT-PCR 结果发现抑制MALAT-1 后miR-370-3p 表达显著升高,pc-DNA-MALAT-1 组miR-370-3p 表达显著下降,这进一步证实了LncRNA MALAT-1 对miR-370-3p 具有负调控作用。与单纯抑制LncRNA MALAT-1 相比,si-MALAT-1+anti-miR-370-3p 在培养48 h 和72 h 时A549 细胞的增殖以及迁移和侵袭显著升高但仍显著低于si-NC 组,si-MALAT-1+anti-miR-370-3p 组的细胞凋亡率则显著下降但仍然显著高于si-NC 组,这更加印证了MALAT-1和miR-370-3p之间的负向关系。
PI3K/Akt 信号途径(又称为Akt 通路)是一条与细胞增殖和凋亡密切相关的络氨酸激酶级联信号传导途径,多项研究[18-19]证实该途径参与肺癌的发生、发展和预后。本研究中,抑制LncRNA MALAT-1或过表达miR-370-3p 时p-Akt 和p-PI3K 表达均显著下降,但Akt 和PI3K 无显著变化,同时抑制LncRNA MALAT-1 和干扰miR-370-3p 时,p-Akt 和p-PI3K 表达均有所上升但仍显著低于单纯抑制LncRNA MALAT-1。 说明单纯沉默 LncRNA MALAT-1 或提高miR-370-3p 的表达都能抑制Akt和PI3K 的磷酸化,而沉默LncRNA MALAT-1 并干扰miR-370-3p,对Akt 和PI3K 磷酸化的抑制作用被减弱。PI3K/Akt 信号通路的磷酸化能促进恶性肿瘤的发生与发展,WU 等[20]发现可以通过调节LncRNA WT1-AS 来调控其靶向基因miR-494-3p,并最终抑制PI3K/Akt 通路的激活,起到抑制A549 和NCIH1975 细胞的增殖、迁移和侵袭作用。磷酸化的PI3K/Akt 可以下调促凋亡蛋白Bax 的表达以及抗凋亡蛋白Bcl-2 的降解,发挥抑制肿瘤细胞凋亡的作用,还可以通过激活酶激酶-3β 来加重癌细胞的侵袭和转移。
综上所述,LncRNA MALAT-1 可以与miR-370-3p 靶向结合且对miR-370-3p 的表达具有负调控作用。抑制LncRNA MALAT-1 可以上调miR-370-3p 的表达,抑制549细胞的增殖、迁移及侵袭能力,促进A549细胞的凋亡,并下调Akt通路蛋白的磷酸化。
