象皮生肌膏预处理的骨髓间充质干细胞源外泌体对人脐静脉内皮细胞血管生成的影响
2023-03-02尹园缘邹巍莹宾东华
刘 颖,尹园缘,邹巍莹,曹 晖,宾东华*
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208
伤口修复自古以来都是临床工作中的一大难题。目前,因创伤、手术、慢性疾病等所导致的皮肤伤口给患者、家庭及社会带来了生理、心理、医疗及经济等方面的沉重负担。因此,寻求有效的方法以促进伤口快速地愈合尤为重要。 新血管的生成在伤口愈合的过程中发挥重要作用[1]。 新生的血管可运送营养物质、氧气及生长因子至损伤的组织,并带走相关代谢产物,从而加速伤口愈合。 因此,刺激血管生成是促进创面愈合的有效策略。 近年来,外泌体(exosomes, Exos)作为一种无细胞疗法,避免了干细胞治疗的免疫排斥、致瘤、栓塞等缺点,以其较高的安全性及稳定性和更强大的组织再生潜能,已成为促进伤口愈合的研究热点[2]。 研究表明,间充质干细胞(mesenchymal stem cell, MSC)来源的Exos 可加速组织修复的新生血管形成和提高再生能力,对多种类型的皮肤组织损伤具有强大的修复作用[3-4]。MSC 来源的Exos 可通过携载诸多生物活性分子,作用于内皮细胞,促进其增殖、迁移和成管,从而调节血管生成过程,加速伤口的愈合[5-6]。
象皮生肌膏(Xiangpi Shengji Ointment, XPSJO)出自张山雷的《疡科纲要》,湖南中医药大学第一附属医院药物制剂中心在其原方基础上进一步化裁,并结合现代制备工艺制作成中医外科常用膏剂,具有清热解毒、活血化瘀、祛腐生肌之功效,在湖南中医药大学第一附属医院外科临床广泛应用,生肌效果显著。 已有证据表明,预处理可增强MSC 的生物学功能,增强Exos 活性,从而提高创面修复效果[7-10]。目前,XPSJO 结合Exos 的研究未见报道。 因此,本研究以血管新生为切入点,探讨经XPSJO 预处理骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)后提取的外泌体(XPSJO-Exos)对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)的影响,分析XPSJO-Exos 作为“非细胞治疗”方法在促伤口愈合治疗中的潜力,为XPSJO 促伤口愈合提供实验证据,并为临床促伤口愈合的治疗提供新思路。
1 材料
1.1 细胞
BMSC 购自广州赛业生物科技有限公司,批号:HUXMA-01001。 HUVEC 购自中国科学院细胞库。
1.2 主要药物与试剂
XPSJO 药物组成:象皮粉、生地黄、血余炭、当归、炉甘石、醋龟甲、生石膏等(湖南中医药大学第一附属医院制剂室制备,批号:20210510)。
成人BMSC 完全培养基(广州赛业生物科技有限公司,批号:HUXMA-90011);成人BMSC 无血清完全培养基(上海泽叶生物科技有限公司,批号:ZY3055A);内皮细胞培养基(湖南丰晖生物科技有限公司,批号:SC210513);CCK-8试剂盒(批号:FC101-03)、qPCR 试剂盒(批号:AQ601-24)均购自北京全式金生物技术股份有限公司;胎牛血清(批号:42F7180K)、Trypsin-EDTA(批号:25200072)均购自美国Gibco 公司;细胞上清液Exos 提取分离试剂盒(上海宇玫博医药科技有限公司,批号:UR5212);抗TSG101 抗体(批号:ab125011)、抗CD63 抗体(批号:ab134045)、抗CD9 抗体(批号:ab92726)均购自英国Abcam 公司;DAPI 染色液(上海碧云天生物技术有限公司,批号:C1005);血管内皮生长因子(vascular endothelial growth factor, VEGF)ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:ETSEL-H0026);Trizol 试剂(北京天根生化科技有限公司,批号:DF424);预混液形式的两步法RT-qPCR试剂(南京诺唯赞生物科技股份有限公司,批号:R233-01)。
1.3 主要仪器
透射电子显微镜(日本日立公司,型号:H-7650);显微镜相机(日本尼康公司,型号:DS-Fi3);激光共聚焦高内涵筛选平台(上海赛默飞世尔科技有限公司,型号:Cell Insight CX7 Pro LZR);酶标仪(美国Bio Tek 公司,型号:Elx800);酶联免疫检测仪(山东博科生物产业有限公司,型号:BK-EL10C);纳米颗粒跟踪分析仪(德国Particle Metrix 公司,型号:ZetaView);电泳仪(北京六一生物科技有限公司,型号DYY-7C);快速湿转仪(南京金斯瑞生物科技有限公司,型号:eBlotTML1);荧光定量PCR 仪(德国Eppendorf 公司,型号:Realplex2);化学发光成像系统(上海天能科技有限公司,型号:Tanon 5200);超速离心机(美国Beckman Coulter 生物科技有限公司,型号:OptimaTMXPN)。
2 方法
2.1 XPSJO 溶液的制备
取洁净的5 mL EP 管,称取1 g XPSJO,加入2 mL PBS,加热后溶解XPSJO;待药物完全溶解后,0.45 μm滤膜过滤溶解后的XPSJO,得到浓度为500 μg/mL的XPSJO 溶液,分装后置于-20 ℃冰箱内保存。
2.2 细胞的培养与预处理
BMSC 采用成人BMSC 完全培养基培养,HU VEC 采用内皮细胞培养基培养, 以上细胞均置于37 ℃、5% CO2培养箱中培养,待细胞融合度达80%时进行传代[11]。
在96 孔板中配制100 μL 的BMSC 细胞悬液4×105/mL,37 ℃培养至80%的细胞融合,更换维持培养基(2% FBS+98% DMEM),加入10 μL 不同浓度XPSJO 溶液(0、10、20、50、100、200 μg/mL),每组5 个复孔,并设空白对照孔。 24 h 后吸去培养液,DPBS 洗涤2 次,每孔加90 μL 维持培养基及10 μL CCK-8 溶液,培养2 h 后,用酶标仪测定450 nm 处的吸光度(A),确定适合的药物浓度。 细胞活力(%)=[A(加药)-A(空白)]/[A0(加药)-A(空白)]×100%。根据实验结果,在后续的实验中选用浓度为50 μg/mL 的XPSJO 溶液作为药物使用浓度。
2.3 Exos 的提取及形态观察
待BMSC 融合度到80%时,更换为无血清培养基培养,加入XPSJO 或等体积PBS,48 h 后收集细胞培养上清液。以300×g 离心10 min,2000×g 离心20 min 后,收集上清液,按照Exos 提取分离试剂盒操作说明提取BMSC 中的Exos(Exos 组)和XPSJOExos(XPSJO-Exos 组),储存于-80 ℃冰箱内,用于下一步的实验。
在孔径为2 nm 的载样铜网上滴加Exos 悬液,室温静置5 min,滤纸吸干浮液,滴加3%的磷钨酸于载样钢网上,室温下染色1 min,滤纸吸去染色液,透射电子显微镜下观察成像并拍照。
采用粒径分析仪测量Exos 的粒径。
2.4 Western blot 检测Exos 标志物蛋白CD9、CD63、TSG101 的表达
配制10%分离胶及浓缩胶,以6 μL/孔向加样孔中加入Exos 蛋白样品,80 V 电泳30 min,调整电压到100 V,溴酚蓝进入到凝胶底部后停止电泳,恒流200 mA 转膜1 h,5%脱脂奶粉封闭2 h,加一抗(TSG101、CD63、CD9),4 ℃摇床过夜,TBST 洗膜,加入二抗室温孵育1 h,TBST 洗膜,滴加ECL 发光液显色,于化学发光成像系统孵育板上曝光采集图像,Image J 软件分析灰度值。
2.5 Exos 的分离及被HUVEC 摄取观察
根据PKH67 使用说明书,采用绿色荧光染料标记Exos。 将PKH67 标记的Exos 与HUVEC 继续共培养24 h,4%多聚甲醛固定15 min,PBS 洗涤3次,滴加2 mg/mL DAPI,室温染核5 min。最后,通过激光共聚焦显微镜观察并拍照。
2.6 HUVEC 增殖、迁移及小管形成能力检测
在96 孔板中配制100 μL 的HUVEC 细胞悬液(细胞密度4×105/mL),37 ℃培养至80%的细胞融合后更换维持培养基(2% FBS+98% DMEM),每孔中加入10 μL 200 μg/mL 的Exos,并设空白对照孔(对照组),每组4 个复孔,放入培养箱中培养。 分别在24、48、72、96 h 时,吸去培养液,DPBS 洗涤细胞2 次, 每孔加90 μL 维持培养基及10 μL CCK-8溶液,继续培养2 h,用酶标仪测定450 nm 处的吸光度,即为细胞活力。
将HUVEC 接种于6 孔板, 待细胞融合达80%时,使用枪头垂直于直尺进行划痕操作,PBS 洗涤细胞3 次,加入含Exos 或不含Exos 的无血清培养基,37 ℃、5% CO2培养24 h,于0、24 h 使用光学显微镜观察并拍照。
将解冻后的基质胶与无血清培养基按1∶1 混合稀释,在预冷的24 孔板中以150 μL/孔装入混合液,置于37 ℃培养箱内30 min,使混合液凝固。 将HUVEC 细胞悬液以1.5×105个/孔接种至24 孔板,加入Exos,并设置空白对照,37 ℃恒温培养6 h,光学显微镜观察毛细血管样结构的形成并拍照。
2.7 ELISA 法检测HUVEC 的VEGF 的表达
将HUVEC 接种于6 孔板, 加入Exos 共培养,并设置空白对照孔(对照组),离心并收集各组HUVEC 细胞上清液, 按照ELISA 试剂盒使用说明,检测各组上清液中VEGF 的表达。
2.8 RT-qPCR 法检测HUVEC 的ANG1、PDGF、bFGF、EGF 表达
将HUVEC 接种于6 孔板,加入Exos 共培养,并设置空白对照孔(对照组),随后进行RNA 的检测。 采用Trizol 法提取RNA,测定RNA 的浓度后,使用预混液形式的两步法RT-qPCR 试剂对提取的RNA进行反转录,获得互补DNA。 采用SYBR 法对互补DNA 样品进行RT-qPCR 检测。 95 ℃预变性30 s;95 ℃变性10 s、60 ℃退火30 s,循环40 次。针对每个基因,设计一对引物以检测mRNA 的表达情况,并设置GAPDH 作为内参对照,引物序列见表1。 数据采用2-△△Ct法进行分析。

表1 引物序列
2.9 统计学分析
采用Graphpad Prism 8.0 统计软件进行数据分析。 数据以“±s”表示;三组间比较采用One-way ANOVA 和Turkey 检验;两组间比较采用t 检验。 以P<0.05 表示差异有统计学意义。
3 结果
3.1 XPSJO 的安全浓度
10、20、50 μg/mL 的XPSJO 与0 μg/mL 的XPSJO 间细胞活力比较,差异均无统计学意义(P>0.05)。 与0 μg/mL 的XPSJO 比较,100、200 μg/mL的XPSJO 细胞活力显著降低(P<0.01)。 在后续的实验中选用浓度50 μg/mL 作为药物使用浓度。 详见图1。

图1 不同浓度的XPSJO 对细胞活力的影响
3.2 Exos 的分离鉴定
(1)透射电子显微镜观察到Exos 组和XPSJOExos 组均有呈球形、膜结合囊泡的典型Exos 结构。 详见图2。
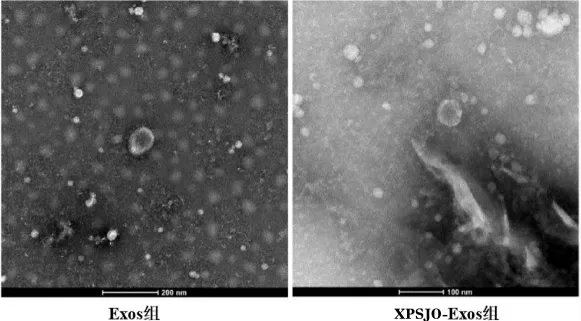
图2 电子显微镜检测Exos
(2)Western blot 检测结果表明,Exos 组和XPSJO-Exos 组均检测到Exos 标志性蛋白TSG101、CD9 和CD63 的表达。 详见图3。

图3 Exos 标记蛋白TSG101、CD9、CD63 电泳图
(3)粒径分析研究表明,大多数Exos 粒径约为120 nm。 详见图4。
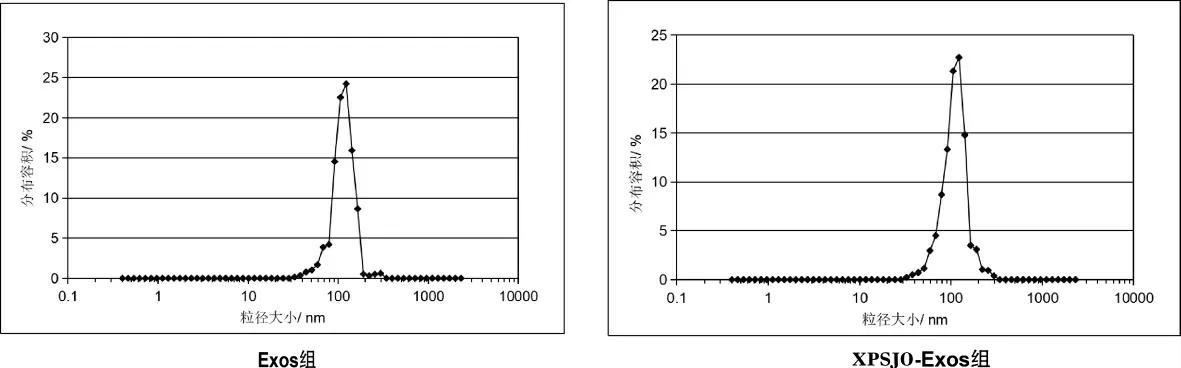
图4 Exos 粒径分析图
(4)激光共聚焦显微镜观察结果显示,成功分离到Exos,Exos 能被HUVEC 摄取, 且Exos 组和XPSJOExos 组Exos 结构、大小、吞噬性能等方面无明显差别。 详见图5。

图5 Exos 被HUVEC 摄取激光共聚焦图
3.3 Exos 对HUVEC 增殖、迁移及小管形成能力的影响
(1)与对照组比较,Exos 组和XPSJO-Exos 组在72、96 h 时细胞活力均显著增强(P<0.01)。 与Exos组比较,XPSJO-Exos 组在72、96 h 时细胞活力均显著增强(P<0.05)。 详见图6。
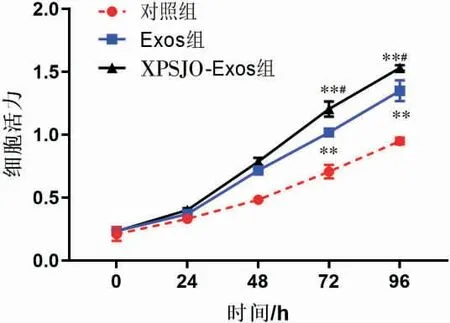
图6 CCK-8 检测细胞增殖
(2) 与对照组比较,Exos 组和XPSJO-Exos 组HUVEC 迁移率显著升高(P<0.01)。 与Exos 组 比 较,XPSJO-Exos 组HUVEC 迁移率显著升高(P<0.05)。详见图7。
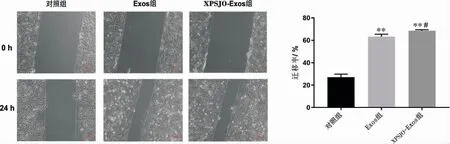
图7 划痕实验检测细胞迁移(bar=100 μm)
(3)与对照组比较,Exos 组和XPSJO-Exos 组小管数量显著增加(P<0.01)。 与Exos 组比较,XPSJOExos 组小管数量显著增加(P<0.05)。 详见图8。

图8 小管形成实验检测结果(bar=100 μm)
(4) 与对照组比较,Exos 组和XPSJO-Exos 组VEGF 浓度显著升高(P<0.01)。 与Exos 组比较,XPSJO-Exos 组VEGF 浓度显著升高(P<0.01)。详见图9。
3.4 HUVEC 的ANG1、PDGF、bFGF、EGF 的RNA相对拷贝数
与对照组比较,Exos 组和XPSJO-Exos 组bFGF、PDGF RNA 相对拷贝数下降,但差异无统计学意义(P>0.05)。 详见图9。
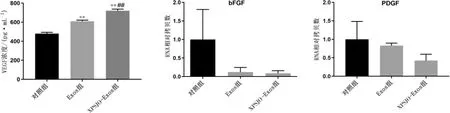
图9 各组VEGF 浓度及bFGF、PDGF RNA 相对拷贝数比较
4 讨论
伤口愈合是一个重要并且复杂的生理过程,涉及多种细胞类型及其分泌因子的相互作用[12-13]。 正常的伤口愈合包括了4 个部分重叠的阶段:稳态、炎症、增殖及重塑阶段,这些阶段紧密协助,促进皮肤伤口愈合,从而恢复皮肤的屏障保护功能[14]。由于新形成的伤口区域缺乏氧气和营养,因此,能将营养物质、氧气和生长因子输送到损伤部位的新生血管在皮肤组织再生中至关重要。尤其是对于糖尿病足等慢性伤口而言,血管功能障碍导致创面供血不足,伤口难以愈合,故新生血管的生成是促其伤口修复的关键步骤[15]。
在过去的十年里,MSC 以其自我更新、多向分化潜能和免疫调节能力等优点,广泛应用于促进和改善创面愈合,其中,以BMSC 研究最早且应用最广泛[16-17]。 但随着研究的进展,MSC 细胞治疗展现出了诸多局限及不良反应,且更多证据表明,MSC 发挥的生物学疗效主要来自于其旁分泌的产物,即Exos[18]。Exos 是粒径在30~150 nm 的细胞外囊泡,其能携带众多生物活性分子如mRNA、miRNA 和蛋白质等,发挥类似干细胞的治疗效果,并为伤口修复提供了一种潜在方式。 研究表明,MSC 来源的Exos 参与了血管形成中的多条通路,可通过传递活性因子促进血管新生,在伤口修复中发挥着重要作用[19-20]。
中医药促进伤口愈合的方面历史悠久且具有独特优势[21]。XPSJO 作为祛腐生肌的代表性药物,广泛应用于多种伤口的修复,如各类溃疡、肛肠疾病术后创面、软组织损伤等,促伤口愈合疗效显著,沿用至今已有百年余[22-30]。 XPSJO 由象皮粉、生地黄、血余炭、当归、炉甘石、醋龟甲、生石膏等药物组成。 其中象皮粉具有敛疮止血的功效;生地黄具有清热养阴生津、凉血止血的功效;血余炭具有收敛止血、化瘀的功效;当归具有补血活血、生肌止痛的功效;炉甘石具有解毒止痒、收湿敛疮的功效;龟甲具有滋阴潜阳、益肾强骨、养血补心的功效;生石膏具有解肌清热、泻火解毒的功效。诸药合用,共奏清热活血、收湿敛疮、祛腐生肌之功效。
本研究首先采用不同浓度XPSJO 预处理BMSC,通过细胞活力检测发现XPSJO 安全浓度为10、20、50 μg/mL。 而100、200 μg/mL 的XPSJO 能显著降低BMSC 的活力。对提取的Exos 形态结构、大小、吞噬性能、标志性蛋白进行检测,结果表明,XPSJOExos 和Exos 在形态结构、大小和表面标记物表达上几乎没有显著差异,证明XPSJO-Exos 被成功提取,且XPSJO-Exos 及Exos 均能被HUVEC 摄取。
通过使用物理因素、细胞因子及药物等对Exos的供体细胞进行预处理,可以提高Exos 促血管生成功能,达到更好的促伤口愈合效果。 如HU 等[9]研究证明,经吡格列酮预处理的BMSC 的Exos 在高糖的条件下通过激活PI3K/AKT/eNOS 通路增加了VEGF的表达,进一步增强了HUVEC 的血管生成能力,通过增强血管生成加速糖尿病大鼠伤口的愈合。 同样,使用阿托伐他汀钙预处理的MSC 来源的Exos 在糖尿病创面的愈合中展现了显著的促血管生成能力。 该研究证实,使用阿托伐他汀钙预处理的MSC 来源的Exos 能通过上调miR-221-3p,介导AKT/eNOS信号通路,增强HUVEC 的生物学功能,从而促进创面修复和再生[8]。 本研究结果显示:与对照组比较,Exos 组及XPSJO-Exos 组在体外能促进HUVEC 增殖、迁移及小管形成等生物学功能,且XPSJO-Exos组促进HUVEC 生物学功能的能力强于Exos 组。
血管形成是多种促血管形成因子和抑制因子相互协调作用的复杂过程,其中,VEGF 是血管生成的重要调节因子,通过促进血管内皮细胞的增殖及新生血管的形成,从而促进伤口修复[14]。本实验结果显示:XPSJO-Exos 能显著升高HUVEC 细胞上清液中VEGF 的浓度,表明XPSJO-Exos 能明显促进HUVEC分泌VEGF,从而加速血管的新生。
本次体外实验证实,XPSJO-Exos 能够增强HUVEC 促血管生成的能力,但其具体的作用机制需要更深入的研究。 同时,XPSJO-Exos 在体内实验的作用效果尚不明确,因此,后续还需进行动物实验以探讨XPSJO-Exos 对体内血管生成的影响。 此外,血管生成相关基因bFGF、PDGF 的表达呈现下降趋势,但无统计学差异(P>0.05),而EGF 和ANG1 未见表达。 该结果可能证实XPSJO-Exos 对血管生成相关基因(ANG1、PDGF、bFGF、EGF)的表达无影响。
综上所述,本研究证实XPSJO-Exos 被成功提取,其能促进HUVEC 的增殖、迁移及小管形成,并促进VEGF 的分泌。 本研究为促伤口愈合的治疗提供了新思路。
