槲皮素对自然流产小鼠模型母胎免疫耐受的影响
2023-03-02黄长盛辛兴涛贺守第
黄长盛,辛兴涛,贺守第,谭 宁*
1.华中科技大学协和深圳医院中医风湿科,广东 深圳 518000;2.河北省第八人民医院普外科,河北 石家庄 050011
自然流产(spontaneous abortion, SA)是妇科常见生殖功能障碍疾病。 据目前不完全统计,SA 的发病率为2%~4%[1],并且具有反复发作的特点。 SA 严重影响妇女的身心健康,也关系到人类种族繁衍,因此,研究其防治的方法具有较大的临床和社会意义。成功的妊娠是母体免疫系统识别和耐受胚胎的种植过程。研究发现,SA 与母胎界面免疫耐受相关,母胎界面免疫受损是导致SA 的重要环节之一[2]。 提高母胎界面的免疫耐受性是近年来治疗SA 的研究热点,研究新的药物对母胎界面的免疫耐受性的影响,是治疗SA 的重要方向。
本团队前期研究表明,补肾复方减味寿胎丸能减少SA 动物模型的流产率,菟丝子是该方最重要的药物[3]。 研究表明,槲皮素是菟丝子黄酮中具有类雌激素活性的重要成分[4],菟丝子黄酮和其主要成分槲皮素对SA 具有有效治疗作用[3],槲皮素对妊娠大鼠调节母胎界面免疫耐受的T 淋巴细胞亚群有改善作用[5],但槲皮素是否对SA 动物模型具有免疫调节作用尚未见系统研究。 地屈孕酮是一种治疗先兆流产的孕激素,可降低子宫平滑肌兴奋性,抑制子宫收缩,促进胚胎正常发育[6]。因此,本文研究槲皮素对SA 动物模型免疫调节的影响,从母胎免疫耐受调节的角度进一步阐明槲皮素治疗SA 的免疫机制。
1 材料
1.1 药物与主要试剂
槲皮素(美国Sigma 公司,批号:117-39-5);荧光 素 标 记-抗 小 鼠CD56、CD16、CD19、CD5、CD4、CD8、CD3 荧光抗体(美国Ebioscience 公司,批号:21-0125-62、24-0175-61、06-0028-13、58-0164-21、21-0125-62、12-0040-68、12-0102-18);小鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-10(interleukin-10,IL-10)、γ-干扰素(interferon-γ, IFN-γ)(北京四正柏公司,批号:BBMS7262、MS7267、MS5424);雌二醇(estradiol, E2)、孕酮(pro gesterone, P)ELISA 试剂盒(上海纪宁生物有限公司,批号:42348-14-6、60241-11-2)。
1.2 主要仪器
酶标仪(美国Thermo 公司,型号:Multiskan FC);流式细胞仪(美国BD 公司,型号:FACSCanto Ⅱ);倒置荧光显微镜(中国世纪科信公司,型号:FRD-6C)。
2 方法
2.1 实验动物
SPF 级雌性CBA/J 小鼠60 只、雄性BALB/c 小鼠4 只、雄性DBA/2 小鼠4 只,6~8 周,动物购于广东省实验动物中心,动物许可证号:SCXK(粤)2022-0063,所有小鼠均饲养于深圳大学实验动物中心,环境温度:(24±2) ℃,相对湿度:45%±5%,每日光照时间和黑夜时间均等,各12 h,自由获得水及食物,适应性饲养1 周。 所有操作均符合深圳大学实验动物伦理委员会批准,伦理审批号:2020-088。
2.2 模型制备、分组及干预方法
2∶1 比例的雌性CBA/J 与雄性BALB/c 小鼠合笼交配建立正常妊娠小鼠模型,为正常组,共6 只;2∶1 比例的雌性CBA/J 小鼠与雄性DBA/2 小鼠合笼交配建立SA 小鼠模型[5],检出阴栓者确定为妊娠第0 天。将SA 小鼠模型随机分为模型组、地屈孕酮组、低浓度槲皮素组、高浓度槲皮素组,每组6 只。 每只小鼠分别标记,采用表格记录其妊娠第0 天的时间。 从妊娠第0 天起开始灌胃,根据前期试验基础[7],低浓度槲皮素组、高浓度槲皮素组分别灌胃槲皮素300、600 mg/(kg·d)(0.5%羧甲酸纤维素钠溶液溶解),地屈孕酮组灌胃地屈孕酮3.75 mg/(kg·d)(0.5%羧甲酸纤维素钠溶液溶解),正常组及模型组灌胃等体积的0.5%羧甲酸纤维素钠溶液。 灌胃均为1 次/d,第14 天处死动物。
2.3 检测指标及方法
2.3.1 流产率统计 灌胃后第14 天解剖动物,取出子宫观察胚胎流产情况,以胚胎体积明显缩小、胎盘出现明显出血或坏死为流产,按照流产率公式计算:流产率=流产胚胎数/(流产胚胎数+正常胚胎数)×100%[8]。
2.3.2 血清学指标检测 眼球取血,置于-4 ℃冰箱静置20 min,室温,3500 r/min,离心10 min,离心半径10 cm,收集血清,根据ELISA 试剂盒说明书操作检测血清中IFN-γ、IL-10、TNF-α、E2、P 水平。
2.3.3 外周血CD3-CD56+CD16+NK 细胞、CD19+CD5+B 细胞、CD4+细胞、CD8+T 细胞比例检测 收集小鼠外周血,用淋巴分离液提取外周单个核细胞,根据流式配色方案,分别加入流式相关抗体孵育,流式细胞仪检测CD3-CD56+CD16+NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞和CD8+T 细胞比例。
2.3.4 子宫蜕膜HE 染色 分离子宫蜕膜组织,4%多聚甲醛固定过夜、不同浓度的乙醇中脱水,石蜡包埋、切片、脱蜡,HE 染液染色,光学显微镜下观察蜕膜组织情况。
2.4 统计学方法
3 结果
3.1 各组小鼠流产率比较
与正常组比较,模型组流产率升高(P<0.01);与模型组比较,高浓度槲皮素组、地屈孕酮组流产率降低(P<0.05);与地屈孕酮组比较,低浓度槲皮素组、高浓度槲皮素组流产率升高(P<0.01)。 详见表1。
表1 各组小鼠流产率比较(±s)

表1 各组小鼠流产率比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与地屈孕酮组比较,&&P<0.01。
组别正常组模型组低浓度槲皮素组高浓度槲皮素组地屈孕酮组n 6 6 6 6 6流产率/%7.71±3.12 43.43±3.18##40.12±2.32##&&35.57±4.53##*&&21.42±2.24##**
3.2 各组小鼠子宫蜕膜组织病理比较
与正常组比较,模型组的子宫蜕膜组织结构紊乱,胞浆空泡变增加,血管数量减少。与模型组比较,低浓度槲皮素组、高浓度槲皮素组、地屈孕酮组子宫蜕膜组织结构清晰,血管数量增加,组织间质水肿减少、胞浆空泡变减少。 与地屈孕酮组比较,子宫蜕膜组织结构轻度紊乱,胞浆空泡变少量增加,血管数量减少。 详见图1。
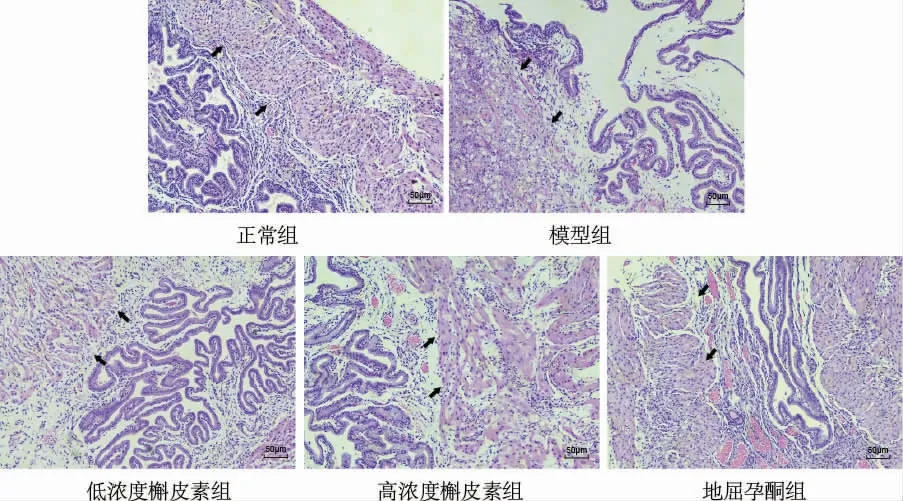
图1 各组小鼠子宫蜕膜组织病理变化(HE,×40)
3.3 各组小鼠血清IFN-γ、IL-10、TNF-α 水平比较
与正常组比较,模型组IFN-γ、TNF-α 水平明显升高,IL-10 水平明显降低(P<0.01);与模型组比较,低浓度槲皮素组、高浓度槲皮素组、地屈孕酮组的IL-10 明显升高(P<0.01),IFN-γ、TNF-α 浓度明显降低(P<0.01);与地屈孕酮组比较,低浓度槲皮素组、高浓度槲皮素组IL-10 水平明显升高(P<0.01)。详见表2。
表2 各组小鼠血清IFN-γ、IL-10、TNF-α 水平比较(±s)

表2 各组小鼠血清IFN-γ、IL-10、TNF-α 水平比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01;与地屈孕酮组比较,&&P<0.01。
组别正常组模型组低浓度槲皮素组高浓度槲皮素组地屈孕酮组n 6 6 6 6 6 IFN-γ/(pg/mL)38.67±5.51 83.33±3.21##45.33±5.86**40.01±7.81**47.12±7.81**IL-10/(pg/mL)325.33±18.58 68.21±1.36##180.67±11.92##**&&246.10±9.54##**&&137.32±11.24##**TNF-α/(pg/mL)55.56±2.65 141.24±4.58##113.67±6.66##**89.12±2.23##**92.68±4.04##**
3.4 各组小鼠血清E2、P 水平比较
与正常组比较,模型组E2、P 水平明显下降(P<0.01);与模型组比较,低浓度槲皮素组、高浓度槲皮素组、地屈孕酮组E2、P 水平明显升高(P<0.01);与地屈孕酮组比较,低浓度槲皮素组P 水平明显下降(P<0.01)。 详见表3。
表3 各组小鼠血清E2、P 水平比较(±s)
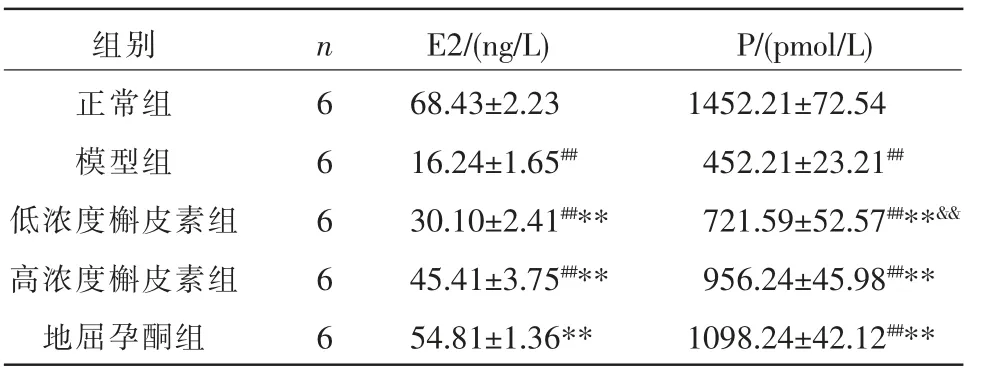
表3 各组小鼠血清E2、P 水平比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01;与地屈孕酮组比较,&&P<0.01。
组别正常组模型组低浓度槲皮素组高浓度槲皮素组地屈孕酮组P/(pmol/L)1452.21±72.54 452.21±23.21##721.59±52.57##**&&956.24±45.98##**1098.24±42.12##**n 6 6 6 6 6 E2/(ng/L)68.43±2.23 16.24±1.65##30.10±2.41##**45.41±3.75##**54.81±1.36**
3.5 各组小鼠外周血CD3-CD56+CD16+NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞、CD8+T 细胞比例比较
与正常组比较,模型组CD3-CD56+CD16+NK细胞、CD19+CD5+B 细胞、CD4+T 细胞比例明显升高(P<0.01),CD8+T 细胞明显下降(P<0.01);与模型组比较,低浓度槲皮素组、高浓度槲皮素组、地屈孕酮 组CD3-CD56+CD16+NK 细 胞、CD19+CD5+B 细胞、CD4+T 细胞比例明显下降(P<0.01),CD8+T 细胞明显升高(P<0.01);与地屈孕酮组比较,低浓度槲皮素组、高浓度槲皮素组CD8+T 细胞明显降低(P<0.01),低浓度槲皮素组CD4+T 细胞明显升高(P<0.01)。 详见表4。
表4 各组小鼠外周血CD3-CD56+CD16+NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞、CD8+T 细胞比例比较(±s,%)

表4 各组小鼠外周血CD3-CD56+CD16+NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞、CD8+T 细胞比例比较(±s,%)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01;与地屈孕酮组比较,&&P<0.01。
组别正常组模型组低浓度槲皮素组高浓度槲皮素组地屈孕酮组n 666 66 CD3-CD56+CD16+NK 细胞5.12±0.12 8.32±0.21##6.25±0.13**5.45±0.35**5.14±0.08**CD19+CD5+B 细胞15.83±0.31 27.21±0.23##22.57±0.21#**20.45±0.31#**21.85±0.12#**CD4+T 细胞45.25±0.71 56.42±0.21##49.82±0.51**&&46.62±0.24**45.85±0.32**CD8+T 细胞14.25±0.18 9.54±0.13##10.54±0.29##**&&12.32±0.42##**&&14.92±0.62**
4 讨论
SA 是妇女妊娠期最常见的并发症之一,近年研究发现,SA 与母胎界面免疫耐受损伤密切相关,子宫环境中的炎症状况在病因学中起重要作用,而炎症与免疫密切相关[3]。 从免疫学角度而言,妊娠产物与母体是半异己的同种移植物,母体免疫系统对胚胎及其抗原的识别并耐受,是妊娠的建立与维持的重要因素。当母胎界面免疫耐受下降时,免疫细胞及其炎症因子发生紊乱,引起免疫排斥反应,导致流产[9]。通过对外周血和母胎界面的研究,TRIPATHI等[10]发现母体免疫系统对胚胎的耐受性与不同免疫细胞的各种调节机制有关。 炎症免疫细胞在SA 中起着关键作用,NK 细胞、T 淋巴细胞、B 淋巴细胞等介导的细胞免疫反应在某些条件下出现免疫亢进,导致母胎界面免疫耐受低下[8]。 有文献报道,子宫内NK 细胞过度表达可导致SA 动物模型的胎儿死亡,而子宫NK 细胞的降低、TNF-α 的减少,或IL-10 的增加能改善妊娠结局[8],患有复发性SA 的女性有更高的子宫NK 细胞水平[11]。 因此,过量的子宫NK 水平或者过高的NK 细胞活性可能导致妊娠失败。 研究发现,外周血NK 细胞能反映复发性SA 妇女蜕膜NK 细胞的变化,外周血NK 细胞在全血中比值的增加对正常妊娠造成损害[12]。 NK 细胞功能的激活也是NK 细胞发挥调节功能的一个重要方面,据报道,复发性SA 妇女CD56+/IFN-γ/TNF-α 细胞比值明显高于健康妇女,但复发性SA 妇女CD56+/IL-4/IL-10 细胞的比例明显低于健康妇女[13]。CD4+T细胞和CD8+T 细胞是T 淋巴细胞的两大亚群。CD4+T 细胞是辅助性T 淋巴细胞, 能分泌细胞因子,增强T 淋巴细胞和B 淋巴细胞的增殖、分化和成熟,促进细胞免疫应答;CD8+T 细胞是细胞毒性T 淋巴细胞,具有抑制免疫应答的功能[14]。与正常分娩者相比,SA 患者的CD4+T 细胞比例显著增加,CD8+T 细胞比例显著降低,免疫细胞比率的失衡可能诱发SA,而补肾中药复方可以降低CD4+T细胞/CD8+T 细胞的比值,改善患者妊娠结局[15]。
中医学认为,肾主生殖,肾与下丘脑-垂体-卵巢轴及生殖内分泌密切相关,肾虚是SA 的根本病因。 因此,目前中药防治SA 主要以补肾填精为基本方法,包括辨证分型论治、单方验方治疗,取得了一定疗效[16]。已有研究证实,补肾中药复方可以通过调节CD4+T 细胞/CD8+T 细胞亚群比值及Th1/Th2 细胞因子比值,调节母胎界面免疫耐受,维持细胞因子稳定的内环境,从而治疗SA[17]。 槲皮素为中药菟丝子的主要有效单体之一[3]。 研究发现,槲皮素能改善SA 小鼠模型妊娠结局,其作用可能通过调节部分免疫平衡因子产生[18]。 体外实验发现槲皮素能改善人早孕蜕膜凋亡,抑制细胞早期凋亡率、Caspase-3凋亡基因表达[19]。
本研究建立了SA 动物模型,发现用槲皮素治疗,能改善SA 动物模型的流产率及蜕膜组织结构紊乱,说明槲皮素能抑制SA 的进展。 进一步实验发现,SA 动物模型外周血NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞比例上调,IL-10 水平、CD8+T 细胞比例下降,而槲皮素能通过下调外周血中的NK 细胞、CD19+CD5+B 细胞、CD4+T 细胞的比例纠正免疫紊乱。 妊娠免疫耐受的形成还与辅助性T 细胞密切相关,辅助性T 细胞具有核心调控的作用[20],研究发现,辅助性T 细胞中的亚型Th2 型细胞因子可促进滋养细胞的生长、蜕膜的形成和胚胎的发育,亚型Th1 型细胞因子可抑制滋养细胞的分化、增殖、胚胎的发育[21]。 LIM 等[22]发现,复发性SA 患者围着床期的子宫内膜中,Th1 型细胞因子明显升高,而正常妊娠妇女中Th2 型细胞因子明显升高,说明Th1 型细胞因子与复发性SA 有关,Th2 型细胞因子与正常妊娠有关。 Th1 细胞分泌TNF-α、IFN-γ[23],IL-10 为Th2细胞分泌,在SA 患者中,TNF-α/IL-10 与IFN-γ/IL-10升高,与Th1/Th2 细胞比率有关[24]。 本研究发现,模型组TNF-α、IFN-γ 水平升高,IL-10 水平下降,说明SA 模型呈Th1 优势,而槲皮素治疗后,能提高Th2 比例、改善SA 模型Th1/Th2 细胞的平衡。
综上所述,槲皮素能改善SA 动物模型的流产率及蜕膜组织结构,可能与调节NK 细胞、T 细胞、B细胞及Th1/Th2 细胞因子平衡有关。
