血清miR-199、miR-448表达与慢性乙型肝炎组织学特征以及进展为肝硬化的相关性分析
2023-03-02陈尚军梁雪松
陈尚军 蒋 蒙 张 继 谢 虎 梁雪松
1.中国人民解放军东部战区海军医院感染科 (浙江 舟山,316000) 2.海军军医大学附属长海医院感染科
慢性乙型肝炎是持续乙型肝炎病毒(HBV)感染引起的肝脏炎症性疾病,世界卫生组织报告显示2016年全球估计有2.57亿慢性HBV感染者,约887 000人死于慢性HBV感染相关疾病,其中肝硬化占52%[1],我国肝硬化患者中约77%由HBV感染所致[2]。微小核糖核酸(miRNA)是内源性非编码 RNA,在转录后调节靶基因的表达,与HBV复制、持续感染以及肝细胞损伤和肝硬化进展密切相关[3]。miR-199是与纤维化疾病相关的miRNA,通过调节caveolin-1、磷酸化激酶 B等纤维化相关分子途径参与各器官纤维化发生和进展过程[4]。上皮-间充质转化(EMT)来源的肌成纤维细胞是纤维化的关键,miR-448是与EMT相关的miRNA,通过抑制EMT降低波形蛋白和 E-钙黏蛋白表达,进而促使癌细胞凋亡,降低迁移能力[5],但是miR-448是否参与慢性乙型肝炎患者肝硬化的发生尚不清楚。本研究通过检测慢性乙型肝炎患者血清miR-199、miR-448表达,分析其与肝炎组织学特征以及进展为肝硬化的关系。
1 资料与方法
1.1 纳入及排除标准 选择2009年2月至2021年3月东部战区海军医院收治的慢性乙型肝炎患者269例,纳入标准:①经传统血清学检查,HBV病毒学和肝功能检测、腹部超声、病理学检查证实为慢性乙型肝炎,符合《慢性乙型肝炎防治指南(2015 更新版)》中诊断标准[6];②年龄18周岁以上;③入组时未出现肝硬化;④知情同意签署同意书。排除标准:①肝癌、自身免疫性肝病患者;②肝移植术后患者;③药物或酒精性肝病患者;④近期应用免疫调节剂者;⑤妊娠或哺乳期女性。本研究已经获得我院伦理委员会批准。
1.2 肝活检 入组时进行肝组织活检,患者左侧卧位,局部消毒穿刺区域,采用16 G穿刺针(美国巴德公司)取长1.5 cm的肝组织活检,5%甲醛固定,石蜡包埋切片,苏木精-伊红染色,选取6个汇管区在显微镜(奥林巴斯 BX50)下观察。采用METAVIR评分评价肝脏炎症和纤维化程度。肝脏炎症活动度分级:G0,无;G1,轻度;G2,中度;G3,中/重度;G4:重度。根据METAVIR炎症活动分级将患者分为G0~1组(68例)、G2组(104例)、G3~4组(97例)。肝纤维化分级:S0,纤维化形成;S1,轻度纤维化;S2,纤维化超过汇管区;S3,桥接纤维化;S4,肝硬化[7,8]。根据纤维化分期将患者分为S0~1组(71例)、S2组(110例)、S3组(88例)。
1.3 血清miR-199、miR-448表达检测 入组时(T0)、入组1个月(T1)、入组3个月(T2)、末次随访时(T3)采集患者静脉血3 ml,注入干燥试管后在室温下静置30 min,离心(相对离心力688×g),5 min,取上层液上机检测。取200 μl血清样本,miRNeasy提取试剂盒(美国Qiagen公司)提取总RNA,NanoDrop-2000分光光度计(美国Thermo公司)评估RNA质量,采用qScriptTMmicroDNA cDNA合成试剂盒(美国Quanta Biosciences公司)将RNA逆转为cDNA,逆转录条件:37℃ 60 min,95℃ 5 min,4℃维持。miScript SYBR Green Master Mix试剂盒(美国Qiagen公司),7500实时PCR系统(美国Applied Biosystems公司)进行定量PCR反应,应用 2-ΔΔCt方法以 GAPDH 为内源对照评估比较miR-199、miR-448相对表达量。引物序列:miR-199,正向引物为5′-GCCAAGCCCAGTGTTCAGAC-3′,反向引物为5′-GTGCAGGGTCCGAGGTATTC-3′;miR-448,正向引物为5′-GCGTTGCATATGTAGGAT-3′,反向引物为5′-CTGGTGTCGTGGAGTC-GG-3′;U6,正向引物为5′-CTCGCTTCGGCAGCACA-3′,反向引物为5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95℃ 15 min,94℃ 15 s,55℃ 30 s,70℃ 30 s,共40个循环。反应体系:Power SYBR®Green PCR Master Mix 2.5 μl,cDNA(12.5 ng)特异引物2 μl,RNase-Free ddH2O 21 μl。
1.4 随访和临床资料收集 所有慢性乙型肝炎患者出院后均定期电话随访,门诊复查,不适随诊,随访截止至2021年10月,统计随访期间乙型肝炎肝硬化发生情况。乙型肝炎肝硬化诊断标准[9]:①HBsAg阳性、或 HBsAg阴性、抗-HBc阳性且既往 HBsAg阳性>6个月,并除外其他病因;②肝脏活组织病理学提示肝硬化。③影像检查显示肝硬化和(或)门静脉高压征象;内镜检查显示食管胃底静脉曲张;肝脏硬度值测定符合肝硬化;白蛋白水平<34 g/L和(或)凝血酶原时间(PT)延长超过正常值3 s;血小板计数<100×109/L,符合①和②或者①和③中2项以上可诊断为肝硬化。收集慢性乙型肝炎患者年龄、性别、慢性乙型肝炎病程、肝硬化家族史、吸烟史、饮酒史、HBV DNA载量、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、PT、临床治疗等信息。

2 结果
2.1 慢性乙型肝炎患者不同肝组织学特征T0血清miR-199、miR-448表达比较 G3~4、S3组血清miR-199表达高于G2和G0~1组、S2和S0~1组(P<0.05),miR-448表达低于G2和G0~1组、S2和S0~1组(P<0.05);G2组、S2组血清miR-199表达高于G0~1组、S0~1组(P<0.05),miR-448表达低于G0~1组、S0~1组(P<0.05)。见表1。

表1 慢性乙型肝炎患者不同肝组织学特征T0血清miR-199、miR-448表达比较
2.2 肝炎组、肝硬化组血清miR-199、miR-448表达比较 中位随访51(7~152)个月,截止末次共失访14例,余255例慢性乙型肝炎患者中121例发生乙型肝炎肝硬化(肝硬化组),134例未发生乙型肝炎肝硬化(肝炎组)。肝炎组、肝硬化组T0、T1、T2、T3血清miR-199、miR-448表达变化差异具有统计学意义(F组间=623.475、532.168,P<0.05),两组患者血清miR-199表达呈持续增高趋势,miR-448表达呈持续降低趋势(F时间=135.241、205.124,P<0.05),两组间存在交互效应(F交互=152.427、172.414,P<0.05)。肝硬化组患者T0、T1、T2、T3血清miR-199表达高于肝炎组(P<0.05),miR-448表达低于肝炎组(P<0.05)。见表2。

表2 肝炎组、肝硬化组血清miR-199、miR-448表达比较
2.3 慢性乙型肝炎进展为肝硬化的影响因素分析 肝炎组和肝硬化组患者单因素分析结果见表3。以是否发生乙型肝炎肝硬化为因变量(赋值:0=否,1=是),饮酒史(赋值:0=否,1=是)、肝硬化家族史(赋值:0=否,1=是)、乙型肝炎病程、ALT、AST、PT、白蛋白、血小板计数、HBV DNA载量、T3血清miR-199、T3血清miR-448为自变量,向后逐步法排除无关变量(入α=0.05,出α=0.10),最终ALT、HBV DNA载量、T3血清miR-199、T3血清miR-448与慢性乙型肝炎进展为肝硬化有关(P<0.05)。见表4。

表3 慢性乙型肝炎进展为肝硬化的单因素分析
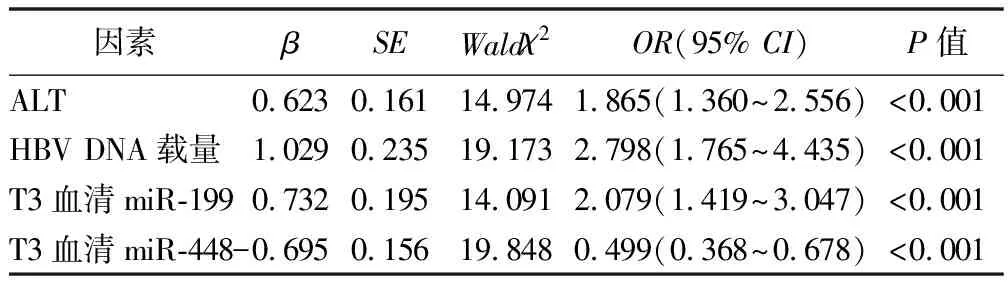
表4 慢性乙型肝炎进展为肝硬化的Logistic回归方程
2.4 T3血清miR-199、miR-448诊断慢性乙型肝炎进展为肝硬化的价值分析 T3血清miR-199、miR-448诊断慢性乙型肝炎进展为肝硬化的截断值为2.11、1.09,曲线下面积为0.742、0.765,联合T3血清miR-199、miR-448(取各自截断值)诊断慢性乙型肝炎进展为肝硬化的曲线下面积为0.924,高于单独T3血清miR-199、miR-448(z=6.249、5.781,P<0.05)。见表5和图1。

表5 T3血清miR-199、miR-448诊断慢性乙型肝炎进展为肝硬化的效能
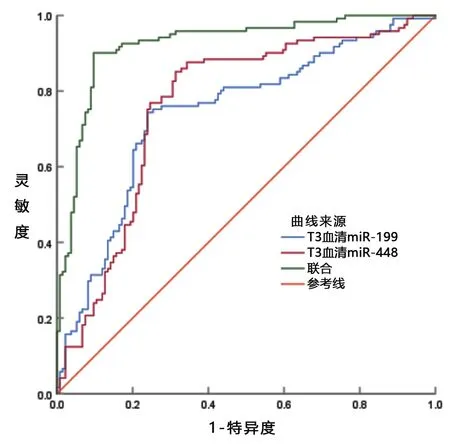
图1 T3血清miR-199、miR-448诊断慢性乙型肝炎进展为肝硬化的ROC图
3 讨论
HBV持续感染可导致肝组织炎症反应,引起肝星状细胞和成纤维细胞合成大量胶原蛋白并在肝实质内沉积。在病毒性肝炎中,过度肝纤维化通常发生在门静脉束内,这与持续的门静脉炎症有关,随着门静脉周围纤维化的发展,出现桥接纤维化并跨越肝小叶,逐渐延伸到肝实质内,导致肝硬化的发生。慢性乙型肝炎进展为肝硬化受多种因素影响,包括年龄较大、男性、慢性活动性肝炎、ALT水平较高、失代偿史、基因变异等[10]。表观遗传在慢性乙型肝炎进展为肝硬化的机制中发挥重要作用,miRNA在多种细胞过程中发挥重要作用,包括病毒-宿主的相互作用,部分miRNA通过与HBV转录调节基因相互作用调节病毒复制和持续感染[3],在肝纤维化进展和肝硬化过程中,miRNA通过调节多种细胞通路参与胶原蛋白在细胞外基质过度和持续积累过程,与肝硬化的发生密切相关[11]。
miR-199家族是负责细胞外基质沉积和促纤维化细胞因子释放的小非编码 RNA,包括3个成员,分别是miR-199a1、miR-199a2和miR-199b[12]。miR-199与纤维化疾病密切相关,现有报道显示在肾间质纤维化模型中miR-199a-3p表达增加,miR-199a-3p通过抑制其靶基因细胞因子信号传导抑制蛋白7表达,激活信号转导子和转录激活子3,增加转化生长因子(TGF)-β1诱导的Ⅰ型胶原蛋白和波形蛋白表达,促使肾间质纤维化进程[13]。Lino等[14]在单侧输尿管梗阻诱导的肾纤维化小鼠模型以及胆管结扎和四氯化碳诱导的肝纤维化小鼠模型中也观察到miR-199a-5p表达增加,miR-199a-5p在TGFβ诱导下表达上调,并促进成纤维细胞激活,增殖、迁移、侵袭和分化为肌成纤维细胞,发挥促纤维化作用。miR-199-5p被认为是口腔黏膜下纤维化关键miRNA,其表达上调可促使胶原蛋白Ⅰ、Ⅲ表达,引起口腔纤维细胞增殖,导致口腔黏膜下纤维化发生和进展[15]。本研究显示慢性乙型肝炎患者基线血清miR-199表达随着肝脏炎症分级和纤维化分期的增加而增高,通过随访发现,肝硬化组患者T0、T1、T2、T3血清miR-199表达均高于肝炎组,表明miR-199与肝炎症活动增强,肝纤维化进展和肝硬化的发生有关,推测miR-199在慢性乙肝肝炎进展为肝硬化过程中可能发挥促肝硬化作用。回归分析结果显示miR-199过表达是慢性乙肝肝炎合并肝硬化的危险因素,证实了miR-199过表达与慢性乙肝肝炎发生肝硬化的因果关系,验证了上述推测。Bi等[16]报道显示miR-199靶向角质形成细胞生长因子(KGF)mRNA 的 3'-UTR以抑制KGF蛋白质翻译,降低KGF表达,促使肝纤维化,沉默miR-199后可激活KGF逆转纤维化进程,该结果也说明miR-199在肝纤维化发病机制中发挥促纤维化作用,支持本研究结论。
肌成纤维细胞是纤维化的关键细胞介质,肌成纤维细胞激活可生成大量胶原蛋白,并在细胞外基质中沉积,导致组织过度生长、硬化。肌成纤维细胞主要来源于间充质细胞、上皮细胞和内皮细胞,其激活需要EMT。EMT是上皮细胞逐渐转变为间充质样细胞并失去其上皮功能和特征的过程,正常EMT可促使细胞外基质沉积,形成新的上皮组织,促使伤口愈合,但EMT异常可引起上皮细胞持续转变为肌成纤维细胞,导致纤维化的发生[17]。miR-448是一种抑癌基因,广泛参与细胞过程,包括增殖、凋亡、侵袭和EMT过程,在乳腺癌、肝细胞癌和结肠直肠癌等多种恶性肿瘤中表达下调,研究显示miR-448表达缺失可促使EMT,导致癌细胞侵袭和迁移[18],miR-448过表达可下调波形蛋白,抑制癌细胞的EMT,抑制细胞增殖、迁移和侵袭[19]。本研究发现miR-448与慢性乙型肝炎合并肝硬化也存在密切关系,肝硬化组患者血清miR-448表达明显低于肝炎组,且血清miR-448表达随着肝脏炎症分级和纤维化分期的增加而降低,说明miR-448表达缺失可能诱导和加重慢性乙型肝炎患者肝硬化过程。Xu等[20]发现miR-448可靶向下调ABC转运蛋白超家族的C亚家族3,抑制Jun N 末端激酶信号通路,促使肺成纤维细胞增殖减少,凋亡增加,逆转肺纤维化进程。Yang等[21]报道显示miR-448-5p缺失可上调正弦同源框同源物1(Six1)表达,导致TGF-β1表达上调,进而促使支气管上皮细EMT和肺纤维化。以上结果提示miR-448表达异常与纤维化疾病发生有关,但miR-448通过何种机制参与慢性乙型肝炎患者肝硬化过程尚不清楚,已知TGF-β是一种主要的促纤维化细胞因子,其信号通路激活通过Smad信号通路诱导内皮细胞的间充质转化,促使肝纤维化[22],miR-448可通过靶向调控其下游信号传导抑制TGF-β表达[23],阻止肌成纤维细胞激活和胶原蛋白产生,逆转肝纤维化进程和肝硬化的发生,而miR-448表达缺失则促使肝硬化发生。
ROC分析结果显示T3血清miR-199、miR-448诊断慢性乙型肝炎合并肝硬化的曲线下面积为,表明miR-199、miR-448具有较高的价值,联合两项指标后其诊断效能明显提高,提示同时检测血清miR-199、miR-448表达,可为临床诊断提供更准确的信息。Khairy等[24]报道显示丙型肝炎病毒感染肝炎患者纤维化晚期血清miR-199表达显著上调,miR-448表达显著下调,miR-199和 miR-448可作为评估肝纤维化进展的非侵入性生物标志物。
综上,乙型肝炎肝硬化患者血清miR-199高表达,miR-448低表达与慢性乙型肝炎患者炎症分级、肝硬化分期以及进展为肝硬化均有关,可作为慢性乙型肝炎进展为肝硬化评估的指标。
