2-羟基-3-甲基蒽醌诱导结肠癌细胞凋亡机制的研究
2023-03-02陈小燕吴应强
陈小燕,吴应强,朱 蓉,赵 逵
结肠癌的发病率和死亡率较高、预后差[1-2],临床治疗以手术、化学为主,但放化疗的毒副作用较强。中医学认为大肠癌以脾肾亏虚为本虚,以热毒、瘀血、湿热为标实[3],临床上常以清热解毒、活血化瘀、消肿散结等中药用于治疗大肠癌[4],其副作用较少。前期研究结果证实白花蛇舌草对结肠癌可抑制细胞生长和诱导细胞凋亡[5-6],但对其内在成分分析和作用机制研究较少。2-羟基-3-甲基蒽醌(2-hydroxy-3-ethylanthraquinone, HMA)为白花蛇舌草中提取出的一种蒽醌类化合物,研究表明该化合物对白血病、肝癌、卵巢癌、乳腺癌、肺癌等多种肿瘤具有明显增殖抑制作用及诱导凋亡作用[7-8],但关于其抗肿瘤的机制,尤其在结肠癌研究较少。因此,该研究通过TCMSP等数据库预测HMA调控的靶基因,体外细胞实验研究HMA对结肠癌细胞株增殖和凋亡的影响并分析及可能的机制,为临床研究提供一定的实验室依据和理论基础。
1 材料与方法
1.1 细胞人结肠癌细胞株HCT-116和HT-29购自中国科学院细胞库。
1.2 主要试剂HMA(上海源叶生物科技有限公司)、胎牛血清(FBS)(美国Thermo Fisher Scientific公司);McCoy′s 5A培养基(江苏凯基生物有限公司);青链霉素混合液和磷酸盐缓冲液(美国Hyclone公司);Caspase-9、Caspase-3、Bax、Bcl-2一抗,羊抗兔二抗(美国CST 公司);CCK-8试剂盒和Annexin V-FITC细胞凋亡检测试剂盒(武汉Abbkine公司);RIPA裂解液、PMSF、封闭液、ECL显影剂(北京索莱宝有限公司)。
1.3 主要仪器CO2培养箱、超净工作台(美国Thermo Fisher Scientific公司);酶标仪(美国BioTek公司);Countstar全自动细胞计数仪(美国Countstar公司)流式细胞分析仪(美国BD公司);离心机(美国Eppendorf公司);电泳系统、凝胶成像系统(美国Bio-Rad公司)。
1.4 方法
1.4.1HMA靶点分析 采用中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform, TCMSP, https://tcmspw.com/tcmsp.php)[6]研究HMA可能的靶点信息。在“Chemical name”下检索关键词“2-hydroxy-3-methylanthraquinone”,得到该化合物的相关信息和可能的靶点信息。
1.4.2细胞培养 将HCT116和HT-29细胞分别培养在含有10%FBS的McCoy′s 5A 培养基中,37 ℃、5% CO2培养箱中培养,细胞贴壁生长至融合80%~90%时,胰酶消化传代。
1.4.3药物制备 HMA加入适当DMSO震荡混匀配置成终浓度为200 μmol/L的母液,超声助溶30 min,使粉末充分溶解后分装并-20 ℃保存。在细胞加药时用完全培养基稀释成工作浓度,即为0、25、50、100 μmol/L;0 μmol/L HMA溶液为不加HMA的纯溶剂(DMSO)溶液。
1.4.4CCK-8检测细胞活力 人结肠癌细胞在培养瓶中培养至对数生长期,以3×104个/ml接种于96孔板,过夜培养后,加入不同浓度(0、25、50、100 μmol/L)的HMA,干预48 h后每孔10 μl的CCK-8溶液混匀,培养箱避光孵育2 h,于450 nm波长测定吸光度值。计算HMA对结肠癌细胞的活力,细胞存活率(%)=(实验组吸光度均值/对照组吸光度均值)×100%。
1.4.5台盼蓝染色细胞计数检测细胞生长能力 取对数生长期细胞,以1×105/ml细胞接种于12孔板,过夜培养后分别加入不同浓度(0、25、50、100 μmol/L)的HMA药物干预,培养48 h后消化收集细胞,重悬混匀细胞后与0.2%台盼蓝等体积混合,加入计数板中,Countstar全自动细胞计数仪分析细胞总数。
1.4.6集落形成检测细胞存活能力 取对数生长期细胞,以2×105/ml细胞接种于6孔板,过夜培养后分别加入不同浓度(0、25、50、100 μmol/L)的HMA药物干预,培养48 h后消化细胞,以500个/孔接种于12孔板中,连续培养8~12 d,每隔3 d换1次液,待肉眼看到集落时终止实验,结晶紫染色观察细胞集落形成情况,集落形成率(%)=(实验组吸光度均值/对照组吸光度均值)×100%。
1.4.7Annexin V/PI双染法检测细胞凋亡 取对数生长期细胞,过夜培养后加入不同浓度(0、25、50、100 μmol/L)的HMA药物干预,48 h后收集细胞,PBS洗细胞2次,用1×Annexin-binding buffer重悬细胞,将细胞浓度调整为1×106个/ml,每100 μl细胞悬液加入5 μl AnnexinV-FITC和5 μl碘化丙啶(PI)混匀,室温避光反应30 min,流式细胞仪上机检测,实验结果采用ModfitLT version 3.0软件依据在各个时期的DNA含量进行分析,每个样本至少计数10 000个细胞。
1.4.8Western blot实验检测凋亡相关蛋白的表达 按照上述方式HMA干预后收集细胞,PBS洗涤后加入含PMSF裂解液,低温高速离心后吸取上清液即为所需蛋白。BCA测定蛋白浓度后加入50 μg蛋白量上样电泳,将胶上蛋白转入PVDF膜后室温封闭1 h,加入不同抗体(1 ∶1 000)4 ℃过夜孵育。经TBST清洗后加入对应二抗(1 ∶5 000)室温孵育1 h,经TBST洗膜后化学发光显影拍照。

2 结果
2.1 HMA基本信息TCMSP数据库中检索可得,HMA的分子式为C15H10O3,分子量:238.25,结构式见图1,主要存在于白花蛇舌草、半枝莲、巴戟天三种植物中,并获得32个靶基因,结果如表1所示。其中包含Caspase-3等凋亡相关基因。

图1 HMA化学结构式
2.2 HMA对结肠癌细胞生长的影响为了确定HMA对细胞增殖的影响,本研究采用细胞计数和CCK-8方法检测HMA对结肠癌细胞活力的影响。CCK-8结果显示,与对照组(0 μmol/L)相比,不同浓度的HMA对HCT116(图2A)和HT-29(图2B)细胞活性具有明显的抑制作用,差异有统计学意义(P<0.05)。台盼蓝染色计数结果显示,与对照组(0 μmol/L)相比,不同浓度的HMA干预HCT116(图3A)和HT-29(图3B)结肠癌细胞后,细胞数量明显减少,差异有统计学意义(P<0.05)。表明HMA可抑制HCT116和HT-29细胞的生长。
2.3 HMA对结肠癌细胞存活能力的影响为了进一步验证HMA对细胞增殖的影响,采用集落形成探讨HMA对HCT116和HT-29细胞存活能力的影响。实验结果显示,在HCT116细胞中(图4A),与对照组(0 μmol/L)细胞集落形成率相比,25、50、100 μmol/L HMA干预组细胞集落形成率明显降低,差异有统计学意义(F=38.894,P<0.05);在HT-29细胞中(图4B),与对照组(0 μmol/L)细胞集落形成率相比,25、50、100 μmol/L HMA干预组细胞集落形成率亦呈减少趋势,差异有统计学意义(F=12.886,P<0.05),说明HMA可抑制结肠癌细胞的存活能力,进一步证实了HMA抑制结肠癌细胞的增殖。

表1 HMA潜在靶基因信息
2.4 HMA对结肠癌细胞凋亡的影响为了进一步探讨HMA对大肠癌细胞凋亡的影响,采用Annexin V/PI双染法检测HMA对HCT116和HT-29细胞凋亡情况。实验结果显示(图5):在HCT116细胞中(图5A),与对照组(0 μmol/L)细胞凋亡率相比,25、50、100 μmol/L HMA干预组细胞凋亡率明显提高,差异有统计学意义(F=29.122,P<0.05);在HT-29细胞中(图5B),与对照组(0 μmol/L)细胞凋亡率相比,25、50、100 μmol/L HMA干预组细胞凋亡率亦有所升高,差异有统计学意义(F=15.779,P<0.05),说明不同浓度的HMA可诱导细胞凋亡。
2.5 HMA对结肠癌细胞凋亡相关蛋白的影响Western blot结果显示:与对照组比较,不同浓度的HMA干预大肠癌HCT116(图6A)和HT-29(图6B)细胞后可明显升高活化形式的cleaved Caspase-9和cleaved Caspase-3、Bax的蛋白表达,同时降低Bcl-2的蛋白表达。
3 讨论
结肠癌是我国最常见恶性肿瘤,其发病率和病死率均居消化系统恶性肿瘤第一位,其发生发展是一个涉及多基因、多步骤的癌变过程。结肠癌早期症状不明显,诊断困难,临床确诊时患者已处于中晚期,错失最佳治疗时机。尽管手术治疗仍为结肠癌的首选方案,但对于中晚期结肠癌患者来说,不适宜手术治疗,常以放化疗或临床药物控制,但存在靶点单一、途径单一和不同程度的毒副作用,影响患者的生存质量和预后。
本课题采用台盼蓝染色法、CCK-8法和集落形成实验检测不同浓度HMA药物对结肠癌HCT116和HT-29细胞的生长和存活能力,实验结果表明不同浓度(25、50、100 μmol/L)的HMA均能明显抑制结肠癌HCT116和HT-29细胞的生长,且对HCT116细胞的抑制效果更显著。白花蛇舌草有名二叶葎、白花十字草、尖刀草,属茜草科耳草属1年生披散草本植物。该药最早记载于《广西中药志》,其味苦、甘,性寒,归肺、胃、大肠、小肠经,全草皆可入药,内服外用均可。传统中医药理论认为本品苦寒清泄,甘寒渗利,具有清热解毒、消痛散结、利尿除湿之功效,可用于治疗痈肿疮毒、咽喉肿痛、毒蛇咬伤、热淋涩痛及癌肿等症状。现代药理研究发现,白花蛇舌草具有抗肿瘤、调节免疫、抗感染以及抗氧化等药理活性。近年来,百花蛇舌草在多种人类恶性肿瘤中应用广泛,研究报道白花蛇舌草、半枝莲等清热解毒类中药临床常用于肿瘤、热症等疾病治疗[9],在体内外实验均证实对大肠癌生长、转移等具有明显的抑制作用[10]。HMA为一种蒽醌类活性成分,存在于中药白花蛇舌草、半枝莲等中草药。研究[11]报道表明HMA对白血病、卵巢癌、乳腺癌、肺癌、肝癌等多种肿瘤细胞具有明显的增殖抑制作用,但在结肠中抗癌机制较少。本研究结果初步表明,HMA对结肠癌细胞增殖具有抑制作用。

图2 不同浓度HMA对HCT116(A)和HT-29(B)细胞活力的影响

图3 不同浓度HMA对HCT116(A)和HT-29(B)细胞数的影响
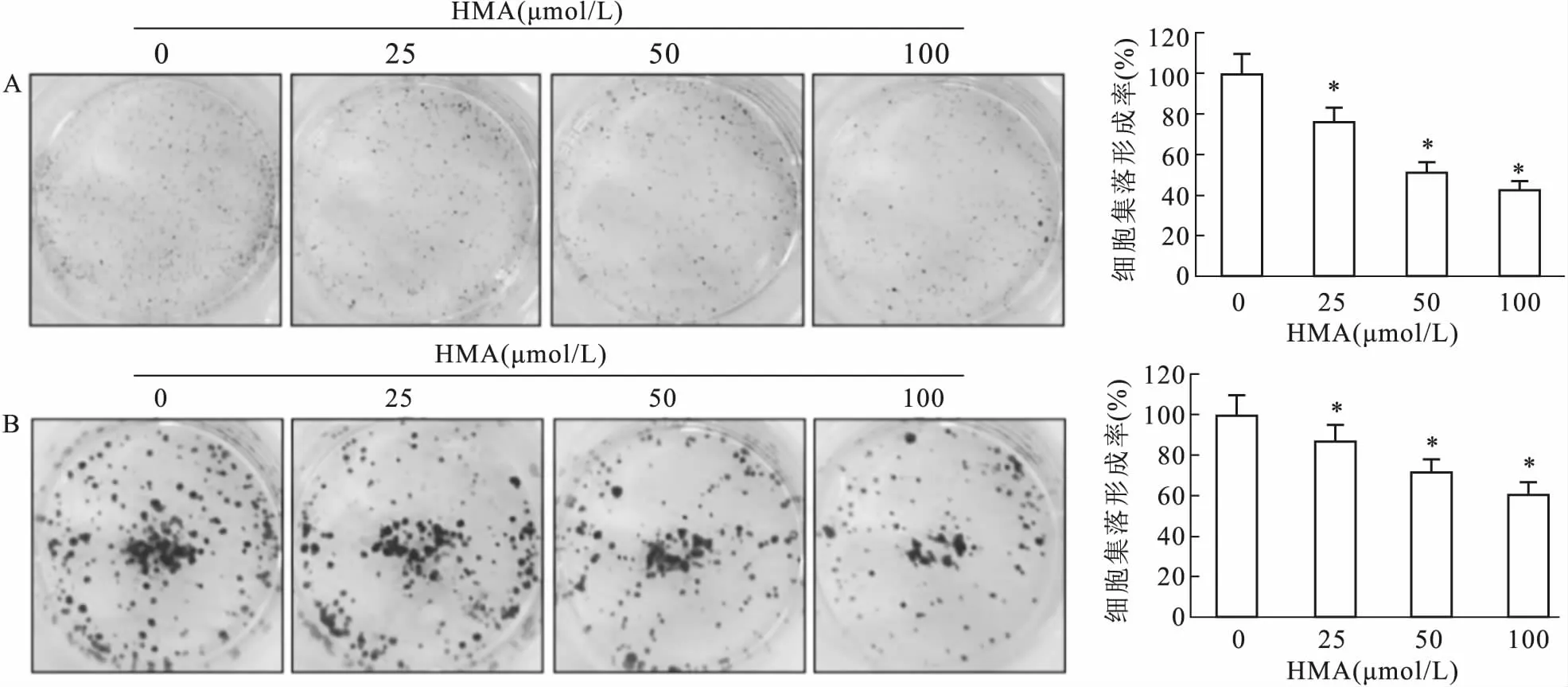
图4 不同浓度HMA对HCT116(A)和HT-29(B)细胞集落形成的影响

图5 不同浓度HMA对HCT116(A)和HT-29(B)细胞凋亡的影响
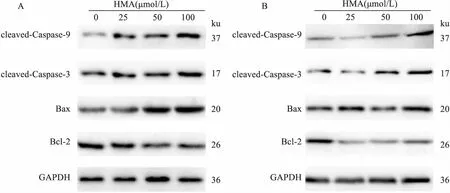
图6 不同浓度HMA对HCT116(A)和HT-29(B)细胞凋亡相关蛋白表达的影响
细胞凋亡是机体常见的正常生理过程,是生物体细胞在特定信号诱导下、凋亡相关基因调控下发生的一种程序性死亡过程,作用机制极为复杂[12]。细胞凋亡与半胱氨酸蛋白酶(Caspase)的激活有关,对大部分肿瘤都有实际意义。其中Caspase-9是位于凋亡级联效应的上游的主要凋亡启动因子,Caspase-3位于Caspases级联反应的下游,被认为是Caspase家族成员中最重要的凋亡执行者,激活后可以诱导细胞凋亡[13]。本研究采用Annexin V/PI双染法分析不同浓度的HMA对结肠癌HCT116和HT-29细胞凋亡情况,并通过WB法检测HMA对凋亡相关蛋白表达的影响。分析结果显示,不同浓度的HMA可以诱导结肠癌细胞凋亡,且呈浓度依赖性;同时HMA可明显升高活化形式的cleaved Caspase-9和cleaved Caspase-3、Bax的蛋白表达,同时降低Bcl-2的蛋白表达。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是细胞增殖和凋亡的重要调控蛋白,两者共同形成一个凋亡调节系统,Bcl-2 通过与Bax 竞争结合形成异源二聚体从而抑制或促进细胞凋亡[14]。Caspases是一个在细胞凋亡中起关键作用的酶家族,又被称凋亡蛋白酶,执行细胞凋亡效应主要是通过凋亡效应因子Caspase-3蛋白活化而实现的,同时Caspase-3的活化又主要依靠凋亡启动因子Caspase-9的激活。Bcl-2属原癌基因,定位于线粒体膜上,高表达的Bcl-2可抑制细胞凋亡。Bax主要定位于细胞质,当受到凋亡信号刺激时,从细胞质迁移至线粒体外膜,并发生构象变化、寡聚化,介导下游凋亡分子释放,从而引发细胞凋亡。既往研究显示[15],白花蛇舌草有效成分HMA有效抑制人肝癌HepG2细胞增殖,上调促凋亡基因Bax、Caspase-9 mRNA表达,诱导细胞凋亡。本研究结果说明HMA能以剂量依赖性诱导HCT116 和HT-29细胞凋亡,可能是通过下调Bcl-2的表达,上调Bax表达,并活化Caspase-9和Caspase-3的表达水平。从而促进结肠癌细胞凋亡。
综上所述,本研究证实HMA对结肠癌细胞株HCT116和HT-29细胞具有抑制生长和诱导凋亡的作用,可能是通过调控Bcl-2和Bax等相关凋亡蛋白的表达,但仍存在一定局限性,仍有待进一步采用RNA测序等组学技术开展更深入的机制研究。
