人参皂苷Rb1改善局灶性CIRI小鼠模型神经损伤的调控机制研究
2023-03-02龙婷婷朱俊德
周 璐,陈 珊,赵 雪,龙婷婷,朱俊德
根据2020年中国卒中报告,2019年我国新发卒中394万例,其中缺血性卒中287万例,约占卒中患者的72.84%[1]。它是一种高致残、高死亡率的疾病,严重危害人类的健康。脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是脑组织缺血后,恢复血液供应时诱发的功能障碍加重的现象,减轻CIRI的损伤对改善脑缺血卒中的治疗有极大作用。此外,由CIRI导致的迟发性神经损伤会严重影响患者预后和神经功能的恢复。Wnt信号通路与增殖、凋亡、迁移和分化等多种生理病理过程密切相关。当Wnt通路激活时,GSK-3β功能和β-catenin降解受到抑制,β-catenin大量聚集并进入细胞核内,启动下游基因的转录与翻译,发挥调控细胞代谢的功能[2-3]。研究[4-6]表明,经典的Wnt/β-catenin信号通路可以在整个生命周期中维持血脑屏障特征。
1 材料与方法
1.1 实验动物60只C 57/BL小鼠(5~8周龄,20~25 g)由重庆恩斯维尔生物科技有限公司提供。小鼠的饲养环境为(25±1) ℃,12 h光照/12 h黑暗循环,自由进食和饮水。动物实验方案经贵州医科大学伦理委员会批准(No.2200094),并严格按照其指导方针进行。
小鼠随机分为6组,每组10只,即假手术组、CIRI模型组、人参皂苷Rb1低剂量组、人参皂苷Rb1中剂量组、人参皂苷Rb1高剂量组和尼莫地平(阳性对照)组。假手术组:行假手术,腹腔注射生理盐水。CIRI模型组:缺血手术,再灌注前10 min予腹腔注射生理盐水。人参皂苷Rb1低、中、高剂量组和阳性药物组:缺血手术后,再灌注前10 min分别腹腔注射人参皂苷Rb1 20、40、80 mg/kg和尼莫地平1 mg/kg。
1.2 局灶性脑缺血再灌注损伤模型制备小鼠适应性饲养1周后,进行大脑中动脉闭塞手术。麻醉后,显露左颈总动脉并使用动脉夹夹住。在手术过程中,使用手术台上的加热垫将体温保持在36.5~37.0 ℃。切口区域用聚维酮碘溶液消毒。分离并结扎颈外动脉。将带有钝头(直径0.35 mm)的尼龙缝线拉入颈外动脉,然后拉入颈内动脉。大脑中动脉被颈动脉分叉远侧18 mm处的缝线阻塞。缺血再灌注损伤通过在闭塞2 h后去除缝合线来执行。在切口闭合后,将小鼠放回笼子,并提供食物和水。
1.3 试剂与仪器人参皂苷Rb1购自北京索莱宝生物科技有限公司;生物素标记的人参皂苷Rb1从Isolife公司(芬兰)购买;RNAiso Plus裂解液购自Takara公司;反转录试剂盒购自北京擎科生物科技有限公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术公司;糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、Wnt3a、Wnt1、β-连锁蛋白(β-catenin)、β-actin以及辣根过氧化物酶偶联二抗抗体均购自武汉爱博泰克生物科技有限公司(Abclonal); Mshot MF53显微镜(广州市明美光电技术有限公司);BioRad成像系统(美国BioRad公司)。
1.4 神经功能评分动物造模手术24 h后,按照MasaoShmiizu-Sasamata的方法对所有小鼠进行神经行为评分,评分标准包括:① 自主活动的程度,② 左前肢偏瘫,③ 提尾时左前肢伸不直,④ 抗侧推能力,⑤ 向左倾斜度,⑥ 向左环形度,⑦ 对触须的反应。以上指标无异常为0分,中等异常为1分,严重异常为2分;各项评分相加,总分为0~14分[7]。
1.5 行为学测试利用平衡木实验、Y迷宫实验和悬尾实验对小鼠的行为学能力进行测试。平衡木实验方法:将小鼠放置于方形平衡木(长1 m,宽14 mm)一侧,另一侧放方形木盒,记录小鼠60 s内通过平衡木时间。训练2次,第3次正式实验。未能达到另一侧或超过60 s均记录为60 s。Y迷宫实验方法:由三个支臂和一个连接区组成,三臂相互夹角为120°,每臂末部铺以食物槽,用以盛放食物。各臂可依次分为起步区、错误臂以及正确臂。通过训练后记录240 s内进入各臂时间,统计正确臂时间。悬尾实验方法:提起小鼠尾部固定,使头向下悬挂,300 s内记录小鼠摇摆和攀爬情况。
1.6 尼氏染色小鼠海马区脑组织样本,4%多聚甲醛固定,切片,二甲苯脱蜡透明,将切片使用梯度酒精水化,双蒸水清洗后,切片入甲酚紫染色,分化1~3 min后,二甲苯脱水,中性树胶封固,使用显微镜对切片进行图像采集。
1.7 qPCR使用RNAiso Plus裂解液提取组织总RNA,利用反转录试剂盒将总RNA反转录为cDNA,并进行qPCR检测,反应体系为:2 ×T5 Fast qPCR Mix 10.0 μl;10 μmol/L Primer F 0.8 μl;10 μmol/L Primer R 0.8 μl;50 ×ROX Reference Dye II 0.4 μl;Template DNA 0.5 μl;ddH2O补充体系到20 μl。95 ℃反应30 s预变性,95 ℃ 5 s、55 ℃ 30 s、72 ℃ 30 s(40个循环,延伸反应),利用2-ΔΔCT法计算相对表达量。引物序列见表1。
1.8 Western blotBCA蛋白浓度测定试剂盒用于蛋白质样品浓度测定,在95 ℃下加热5 min,每泳道上样30 μg,使用10% SDS-PAGE分离,然后电转移到聚偏二氟乙烯膜(PVDF)上。将膜与GSK-3β(1 ∶500)、Wnt3a(1 ∶500)、 Wnt1(1 ∶500)、 β-cate-nin(1 ∶1 000)以及β-actin抗体(1 ∶2 000)4 ℃孵育过夜。用含有吐温的Tris缓冲液(TBST)洗涤后,将膜与辣根过氧化物酶偶联的二抗(1 ∶1 000)在室温下孵育1 h,然后再次用TBST洗涤。增强的化学发光使抗体可视化,BioRad成像系统分析蛋白质条带的密度。

表1 引物序列
1.9 免疫组化检测海马组织的石蜡切片烘干后,将切片(5 μm厚)脱蜡并使用3%过氧化氢修复组织抗原。将脑组织与小鼠GSK-3β(1 ∶50)、Wnt3a(1 ∶50)、Wnt1(1 ∶50)、β-catenin(1 ∶100)抗体孵育。最后,将组织与生物素标记的二抗(1 ∶500)一起孵育以观察蛋白质表达。
1.10 分子对接与共沉淀实验在Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取人参皂苷Rb1分子结构,在PDB数据库(https://www.rcsb.org/)获取β-catenin蛋白结构,利用AutoDock 4.2(美国Scripps研究所)进行分子对接预测与作图。
将生物素标记的人参皂苷Rb1与亲和素标记的磁珠在室温孵育1 h。通过磁力架吸附磁珠后,清洗磁珠,再将磁珠与总蛋白孵育混合后,在垂直混合器上4 ℃孵育过夜。短暂离心后,在磁力架吸附磁珠,弃去上清液,清洗磁珠后加入洗脱液获得与生物素标记的人参皂苷Rb1结合的蛋白质,Western blot法检测其是否含有Wnt信号通路蛋白。
1.11 统计学处理所有数据均以平均值±标准偏差表示,使用单向方差分析和最小差异测试进行分析。所有统计分析均使用GraphPad Prism软件(v.8.0.1,美国)进行。P<0.05为差异有统计学意义。
2 结果
2.1 局灶性脑CIRI损伤小鼠模型构建为了研究人参皂苷Rb1对局灶性脑CIRI损伤小鼠模型的影响,利用手术构建局灶性脑CIRI损伤小鼠模型,并对小鼠模型进行平衡木试验、Y迷宫试验和悬尾试验,随后分离海马体做组织水平和分子水平检测,流程示意图见图1。结果表明,与假手术组比较,CIRI模型组小鼠神经功能评分明显升高(P<0.05);与CIRI模型组比较,人参皂苷Rb1低剂量组、人参皂苷Rb1中剂量组、人参皂苷Rb1高剂量组和尼莫地平(阳性对照)组小鼠神经功能评分显著降低(P<0.05)(图2A)。平衡木试验中,统计分析表明,与CIRI模型组相比,人参皂苷Rb1低剂量组、人参皂苷Rb1中剂量组、人参皂苷Rb1高剂量组和尼莫地平(阳性对照)组能够显著降低小鼠通过平衡木时间(P<0.05)(图2B)。Y迷宫试验中,与模型组相比,人参皂苷Rb1低剂量组、人参皂苷Rb1中剂量组、人参皂苷Rb1高剂量组和尼莫地平(阳性对照)组均能够显著提高小鼠进入正确臂时间(P<0.05)(图2C)。悬尾试验中,添加人参皂苷Rb1后,与CIRI模型组相比,小鼠摇摆时间和攀爬时间增加(P<0.05),见图2D、2E。

图1 局灶性脑CIRI损伤小鼠模型构建以及行为学检测流程示意图
2.2 人参皂苷Rb1能够提高海马体内尼氏体数量尼氏染色检测海马体中尼氏体数量变化,结果如图3所示,可以明显看到CIRI模型组中尼氏染色阳性率降低,人参皂苷Rb1中剂量组、人参皂苷Rb1高剂量组和尼莫地平(阳性对照)组尼氏染色阳性率有所恢复,染色强度强于CIRI模型组。
2.3 人参皂苷Rb1对Wnt信号通路调控作用Western blot结果表明,在CIRI模型组海马体样本中,与假手术组相比,GSK-3β蛋白升高(P<0.01,F=237.7),见图4A、4B,而Wnt3a(P<0.01,F=122.3)、Wnt1(P<0.01,F=71.59)和β-catenin(P<0.01,F=180.5)蛋白表达量降低,见4C-4E。人参皂苷Rb1低剂量组、人参皂苷Rb1中剂量组和人参皂苷Rb1高剂量组则能够降低GSK-3β,提高Wnt3a、Wnt1和β-catenin蛋白表达量,差异有统计学意义,并且随着剂量的增加,作用越显著。免疫组化结果与Western blot结果趋势一致,见图5~8。

图2 小鼠行为学检测结果

图3 尼氏染色检测各组海马体中尼氏体数量变化 ×200
通过分子对接发现人参皂苷Rb1与β-catenin蛋白可能存在直接结合作用(图9A),共沉淀试验结果证明β-catenin蛋白与人参皂苷Rb1存在直接结合作用(图9B)。进一步通过qPCR检测发现人参皂苷Rb1处理后,海马体中Axin2 mRNA表达量降低(P<0.05),β-catenin mRNA表达量增加(P<0.05)(图9C、9D)。
3 讨论
天然产物可用于调节细胞因子活性以治疗疾病。本研究结果表明天然产物人参的主要生物活性成分之一人参皂苷Rb1能改善大脑中动脉栓塞小鼠模型的神经功能并提高海马体中尼氏体数量。人参皂苷Rb1治疗后海马体中Axin2和GSK-3β降低,Wnt3a、Wnt1和β-catenin表达量增加,差异有统计学意义,表明人参皂苷Rb1能够激活Wnt信号通路,可能在卒中治疗期间对局灶性CIRI具有神经保护作用。
许多研究[8-9]已经证明了人参皂苷Rb1在治疗缺血性中风中的有益作用,人参皂苷Rb1可促进局灶性脑梗死小鼠的后期恢复,然而,人参皂苷Rb1功能的机制需要进一步研究。大脑中的氧化应激和炎症反应是影响缺血性卒中的主要因素,可促进自由基释放,导致脑组织氧化损伤[10]。有研究[11]表明人参皂苷Rb1能够激活PI3K/AKT信号通路,调控细胞自噬,保护神经元免受缺血性损伤。也有研究[8]表明,在小鼠大脑中动脉栓塞再灌注模型中,腹腔注射人参皂苷Rb1可以有效保护血脑屏障,提高紧密连接蛋白的含量,抑制自由基的产生,保护血脑屏障完整性。本研究结果表明,在局灶性CIRI小鼠模型中,腹腔注射人参皂苷Rb1干预后,与CIRI模型组相比,人参皂苷Rb1低剂量组、人参皂苷Rb1
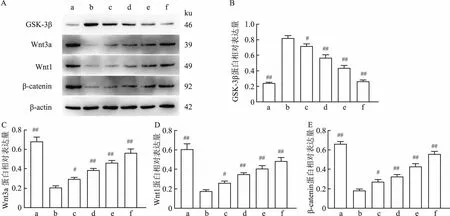
图4 海马体组织中GSK-3β、Wnt3a、Wnt1和β-catenin的蛋白表达

图5 免疫组化法检测海马体组织中GSK-3β表达 ×400
Wnt/β-catenin信号通路在缺血性脑卒中的预防和损伤修复过程中发挥重要作用。以往研究[12-13]表明,Wnt/β-catenin信号通路在脑缺血再灌注损伤中起重要作用,参与神经干细胞的增殖、分化和轴突形成等过程。同时,该信号通路在血脑屏障的形成和维持、脑血管再生和重塑中也至关重要。Wnt蛋白广泛存在于脑血管和血脑屏障中,可参与调节脑血管生成和血脑屏障分化。许多研究[6]已经证实脑缺血再灌注损伤可以激活Wnt/β-catenin信号通路,但该通路的激活是否保护或损伤组织尚存在争议。本研究通过免疫组化与Western blot检测显示,人参皂苷Rb1能够降低GSK-3β,提高Wnt3a、Wnt1和β-catenin蛋白表达量,并且随着剂量的增加,作用越显著。

图6 免疫组化法检测海马体组织中Wnt3a表达 ×400

图7 免疫组化法检测海马体组织中Wnt1表达 ×400

图8 免疫组化法检测海马体组织中β-catenin表达 ×400
综上所述,本研究表明人参皂苷Rb1对局灶性CIRI中的神经系统具有保护作用,能够改善CIRI小鼠模型的神经功能并提高海马体中尼氏体数量,人参皂苷Rb1通过与β-catenin结合激活Wnt信号通路可能在该过程中发挥重要作用。人参皂苷Rb1与激活Wnt信号通路相关,可能在卒中治疗期间对局灶性CIRI具有神经保护作用。研究证明人参皂苷Rb1可能是一种很有前途的神经保护候选物,需要进一步的实验室和临床研究。
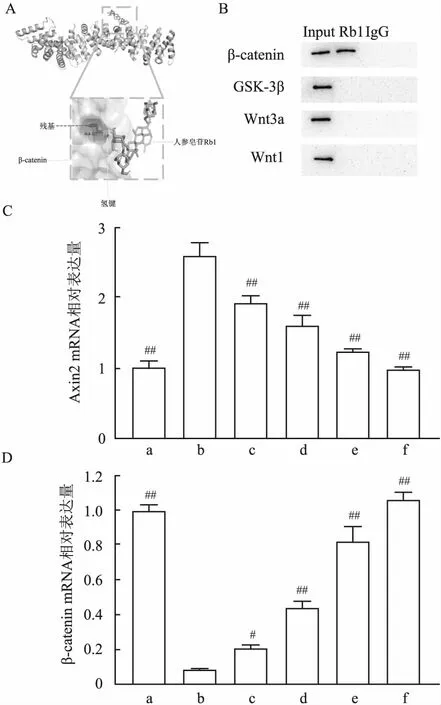
图9 人参皂苷Rb1调控海马体组织中基因表达
