壳寡糖的制备及其对三硝基苯磺酸诱导的大鼠结肠炎模型的治疗作用
2023-03-02袁晓筝
胡 凯,何 欢,袁晓筝,乔 静
炎症性肠病(inflammatory bowel disease,IBD)是临床常见的慢性消化道疾病,包括克罗恩病和溃疡性结肠炎[1]。炎症性肠病的发病机制尚不明确,现有的研究支持黏膜免疫失调在IBD发病机制中的核心作用,进而导致黏膜屏障破坏和纤维化病变[2]。在肠道黏膜免疫中,核因子kappa-B(nuclear factor kappa-B, NF-κB)炎症通路被激活,进一步诱导白细胞介素1β(interleukin 1 beta, IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)的表达,过量的TNF-α进一步加剧炎症反应[3]。
壳寡糖(chitosan oligosaccharide, COS)是一种海洋多糖,它是一种天然抗氧化剂。有研究[4]表明,COS具有免疫调节活性,包括抑制NF-κB信号通路的激活及其下游反应。关于COS治疗IBD的相关研究尚少。该研究将COS用于2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene sulfonic acid, TNBS)诱导的大鼠实验性结肠炎模型的治疗,探究COS对炎症、黏膜屏障和肠纤维化方面的作用。
1 材料与方法
1.1 材料
1.1.1实验动物 健康SPF级雄性Sprague-Dawley大鼠24只,体质量(200±20)g,购自安徽医科大学实验动物中心,饲养温度(22±2)℃,湿度50%,12 h光照与12 h黑暗交替。
1.1.2主要材料 TNBS购自美国Sigma公司。壳聚糖购自青岛弘海生物技术有限公司。IL-1β、TNF-α和白细胞介素6(interleukin 6, IL-6)ELISA试剂盒购自武汉博士德生物工程有限公司。NF-κB1抗体购自中国博士德生物工程有限公司。collagen I、α-SMA抗体购自美国Abcam公司。Masson染液试剂盒、糖原PAS染液购自南京建成生物工程研究所。
1.2 方法
1.2.1COS的制备与表征 取40 g壳聚糖于400 ml蒸馏水中,搅拌使其充分溶解,调节pH至5.5,将壳聚糖酶加到反应体系中,于40 ℃恒温水浴锅中搅拌反应48 h,之后65 ℃水浴反应1h来灭活壳聚糖酶。4 000 r/min离心10 min后收集反应产物,将产物置于-80 ℃过夜后进行真空冷冻干燥,得到酶解产物COS。对产物采用KBr压片法进行红外光谱(FTIR)检测。电离质谱(ESI-MS)检测:取20 mg COS样品溶解于甲醇中,使用三重四级杆液质联用系统生成样品的电离质谱图。薄层色谱法用来鉴定壳聚糖酶解产物,使用的展开剂为异丙醇、氨水和水。产物上样量为1 μl,待不同的COS单体爬板完成后用大茴香醛显色。核磁共振(1HNMR)检测:称取一定量的酶解产物样品溶解在D2O中,震荡溶解后转移至核磁管中,管中加入数滴丙酮作为内参,采用核磁共振仪获取COS的1HNMR图谱。
1.2.2动物模型的构建和管理 实验大鼠适应性饲养1周,采用随机分组法将大鼠均分为正常对照组(CON)、结肠炎模型组(TNBS)、5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)治疗组(TNBS+5-ASA)、COS治疗组(TNBS+COS)。大鼠造模前12 h禁食,将1根直径约2 mm 连接5 ml注射器的导管由肛门缓慢插入结肠腔内约8 cm处,随后将1 ml结肠炎诱导剂(50%乙醇溶液为溶剂+100 mg/kg TNBS)推入导管,最后将大鼠尾巴提起,持续倒置1 min。造模结束后第2天开始灌胃给予治疗剂0.5 ml,灌肠剂及治疗剂设置如下:CON组(50%乙醇溶液+蒸馏水)、TNBS组(结肠炎诱导剂+蒸馏水)、TNBS+5-ASA组(结肠炎诱导剂+120 mg/kg 5-ASA)、TNBS+COS组(结肠炎诱导剂+120 mg/kg COS)。每天给药1次,连续14 d。使用内窥镜对大鼠结肠进行观察。实验期间对疾病活动指数(disease activity index, DAI)进行评估,评分标准见表1[5]。在灌胃后的第14天,戊巴比妥钠腹腔麻醉大鼠,腹主动脉取血,3 000 r/min离心10 min,分离血清置于-80 ℃冰箱保存,用于细胞因子检测。分离结肠组织,拍照后取病变明显处分别用于固定包埋,5 μm切片,进行苏木精-伊红(HE)染色、糖原PAS染色、Masson染色及免疫组织化学染色。

表1 DAI评分
1.2.3组织病理学检查 病理染色后,光学显微镜下随机选择10个视野进行观察,并进行组织病理学计数和评分[6]。
1.2.4细胞因子和生化指标测定 ELISA试剂盒检测各组大鼠血清IL-1β、TNF-α和IL-6的含量。血细胞分析仪检测全血中红细胞(red blood cell, RBC)、血红蛋白(hemoglobin, HGB)、血清总蛋白(total protein, TP)和血浆白蛋白(albumin, ALB)含量。
1.2.5免疫组化检测 检测结肠组织中NF-κB1、collagen I和α-SMA的表达。NF-κB1、collagen Ⅰ、α-SMA的一抗稀释浓度分别为1 ∶100、1 ∶200和1 ∶500,以磷酸盐缓冲液(PBS)作为阴性对照。使用ImageJ软件对阳性表达区域进行统计。

2 结果

2.2 大鼠日常状态观察和体质量变化CON组大鼠精神状态良好、毛色光泽、活动灵敏、饮食水正常。造模大鼠在TNBS造模处理后第2天出现异常,TNBS造成的结肠损伤明显,大鼠饮食饮水量明显减少,出现腹泻,动作迟缓,精神萎靡不振,体质量下降。大部分出现便血。使用内窥镜对大鼠结肠进行观察(图2A),与TNBS组相比,TNBS+COS组恢复的更快。TNBS组DAI评分高于TNBS+COS组(P<0.01)(图2C)。
2.3 COS对结肠炎大鼠肠道功能恢复的影响大鼠的血液学分析表明(表2),与TNBS组相比,TNBS+COS组的HGB显著升高(P<0.01)。COS治疗后增加了血浆蛋白含量(TP和ALB)(P<0.01)。
2.4 COS对结肠炎大鼠结肠组织病理的影响大鼠结肠组织的HE染色结果如图所示,TNBS造成的损伤明显,TNBS组黏膜层空泡变性并伴有强烈的炎症浸润、肌肉层变性和肠系膜增生(图3A)。与TNBS组相比,TNBS+COS组减轻了炎症浸润(P<0.01)。Masson染色显示与CON组相比,TNBS组明显的胶原纤维增多(图3B)。COS治疗组细胞外基质沉积与TNBS组有显著性差异(P<0.01)。

图1 COS的表征
TNBS的诱导不仅使杯状细胞数量减少,还引起杯状细胞空泡变形,导致黏膜层破坏。与TNBS组相比,COS组的杯状细胞数量增多(P<0.01)。
2.5 COS对结肠炎大鼠血清细胞因子的影响通过ELISA法检测大鼠血清中的细胞因子含量,结果显示,与TNBS组相比,TNBS+COS组IL-1β、TNF-α、IL-6水平均下降(P<0.01),见表3。
2.6 COS对结肠炎大鼠结肠NF-κB1、collagen Ⅰ、α-SMA表达的的影响通过免疫组化检测大鼠结肠组织的NF-κB1的表达,与TNBS组相比,COS处理后NF-κB1表达下降(图4A)(P<0.01)。免疫组化的结果显示,与TNBS+COS组相比,TNBS组出现明显的collagen Ⅰ和α-SMA阳性区域。TNBS+COS组α-SMA表达减少与TNBS组有显著性差异(P<0.01)。
3 讨论
IBD是一种肠道慢性炎症性疾病,近年来发病率逐年升高并且难以治愈。目前临床上主要使用5-ASA制剂、免疫抑制剂和糖皮质激素来治疗,但是均存在药物不良反应,因此寻找开发一种新型安全的药物显得尤为重要。
COS是无毒害作用的小分子海洋天然产物,容易被机体吸收,具有很多被证实的生物学功能。在生物医药方面,COS能抑制肿瘤细胞的增殖并起到免疫调节作用,在生物医学工程方面COS可用做基因递送的载体、抗菌材料、表皮伤口敷料等,其缓解炎症作用已得到公认和重视[7]。但是将COS的抗炎作用运用到IBD治疗方面的报道很少。本研究使用已经成熟的TNBS诱导的实验性大鼠结肠炎模型技术,利用120 mg/kg COS进行干预治疗。TNBS刺激肠道上皮会导致巨噬细胞过度活化,释放大量的炎症因子IL-6、TNF-α等,从而造成炎症[8-9]。因此,抑制炎症因子的释放有利于减轻炎症反应。在肠道上皮细胞的细胞实验中,COS则被证实能抑制这些炎症因子释放[10-11]。LPS诱导RAW264.7细胞中IL-6、TNF-α过量表达,COS干预后能够抑制他们的上调[12]。与上述结果一致的是,本研究检测大鼠血清中炎症因子含量,发现COS处理后能有效缓解TNBS诱导的IL-6、TNF-α上调。
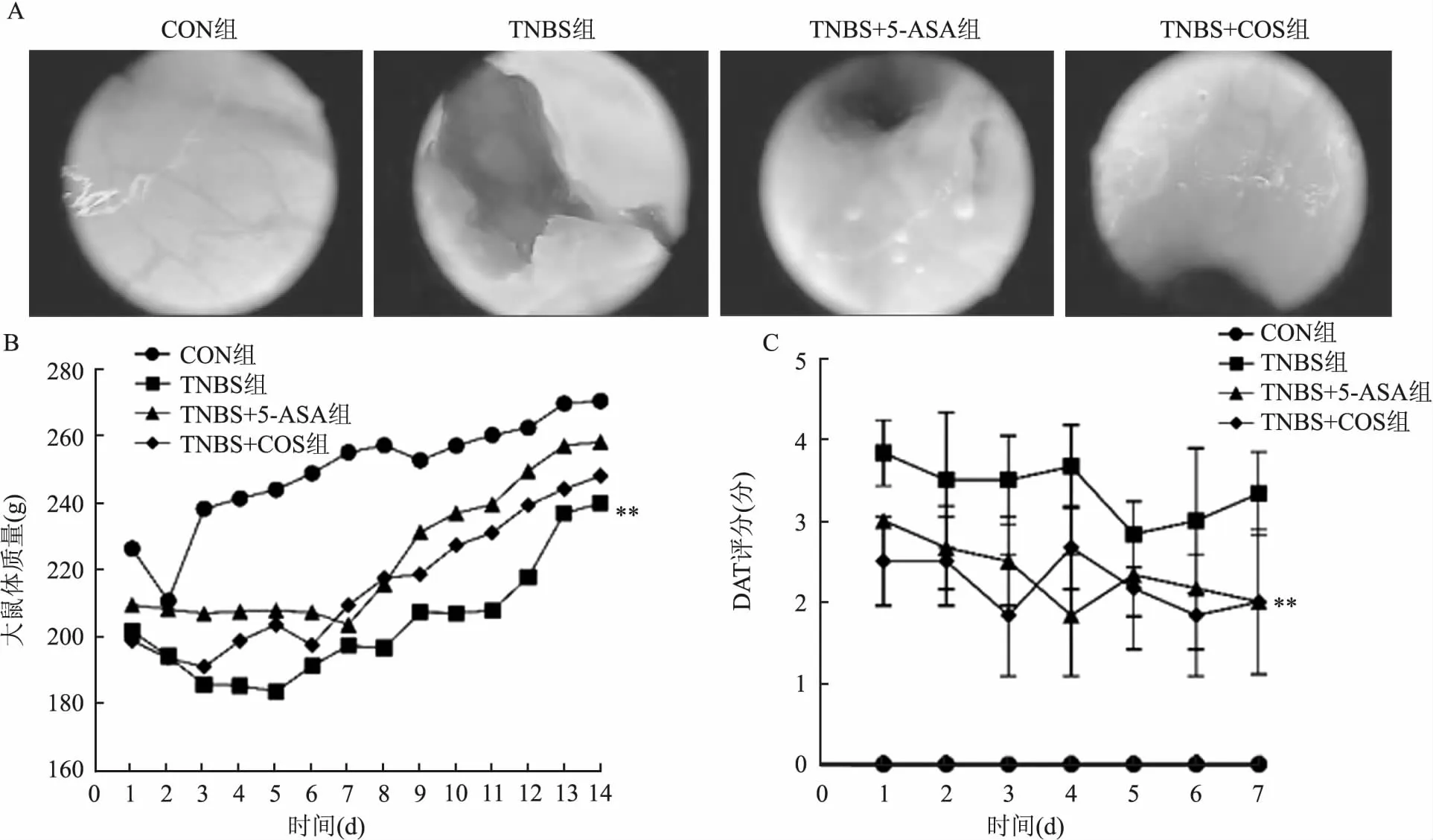
图2 大鼠日常状态观察
表2 各组大鼠血液中RBC、HGB、TP和ALB含量变化

图3 结肠组织病理染色结果

表3 大鼠血清细胞因子含量

图4 结肠组织免疫组化结果
肠道组织是体内重要的免疫代谢调控器官,其稳态的维持对于肠道生理功能的发挥和抵抗病原微生物的侵入至关重要。在健康的结肠中,黏液层厚达1 mm,并且每小时进行一次完整的更新,主要是由杯状细胞形成[13]。通过对大鼠结肠的PAS染色结果观察可知,TNBS组大鼠的肠道杯状细胞数量减少。而经过COS处理后,以上情况得到了缓解。说明COS通过增加杯状细胞数量来改善肠道屏障功能。
肌成纤维细胞的转分化以α-SMA标志蛋白为主要形态学特征,在肠道纤维化发生和发展中起到至关重要的作用[14]。Masson染色结果显示COS干预后能明显缓解由TNBS诱导的结肠炎大鼠模型肠道collagen Ⅰ和α-SMA的表达,减缓纤维化的进展,表明COS可能参与抑制肠道纤维化的过程。
综上所述,本研究结果表明COS是一种安全有效的实验性IBD治疗药物,能够抑制炎症反应相关因子、改善大鼠结肠组织胶原纤维沉积引起的纤维化病变,同时恢复肠道黏膜屏障。本研究结果为IBD的治疗提供了一个潜在的候选药物。
