联合双层探测器光谱CT单能量图及碘图诊断肾脏实性肿瘤
2023-03-01张潇潇吕绍茂王金岸曹代荣陈杏彪
林 禹 张潇潇 吕绍茂 王金岸,* 曹代荣 陈杏彪
1.厦门大学附属中山医院影像科(福建 福州 361004)
2.福建医科大学附属第一医院影像科(福建 福州 350004)
3.飞利浦医疗临床科学部(上海 200233)
与常规混合能量图像相比,能谱CT虚拟单能量图(virtual monoenergetic image,VMI)和碘图可以更准确地反映不同组织的X线吸收特性及碘对比剂摄取率,更容易发现微小组织学差异,有助于肿瘤的检出与鉴别[1-5]。新一代双层光谱探测器CT(dual-layer spectral detector CT,DL-SDCT)可在常规混合能量X线中分离出能谱数据,获取更高质量的VMI及碘图,并可实现VMI和碘图的精确配准与融合[3-4,6]。
肾脏实性肿瘤的诊断有赖于对强化特征和肿瘤血供的准确评价。然而,基于DLSDCT多参数成像的肾脏肿瘤研究却鲜有报道。本研究旨在对比分析DL-SDCT增强扫描多参数图像,初步探讨VMI及碘图在肾脏实性肿瘤术前评估中的应用价值,为患者准确诊断和个体化治疗提供可靠的CT定量参数。
1 资料与方法
1.1 研究对象回顾性分析2019年2月至2020年11月在我院行肾脏增强扫描的患者。
纳入标准:均在DL-SDCT上完成肾脏多期增强检查,并签署知情同意书;手术前2周内完成影像学检查;明确的术后病理结果(包括诊断必需的免疫组织化学信息)。排除标准:年龄<18周岁;图像质量不佳,或肿瘤囊变、坏死、出血或脂肪成分明显,以致无法分析;皮髓质交界期期光谱基图像(spectral based image,SBI)数据包不完整。
1.2 CT检查方案采用DL-SDCT(IQon,Philips Healthcare,荷兰)完成患者扫描。管电压:120kVp,管电流:自动调制;螺距:0.969;准直器宽度:64×0.625mm;转速:0.5s/圈;矩阵:512×512;重建层厚/层间距:2mm/2mm。静脉注射对比剂碘普罗胺(优维显,300mg/mL,流率3.5~4.5mL/s)。其中,皮髓质交界期扫描采用对比剂智能追踪技术,设定140HU为触发阈值。自动完成常规图像的迭代重建(iDose4,level 3)及SBI数据的光谱重建。
1.3 CT图像定量分析在后处理工作站(ISP V10.0,Philips Healthcare,荷兰)上获取平扫及皮髓质交界期50keV的VMI、无水碘图和VMI-碘图融合图。在肾脏肿瘤、同层面竖脊肌、邻近肾皮质上分别勾画类圆形感兴趣区(region of interest,ROI),选取病灶中央实性成分,避开明显的出血、坏死、囊变、钙化、脂肪及血管区,通过自动复制及手动校准,保证ROI大小及层面在各组图像中一致,记录平均CT值和平均碘密度值(iodine density,ID)。
以肌肉测值的标准差(standard deviation,SD)作为图像背景噪声值,计算对比噪声比(contrast to noise ratio,CNR),CNRCT值=(CT值肿瘤-CT值肾皮质)/SD肌肉,CNRID=(ID肿瘤-ID肾皮质)/SD肌肉,计算结果取绝对值。基于相应平扫图像的CT值,计算肿瘤常规图像和VMI的绝对强化值和相对强化值(relative enhancement value,REV),绝对强化值=增强CT值-平扫CT值,REV=绝对强化值/肾皮质CT值。基于肾皮质ID,计算肿瘤的标准化ID(normalized ID,NID),NID=ID肿瘤/ID肾皮质。
1.4 CT图像主观评分由两位具备6年和30年腹部肿瘤影像经验的医师对各组图像进行盲法阅片,保证窗宽和窗位在VMI和常规图像间一致。采用5分法评价图像质量,取二者平均分为最终得分,评分标准如下:1分:细小结构完全不能辨识,伪影及噪声极明显;2分:细小结构显示不清,伪影、噪声较明显;3分:细节基本清晰,略有伪影及噪声,但基本可以诊断;4分:细节较清晰,图像基本无伪影和噪声;5分:细节非常清晰,图像无明显伪影及噪声(大于3分即可满足临床诊断要求)。分别从以下几个维度完成图像质量主观评分:(1)形态学(基于肿瘤形态、边缘、囊变、坏死和强化特征等);(2)血管显示(基于肿瘤及肾脏血管特征);(3)图像整体质量。
1.5 统计学分析采用SPSS 22.0统计软件包进行分析,定量资料以()表示。常规CT图像和VMI定量参数的组间比较采用配对t检验;DL-SDCT多参数图像主观评分的组间比较采用Friedman秩和检验,P值通过Bonferroni校正。通过独立样本t检验比较透明细胞癌(clear cell renal cell carcinoma,ccRCC)和血管平滑肌脂肪瘤(angiomyolipoma,AML)组间各DL-SDCT参数差异。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析不同CT参数诊断透明细胞癌的曲线下面积(area under the curve,AUC)、最佳截断值、Youden指数、敏感性和特异性。不同参数AUC的组间比较采用Z检验。P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料共77例患者纳入本研究,男55例,女25例;年龄19~87岁,平均(54.85±12.51)岁;肿瘤最长径为(5.18±2.98)cm。共80枚(3例患者为双原发病灶)肾脏肿瘤经病理学确诊,其中,ccRCC共计42枚,AML共计10枚,乳头状细胞癌7枚,肾盂浸润性尿路上皮癌7枚,MiT家族易位性肾细胞癌7枚,嗜酸细胞腺瘤4枚,嫌色细胞癌2枚,转移瘤(脂肪肉瘤来源)1枚。
2.2 图像质量评价常规图像、VMI及碘图的SD值分别为(13.80±2.88)HU、(11.52±2.73)HU和(0.31±0.04)mg/mL,对应的CNR分别为6.40±3.59、16.43±9.68和6.18±4.09。相比于常规图像,VMI的SD值(P<0.001)更低,CNR(P<0.001)和REV(P<0.001)更高(表1,图1~图8)。常规图像、VMI、碘图及其融合图均可满足肿瘤诊断要求(主观评分均>3分)。各组图像不同维度的主观评分均存在统计学差异(P均<0.001)。其中,VMI优化了病灶对比及病灶细节的显示,更有助于展现肿瘤形态学特征;而碘图则有助于清晰显示血管细节,但对强化不明显的解剖学结构显示欠佳;VMI-碘图融合图提供了更全面的诊断信息,总体评分最高(表2,图1~图8)。
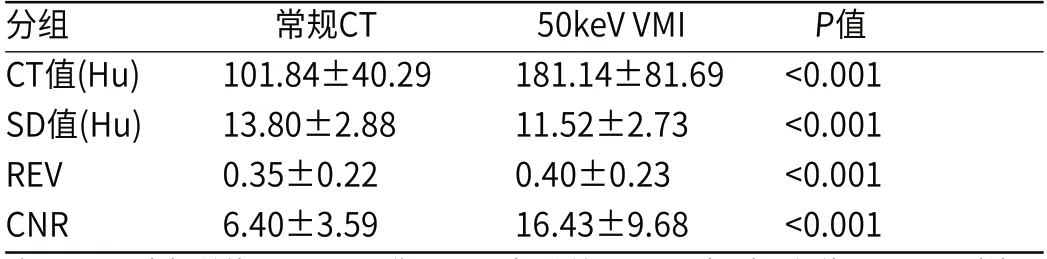
表1 肿瘤皮髓质交界期常规CT图像及VMI定量参数比较(n=80)
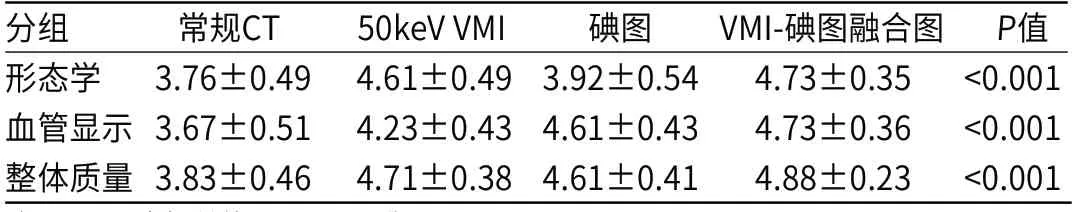
表2 肿瘤皮髓质交界期CT多参数图像质量的主观评分比较(n=80)
2.3 诊断效能评价皮髓质交界期常规CT图像、VMI图以及碘图的各定量参数(CT值、REV值和NID值)均可用于ccRCC与AML的鉴别诊断,见表3。ROC曲线分析揭示,VMI的AUC(0.802)最大,NID的Youden指数最大(0.63),见表4,但各组参数AUC的组间两两比较无统计学差异(Z均>0.05)。

表3 肾脏透明细胞癌(ccRCC)和血管平滑肌脂肪瘤(AML)的CT多参数组间比较(n=52)

表4 常规CT、VMI及碘图定量参数诊断肾脏透明细胞癌的ROC曲线分析

51岁,男性,(左肾)乳头状肾细胞癌。常规CT增强图像(图1)中,左肾占位性病变疑似轻度强化;图2为50keV虚拟单能量图像(VMI),其清晰显示了锯齿状的瘤肾界面,明确了病灶强化范围;碘图(图3)进一步提示病灶存在碘对比剂摄取,但对病灶形态显示欠佳;图4为VMI-碘图融合图,其更加直观显示了肿瘤形态及强化特征。51岁,女性,(左肾)血管平滑肌脂肪瘤。常规CT增强图像(图5)提示不均匀强化的左肾实性肿瘤;图6为50keV虚拟单能量图像(VMI),其清晰显示了肿瘤边缘及强化特征,但部分肿瘤血管的显示存在“开花状伪影”;碘图(图7)可准确清晰显示肿瘤及肾脏血管;图8为VMI-碘图融合图,其通过不同伪彩形象显示了肿瘤的血管(箭)、脂肪(箭头)和平滑肌成分(星号)。
3 讨 论
常规能谱CT通常在70~80keV获得CNR较高的“最佳单能量图”,其更低能级图像(40~50keV,接近碘的K边缘33keV)虽然理论上可增加病灶对比度,但存在较为严重的背景噪声[4]。DLSDCT实现“探测器端”能量分离和投影空间内数据重建,大幅减少光谱混杂,避免像素移位[7]。因此,DL-SDCT可提供更高质量的低能级VMI和碘图,更精确反映组织强化特征和摄碘率,并可生成“时空配准”的融合图[8-9]。
我国肾脏肿瘤的发病率较高,不同类型肾脏实性肿瘤的生物学特征、治疗方案和临床预后不尽相同,因此,术前准确诊断尤为重要。此外,对肾脏血管走行和肿瘤血供的明确评估,有助于腹腔镜下肾部分切除术的开展,最大限度保留患者肾功能,提高术后生活质量[10]。
增强扫描皮髓质交界期的CT图像诊断肾脏肿瘤的效能最高,故本研究均纳入该期相分析。根据预实验结果及文献报道[1,8-9],本研究选取50keV的VMI,以保证最佳病灶对比和图像质量。与常规增强CT图像相比,本研究DL-SDCT生成的VMI和碘图可提供更高对比、更高质量的影像学信息,优化了多种类型肾脏实性肿瘤的显示。Lennartz等学者[1]则认为,相比于常规增强CT,联合应用DL-SDCT的低能级VMI和碘图有助于提高骨骼肌肉转移瘤的检出率和诊断准确性。本研究进一步证实,VMI和碘图不同程度优化了肿瘤细节特征(如病灶边缘、肿瘤血管和特殊征象等)显示,有助于肿瘤早期检出、良恶性肿瘤鉴别以及手术方案规划。
本研究中,对于乏血供实性肿瘤(如乳头状肾细胞癌),VMI相对于常规CT可显著改善肿瘤边缘(尤其是瘤肾界面)等形态学特征显示,并清晰显示在常规图像难以明确的轻度强化范围,见图2。碘图及VMI-碘图融合图则更直观显示了肿瘤摄碘区域的具体范围,见图3~图4,并可通过NID实现准确量化,以期鉴别乏血供肿瘤和高密度囊肿(不摄取碘对比剂),并有助于肾脏肿瘤术前分型。Kessner等学者[11]基于DL-SDCT的多参数成像研究发现,不同能级VMI(40keV和100keV)病灶CT值的光谱曲线斜率有助于良性复杂囊肿和肿瘤性病变的鉴别,进一步佐证了本研究结果。
对于富血供实性肿瘤(如ccRCC),由于肿瘤本身强化十分明显,常规图像、VMI均可获取良好的病灶对比和充分的形态学信息。然而,更高对比的VMI和碘图对优化肿瘤血管和囊变坏死区的显示仍有额外的帮助,有助于精准评估肿瘤血供和生物学行为,为外科医师规划手术方案提供重要参考。此外,对于组织成分复杂的富血供肿瘤(如AML等),碘图及VMI-碘图融合图尤其有助于不同组织学成分(尤其是血管和强化组织)的识别,增加肿瘤诊断信心,见图7~图8。
Nagayama等学者指出[5,9],DL-SDCT增强扫描低能级VMI不仅可获得比常规图像更佳的图像质量,还有助于胰腺肿瘤及周边血管评价,这与本研究上述结果相似。然而,本研究中部分强化明显的血管在VMI图像上存在“开花状伪影”,一定程度上影响肿瘤血管观察(表2,图6)。因此,联合应用碘图及VMI-碘图融合图,可实现多参数DL-SDCT图像的优势互补,有助于肾脏肿瘤全面评价。
本研究初步证实,VMI和碘图各定量参数还有助于ccRCC和AML的术前鉴别,并获得相当于或略优于常规CT的诊断效能。由于本研究中AML样本量较小,组织学成分复杂,AML瘤内存在的微小脂肪和出血成分容易干扰定量分析,VMI和碘图的诊断价值尚有待大样本研究进一步验证。
由于DL-SDCT成像的独特技术优势,本研究VMI及碘图均来自对SBI数据的回顾性重建,不产生额外的扫描序列或电离辐射。多项研究指出[2,4-5],腹部肿瘤单期增强扫描CT低能级VMI及碘图即可达到相当于常规多期CT增强扫描的诊断效能,在降低患者辐射剂量和简化扫描流程的同时,还可有效提高病灶的“可视性”和“可量化性”,有助于肿瘤准确定性与分期。
本研究尚存在以下不足:(1)总样本量较小,不同类型肾脏肿瘤的多参数CT研究还有待进一步细化;(2)未对不同期相和不同能级的VMI参数开展对比研究;(3)未进一步联合肾肿瘤DL-SDCT参数和Ki-67指数或Fuhrman核分级开展研究。
综上所述,DL-SDCT皮髓质交界期VMI、碘图及VMI-碘图融合图提供了优于常规CT的图像质量,有助于肾脏实性肿瘤的细节显示;定量参数REV和NID在ccRCC的诊断中具有一定价值,应用前景可观。
