DSC-PWI与脑胶质瘤分级及Ki-67表达应用研究
2023-03-01陈煜豪陈德基陈满刘波陈弘陈盛钧
陈煜豪 陈德基 陈满 刘波 陈弘 陈盛钧
广州医科大学附属第二医院放射科(广东 广州 510260)
脑胶质瘤起源于神经胶质细胞或干细胞[1]。在病理学中,镜下常可见迂曲走行、分布杂乱的新生血管,随着肿瘤进一步生长,新生血管会逐渐生长增多[2],能在一定程度上反映出胶质瘤的生长特性[2]。有资料显示,Ki-67抗原的表达亦常用于判断肿瘤的病理分级以及肿瘤的增殖程度,是现如今最常用的指标之一[3-4]。常规MR增强所表现出的肿瘤强化实际上并不能明显地反映肿瘤内微循环的情况,故脑胶质瘤术前影像学诊断是重点和难点[5-6]。磁共振灌注成像(Perfusion imaging,PWI)是一种通过测量病灶血流动力学参数初步评估组织灌注状态的功能成像技术。鉴于此,本研究运用动态磁敏感对比灌注加权成像(DSC-PWI)技术,将脑胶质瘤病理分级与Ki-67表达情况的差异性及相关性进行分析。
1 材料与方法
1.1 一般资料选自2019年12月至2020年12月期间在广州医科大学附属第二医院发现脑内占位并予以外科手术切除,经过病理学诊断为脑胶质瘤且进行了Ki-67表达指数检测的患者为研究对象。经统计共有35例患者,其中男性20例,女性15例,年龄范围24~74岁,平均年龄(47.2±14.3)岁,体重范围45-84公斤,平均体重(61.3±9.4)岁。本研究符合伦理审查制度,且所需的检查均取得受试对象的同意并签署检查知情同意书。
1.2 纳入及排除标准
纳入标准:所有患者均在3.0T磁共振完成相关检查;患者影像学检查前未进行相应治疗,且在检查后的2周内予以外科手术切除。排除标准:图像质量差,无法完成影像诊断以及图像后处理;患者脑内存在除脑胶质瘤外其他重大的疾病。
1.3 方法
1.3.1 检查方法 所有患者采用Philips 3.0T磁共振扫描仪和8通道头部专用相控线圈。首先,进行常规平扫序列扫描,包括横断位T1WI、横断位T2WI、横断位T2WI-FLAIR、横断位DWI。然后,予以横断位DSC-PWI灌注扫描(MS-EPI PRESTO;TR 17ms,TE 25ms,翻转角7°,FOV 230mm×187mm,层厚4mm,层间距0mm,扫描期数共50期,激励次数 1次,总时长约1分06秒);该序列启动扫描开始至第5期的同时启动高压注射器,以0.2mL/kg剂量的对比剂,用4mL/s的注射速率经肘部静脉注入,再以相同速率注入20mL0.9%氯化钠进行冲管。最后,进行常规T1WI增强扫描检查。扫描所需对比剂为钆喷酸葡胺注射液(Gd-DTPA,康臣,规格20mL:9.38g)。
1.3.2 数据后处理及分析 将所有数据传输至飞利浦后处理工作站(Philips IntelliSpace Portal),以动脉流出效应(artery inflow function,AIF)曲线图作参考。由一名3年以下以及一名10年以上年资放射科医生根据横断位T2WI-FLAIR或T1WI增强图像,避开可能影响测量结果的区域(如:坏死、出血、钙化、囊变、血管走行区域等),在瘤体灌注最明显区域以及对侧正常脑白质区域绘画ROI区域,每个感兴趣区面积控制在30-40mm2之间,每人分别测量3次并取平均值(在不同时间段进行)。最后,参数进行标准化处理,即感兴趣区域灌注值与对侧正常脑白质区域灌注值相比,分别以rCBF(相对脑血流量)、rCBV(相对脑血容量)、rMTT(相对平均通过时间)、rTTP(相对达峰时间)表示。
1.3.3 组织病理学检查 将肿瘤送至病理科行HE染色观察,根据WHO中枢神经系统肿瘤分类标准[7]并进行病理诊断、分级以及测量Ki-67表达指数。根据相关资料及文献,定义脑胶质瘤的Ki-67抗原表达指数<10%为低表达(-),≥10%为高表达(+)[8-9]。
1.4 统计学方法使用IBM SPSS 26.0进行统计学分析,将数据进行正态性检验后,符合正态分布部分运用t检验、Pearson相关分析,不符合正态分布部分运用Mann-Whitney U检验、Spearman相关分析,并且利用ROC曲线分析检验效能,P<0.05则认为具有统计学意义。
2 结 果
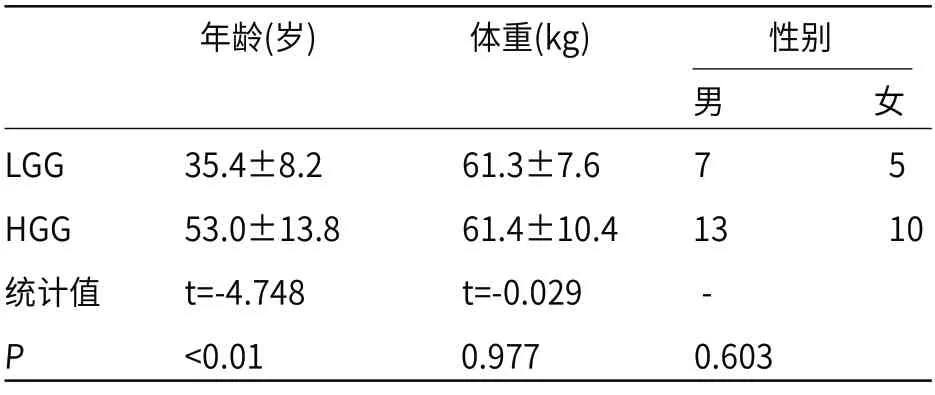
2.1 患者一般资料LGG与HGG两组之间年龄具有显著统计学差异(P<0.01),而两组之间体重和性别均不具有统计学差异(P>0.05),详见表格1。
2.2 LGG与HGG之间DSC-PWI分析两组rCBF、rCBV具有显著统计学差异性和正相关性(P<0.01),且LGG组rCBF、rCBV低于HGG组。然而,两组间的rMTT、rTTP无统计学差异性及相关性(P>0.05),详见表格2、3。ROC曲线分析结果显示在鉴别LGG与HGG中,rCBF、rCBV有一定预测价值(0.5 图1 rCBF、rCBV值与脑胶质瘤分组ROC曲线分析图。图2 rCBF、rCBV值与Ki-67表达程度ROC曲线分析图。 2.3 LGG与HGG组Ki-67表达分析LGG与HGG组的Ki-67表达指数中位数分别为5%、25%,有显著统计学差异(P<0.01)和显著正相关(r=0.802,P<0.01),详见表格5。 2.4 DSC-PWI与Ki-67表达分析根据前面所述定义将患者分为Ki-67低表达、高表达两组。两组的rCBF、rCBV有显著统计学差异性(P<0.01),Ki-67高表达组rCBF、rCBV高于Ki-67低表达组。同时,rCBF、rCBV与Ki-67表达有显著正相关性(P<0.01)。然而,rMTT、rTTP与Ki-67表达无显著统计学差异性及相关性,详见表格6、7。ROC曲线分析结果显示,在判断Ki-67表达程度的高低,rCBF、rCBV有一定的预测价值,且rCBV的诊断效能更优,而获得rCBF、rCBV最佳阈值分别为2.33(敏感度、特异性=91.3%、83.3%)、2.16(敏感度、特异性=95.7%、91.7%),详见表格8与图2。 图3 病例1,男性,41岁,右侧额颞叶不规则肿块,周围片状水肿带,中线结构轻度移位,增强扫描肿瘤内强化不显著,影像初步诊断为低级别胶质瘤。DSC-PWI可见肿瘤局部灌注增高,测得最高灌注区域rCBF、rCBV值分别为3.81、6.32。术后病理:间变性星形细胞瘤(WHO III级),Ki-67表达指数约15%。图4 病例2,男性,32岁,左侧颞叶脑室旁不规则肿块,内可见多个囊状信号,周围可见片状水肿带,增强扫描肿瘤内不均匀中等强化,影像学初步诊断为高级别胶质瘤。DSC-PWI可见肿瘤局部灌注增高,测得最高灌注区域rCBF、rCBV值分别为4.71、4.02。术后病理:多形性黄色星形细胞瘤(WHO II级),Ki-67表达指数约5%。 表1 LGG和HGG两组患者的基本资料 表2 LGG与HGG之间DSC-PWI参数值差异性分析 表3 DSC-PWI参数值与脑胶质瘤分组的相关性分析(r;P) 表4 rCBF、rCBV值与脑胶质瘤分组的ROC分析 表5 LGG与HGG两组Ki-67表达指数分析 表6 Ki-67抗原表达程度与DSC-PWI参数值差异性分析 表7 DSC-PWI参数值与Ki-67表达相关性分析(r;P) 表8 rCBF、rCBV值与Ki-67表达程度ROC曲线分析 脑胶质瘤是CNS最常见起源于神经胶质细胞或者干细胞的恶性肿瘤[1]。文献显示,由于存在生活方式、生活环境、基因差异等原因,不同人群、不同性别之间脑胶质瘤的发病率亦不相同[10,11]。CNS恶性肿瘤在北美或西欧等发达国家更为常见,与东南亚等发展中国家相比较,两者具有5倍的差距[12]。Jill S.Barnholtz-Sloan等人发表了关于美国脑肿瘤流行病学的文章[13]。资料显示,在性别方面,相比于女性,男性患脑胶质瘤的概率更高,但并未提到在病理分级与性别的差异,而本研究结果亦显示LGG与HGG在性别方面无统计学差异;在年龄方面,脑胶质瘤在病理分级上则具有年龄差异,其中15-39岁年轻患者则以LGG多见,中老年人则以HGG多见,而本研究结果亦显示LGG与HGG两组间年龄具有显著统计学差异,与文献报道一致。本研究另显示,两组间体重无统计学差异。 DSC-PWI扫描技术能够在更加准确地判断肿瘤病理分级,有助于临床评估患者的预后情况,因其可运用灌注成像参数值定量或半定量来初步分析肿瘤内新生血管形成能力[14]。Anna Falk等学者运用灌注扫描技术对WHO Ⅱ-Ⅲ级脑胶质瘤分析,结果显示,rCBF能在术前有效区分WHO Ⅱ级与WHO Ⅲ级的脑胶质瘤,且有一定的优势(AUC=0.80)[15]。George A.Alexiou等学者则发现,rCBV对脑胶质瘤的分级有统计学意义[16]。本研究中,LGG与HGG组之间rCBF、rCBV具有显著统计学差异性和正相关性,符合其生物学特性,即HGG新生血管的增殖程度高于LGG。将rCBF、rCBV行ROC分析,结果显示,对于区分LGG与HGG,rCBF、rCBV均有一定的预测价值,且rCBV诊断效能更优,与张磊等学者的研究结果相符[17]。同时,本研究获得rCBF、rCBV最佳鉴别阈值分别为2.33、2.10。 另外,Ki-67抗原的表达与肿瘤的生物学特性有关。本研究显示,脑胶质瘤分级与Ki-67表达指数具有显著统计学差异和正相关,LGG组Ki-67表达指数低于HGG组,与张国臣及Rani N等学者的研究结果相一致[3,4]。根据定义分组后发现,Ki-67低、高表达组间的rCBF、rCBV有显著统计学差异及正相关,且ROC分析结果显示,对于判断Ki-67抗原表达的程度高低,rCBF、rCBV均有一定的预测价值,且rCBV的诊断效能更优,与Ryoo I[18]、张志方[19]等人研究的结果一致。同时,本研究获得rCBF、rCBV最佳鉴别阈值分别为2.33、2.16。 然而,本研究中rMTT、rTTP不具有统计学差异性,可能是由于颅脑肿瘤类型的不同而导致两者参数值存在差异,而两者参数的运用在胶质瘤内报道甚少,因此需要进一步探究其意义。 本研究亦发现与研究结果相反的情况。LGG组中一名患者rCBF、rCBV达到了HGG组的水平,该患者术后经组织病理学检测为多形性黄色星形细胞瘤(WHO Ⅱ级)。对此,相关文献亦有报道,如康厚艺等学者[20]对5例多形性黄色星形细胞瘤灌注成像分析,发现2例多形性黄色星形细胞瘤rCBV明显高于一般的低级别胶质瘤,提示多形性黄色星形细胞瘤的肿瘤血供丰富,且其中1例经病理学分析,可见核分裂像及Ki-67高表达,推测可能与肿瘤术后易复发、有恶变潜能等潜在的生物学特征相关,从而影响了参数值的高低[21]。 本研究亦有一定的不足之处:(1)本研究病例数较少,尚不能探究不同病理类型下灌注参数的情况,后续仍要加大样本量探究其意义。(2)IDH基因的表达,在WHO中枢神经系统肿瘤分类[7]中进行了详细的说明,其在胶质瘤代谢、发病机理等均具有重要意义。无论是弥漫型胶质瘤(Ⅱ级)还是间变型胶质瘤(Ⅲ级)患者,IDH突变型患者的生存率高于IDH野生型患者[22]。本研究病例数有限,关于IDH基因的情况未予以讨论,后续将会加大样本量进行综合分析。(3)灌注成像及相关后处理中所选取的ROI受设备、图像分辨率、个人主观性等差异的影响,可能存在测量的误差。 综上所述,为了给予临床、病理学更多诊断信息,DSC-PWI技术无论在预测脑胶质瘤病理分级还是Ki-67抗原表达都起着重要作用,有助于提高其诊断效能。








3 讨 论
