盐胁迫对裸果木幼苗光合特性的影响
2023-02-28周晓瑾黄海霞张君霞马步东陆刚齐建伟张婷朱珠
周晓瑾,黄海霞,张君霞,马步东,陆刚,齐建伟,张婷,朱珠
(甘肃农业大学林学院,甘肃 兰州 730070)
裸果木(Gymnocarpos przewalskii)是石竹科,裸果木属的一种多年生亚灌木状植物,主要生长在800~2500 m的干河床、山前洪积扇及砾质戈壁滩等地[1],属于古地中海旱生植物区系成分,是亚洲中部荒漠区内比较稀少的孑遗物种[2],对我国旱生植物区系起源和演化过程的研究有着重要的科学价值。裸果木分布区自然环境恶化、繁殖困难、加之人为因素和动物取食的影响,导致其分布区种群数量急剧降低,1997年被列为国家一级保护植物[3]。目前主要分布于我国甘肃河西走廊、内蒙古西部、新疆部分区域及宁夏两区中西部[4-6]。本研究选用材料来自甘肃安西极旱荒漠国家级自然保护区,该区土壤盐分类型以硫酸盐氯化物—钠盐和氯化物硫酸盐为主[7],且其中Cl-和Na+的含量分别为0.4 g·kg-1和0.5 g·kg-1[8]。植物光合作用对盐胁迫敏感,表现为叶片气孔导度减弱,光合速率下降,导致植物生长发育受到不同程度的伤害,如张潭等[9]研究发现,枸杞(Lycium barbarum)叶片净光合速率在盐胁迫下受到明显的抑制,章华婷等[10]表明,高盐胁迫下夏蜡梅(Sinocalycanthus chinensis)最大光化学效率和潜在光化学效率显著降低,但张川红等[11]发现,国槐(Sophora japonica)在盐胁迫下能够维持或提高净光合速率,表现出较好的耐盐性。目前,有关裸果木的研究主要集中于种子萌发、根系形态和生理特征等方面[12-14],而关于不同盐胁迫浓度对裸果木光合特性影响的研究尚未见报道。因此,本研究以安西极旱自然保护区土壤盐渍化为背景,通过设计盐分梯度来模拟该地区土壤含盐量,研究盐胁迫对裸果木光合作用、光响应曲线和叶绿素荧光参数的变化及差异性,揭示裸果木对盐胁迫的适应机制和抗逆机理,为荒漠地区裸果木耐盐性研究及人工种植地的选择提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验材料为一年生裸果木幼苗。种子采集于甘肃安西极旱荒漠国家级自然保护区植物园。于2021年4月初,采用花盆进行播种育苗,播种前用10%的84消毒液浸泡种子3 min,用蒸馏水冲洗干净,最后用滤纸吸干水分。育苗基质配比为泥炭土∶蛭石=3∶1,每个花盆(内径18 cm,高15 cm)播种3穴,每穴4粒,深度为1 cm,待成活稳定后,每盆保留3株。于2021年5月中旬移至甘肃农业大学试验基地的塑料大棚中进行日常管护。
1.2 试验设计
育种前对基质进行风干,每盆装入等量基质(359.97 g),试验设置7个NaCl浓度梯度,使得基质盐分含量分别为0.2%(T1)、0.4%(T2)、0.6%(T3)、0.8%(T4)、1.0%(T5)和1.2%(T6),以蒸馏水为对照(CK)。按照设置的基质盐分处理和盆土干重,计算每个处理需要加入NaCl的量,分别配置成1 L的溶液,缓慢加入基质中。每个处理包括20盆,每3~5 d浇等量水,若底部托盘中有渗出液则浇回至盆中,以避免土壤盐分的流失。于2021年7月末开始测定光合作用等指标。
1.3 指标测定方法
1.3.1 光合气体交换参数的测定 选择晴朗的天气,利用Li-6400便携式光合测定仪(Li-CorInc.Lincoln,NE,美国)于上午9:00-11:00对裸果木叶片净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,C)i和蒸腾速率(transpiration rate,Tr)等光合参数进行测定。测定时选取植株中上部长势良好的叶片,每处理选择3个健壮植株重复,每株测定1次。控制叶室温度为25℃,CO2浓度为400 μmol·mol-1,空气相对湿度为60%~70%,光强设置为1000 μmol·m-2·s-1。水分利用效率(instantaneous water use efficiency,WUE)和气孔限制值(stomatal limitation,Ls)分别用如下公式计算:WUE=Pn/Tr;Ls=1-Ci/Ca[15],其中Ca为大气CO2浓度。
1.3.2 光响应曲线的测定 采用美国LI-COR公司生产的Li-6400便携式光合测定仪,于晴朗日9:00-11:00选择红蓝光源叶室,设定光合有效辐射(photosynthetically active radiation,PAR)由高到低依次为1800、1600、1400、1200、1000、800、600、400、300、200、150、100、50、30、0 μmol·m-2·s-1,利用Li-6400自动“light-curve”曲线功能进行测定,先在1000 μmol·m-2·s-1PAR进行诱导,再按设定PAR范围从高到低依次测定,稳定120 s后系统自动记录并保存光合数据。测定期间,设定气体流速为500 μmol·m-2·s-1,叶室内CO2浓度为400 μmol·mol-1,叶室温度为(25±3)℃,最小等待时间和最大等待时间分别为120和200 s,结果取3次重复的平均值。采用叶子飘等[16]的机理模型进行拟合并计算光响应特征参数。
1.3.3 叶绿素荧光参数的测定 叶绿素荧光参数用PAM-2500便携式调制叶绿素荧光仪(WALZ,德国)测定,测定时间与光合气体交换参数一致。测定前先用叶夹遮光处理(暗适应)30 min,每个处理重复3次。测定的荧 光 参 数 主 要 有:PSII潜 在 活 性(potential activity of PSII,Fv/F0)、PSII原 初 光 能 转 化 效 率(maximal photochemical quantum efficiency of PSII,Fv/Fm)、实际光化学效率(actual photochemical efficiency,ΦPSII)、电子传递速率(electron transfer rate,ETR)、光化学猝灭系数(photochemical quenching coefficient,qp)、非光化学猝灭系数(non-photochemical quenching coefficient,NPQ)。
1.4 数据处理
用Microsoft Excel 2010整理数据;在SPSS 26.1统计分析软件中,采用单因素方差分析(ANOVA)进行数据差异性比较,利用Duncan法检验处理间差异的显著性(P<0.05);用Origin 2020作图。
2 结果与分析
2.1 盐胁迫对裸果木幼苗叶片光合气体交换参数的影响
2.1.1 盐胁迫对叶片Pn、Tr和WUE的影响 叶片Pn随着盐胁迫程度的增加而下降(图1A)。与CK相比,0.2%NaCl处理下Pn下降不明显。当盐浓度≥0.4%时,Pn均显著低于CK,降幅分别为21.0%、55.1%、64.3%、68.6%和78.4%。NaCl浓度为0.6%~1.2%,各处理Pn差异不显著。盐胁迫使叶片Tr呈下降(图1B)趋势,T1处理与CK间差异未达到显著水平。随着胁迫程度的加重,Tr显著降低,较CK分别降低了23.6%、35.1%、47.8%、53.1%和61.5%。T5、T6处理的Tr显著低于T2、T3处理,且T4与T2处理间也存在显著差异。随着盐浓度的增大,叶片WUE呈先上升后下降的趋势(图1C)。T1和T2处理的WUE较CK提高,但不显著。而当盐浓度≥0.6%时,各处理WUE显著低于CK,降幅分别为30.0%、31.5%、32.9%和36.1%,但各胁迫处理之间差异不显著。
2.1.2 盐胁迫对叶片Gs、Ci和Ls的影响 叶片Gs随着盐浓度增加,呈现出减小趋势(图1D)。T1处理的Gs与CK间差异不显著。当盐浓度≥0.4%时,各处理Gs显著低于CK,分别下降了19.2%、59.3%、63.9%、69.5%和76.9%。盐胁迫对叶片的Ci影响显著(图1E)。Ci随着盐浓度的增大呈现先降低后升高的趋势,与CK相比,T1和T2处理下降不明显,T4~T6处理的Ci显著增加,分别是CK的1.0、1.1和1.2倍,T3处理的Ci与CK相比增加不明显。随着盐胁迫程度增大,叶片Ls呈先升后降趋势(图1F)。T1和T2处理的Ls与CK间的差异未达到显著水平;当盐浓度≥0.6%时,Ls显著下降,较CK分别降低了28.2%、51.0%、57.8%和68.1%,但各胁迫处理间差异不显著。

图1 盐胁迫对裸果木幼苗叶片光合气体交换参数的影响Fig.1 Effects of salt stress on photosynthetic gas exchange parameters of seedling of G.przewalskii
2.2 盐胁迫对裸果木幼苗叶片光合响应特性的影响
2.2.1 盐胁迫对叶片光响应曲线变化特征的影响 从图2可知,各处理叶片的光响应曲线均呈先升高后趋于平缓,采用叶子飘等[16]的机理模型对叶片光响应曲线进行模拟,确定系数在0.97以上,说明该模型适合模拟不同盐胁迫对裸果木幼苗叶片的光响应过程。各处理Pn快速上升的PAR范围不一致,CK和T1处理为0~800 μmol·m-2·s-1,T2处 理 为0~600 μmol·m-2·s-1,其 余 盐 分 处 理 为0~400 μmol·m-2·s-1;PAR为1000~1200 μmol·m-2·s-1时,CK和T1、T2处理Pn达到饱和状态;而其余各处理Pn在400~600 μmol·m-2·s-1时就达到饱和。

图2 盐胁迫下裸果木幼苗光合响应曲线的变化Fig.2 Changes of photosynthetic response curves of seedling of G.przewalskii under salt stress
2.2.2 盐胁迫对叶片光响应参数的影响Pnmax随着盐浓度的增加而降低;除T1和T2处理外,其余各处理的Pnmax均显著低于CK,分别降低了26.1%、36.8%、44.0%和52.6%(表1)。随着盐胁迫程度的增大,Rd呈现降低趋势;NaCl浓度≥0.6%时,Rd降幅明显,较CK分别下降了40.0%、43.3%、56.7%和61.7%。随着盐处理浓度增加,LSP逐渐减小,而LCP呈相反趋势。T6处理的LCP比CK显著增加了63.9%;NaCl浓度≥0.6%时,LSP分别较CK显著下降了23.6%、24.1%、27.9%和30.0%。随着盐胁迫的加剧,AQY逐渐降低。除T1和T2处理外,其余各处理与CK间的差异均达到显著水平,分别降低了49.5%、63.9%、66.0%和71.1%。

表1 盐胁迫下裸果木幼苗光响应参数的变化Table 1 Changes of light response parameters of seedling of G.przewalskii under salt stress(μmol·m-2·s-1)
2.3 盐胁迫对裸果木幼苗叶片荧光参数的影响
2.3.1 盐胁迫对叶片Fv/F0与Fv/Fm的影响 叶片Fv/F0随着盐胁迫程度的加重呈下降趋势(图3A)。与CK相比,T1和T2处理下Fv/F0下降不明显。其余各处理Fv/F0较CK显著降低,降幅分别为25.9%、37.1%、42.7%和48.0%;T4和T5处理的Fv/F0与T3和T6处理之间的差异不显著,但T6处理的Fv/F0较T3处理显著下降29.8%。不同处理下叶片的Fv/Fm值介于0.67~0.80之间,随着盐浓度的增加,Fv/Fm呈下降趋势(图3B)。盐浓度在0.6%~1.2%之间,Fv/Fm分别比CK显著下降了7.4%、10.7%、13.0%和15.9%,T6处理的Fv/Fm也显著低于T3处理,其余各胁迫处理之间差异不显著。
2.3.2 盐胁迫对叶片ΦPSII与ETR的影响 盐胁迫对叶片ΦPSII具有显著影响(图3C)。随着盐浓度的增加,各盐分处理ΦPSII与CK相比,分别下降了26.7%、51.8%、80.9%、86.2%、90.5%和94.1%。T3处理ΦPSII显著低于T1和T2处理,降幅分别为73.9%和60.3%。当盐浓度≥0.6%时,各胁迫处理间ΦPSII差异不显著。盐胁迫使叶片ETR降低(图3D)。T1处理 的ETR与CK间差异不 显 著;T2处理下ETR显 著 高于T3~T6处 理,分别高出39.5%、48.1%、55.9%和61.2%。
2.3.3 盐胁迫对叶片qp与NPQ的影响 叶片qp随着盐浓度的增加呈下降趋势(图3E)。T1和T2处理的qp与CK相比分别显著下降了16.4%和19.8%;当盐浓度≥0.6%时,各胁迫处理之间qp差异不明显,但均显著低于CK,降幅介于36.4%和47.6%之间。随着盐浓度增大,叶片NPQ呈现先显著增大后减小的趋势(图3F),在0.4%NaCl处理下达到最大值,较CK高出39.5%,而当NaCl浓度≥0.8%时,NPQ显著降低,较CK分别下降了48.5%、64.2%和82.5%,但这3个处理间差异不显著。
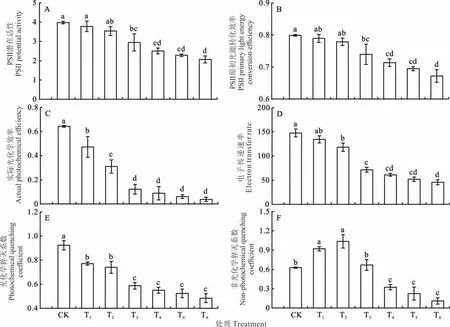
图3 盐胁迫对裸果木幼苗叶片荧光参数的影响Fig.3 Effects of salt stress on leaf fluorescence parameters of seedling of G.przewalskii
3 讨论
3.1 盐胁迫对裸果木幼苗叶片光合气体交换参数的影响
盐胁迫通常会抑制植物的光合作用。如对红花玉兰(Magnolia wufengensis)和沙枣(Elaeagnus angustifolia)进行盐胁迫的研究表明[17-18],盐胁迫显著降低了两种植物的Pn、Gs、Tr和Ci。盐胁迫下,植物光合作用受到多种因素的影响,包括气孔限制和非气孔限制因素[19]。Farquhar等[20]认为,如果盐胁迫使Gs减少而叶肉细胞仍在活跃地进行光合时,Ci应明显下降,Ls升高,则光合速率降低为气孔限制所致;如果叶肉细胞本身光合活性下降,Ci有可能升高或者不变,Ls下降,则光合速率降低的主要因素是非气孔限制。本试验中,在0.2%和0.4%的NaCl处理下,裸果木叶片Ci和Gs与CK相比同时下降,且Ls升高,表明该盐分条件下气孔限制是导致光合速率下降的主要因素;当NaCl≥0.6%处理时,Ci升高,而Ls降低,说明NaCl≥0.6%处理时的光合速率下降主要受非气孔限制影响,其原因可能是叶绿体中非固定状态下的CO2从叶肉细胞壁到CO2还原侧移动的过程中受阻,同时核酮糖二磷酸羧化酶的活性降低[21]。对于盐胁迫通过气孔因素或非气孔因素导致光合速率降低的原因,研究结果不尽一致,对同种植物的研究也有着不一致的报道,这可能是盐胁迫下研究的物种不同,植物的耐盐性存在差异,或者针对同一物种,低盐或高盐胁迫的浓度范围设置不同[22]。
3.2 盐胁迫对裸果木幼苗叶片光响应曲线的影响
光响应曲线描述了在一定范围光照强度下植物潜在的光合作用能力和植物对生长环境的适应性,是探究环境胁迫下光合作用变化的重要手段[23-24],通过拟合光合响应曲线得到的各种参数,对了解环境胁迫下植物光反应过程的光合速率十分重要。Pnmax是光饱和状态下的净光合速率,其在适宜的环境条件下完全取决于叶片自身光合能力的大小[25]。本研究中低盐胁迫(NaCl≤0.4%)的Pnmax与CK差异未达到显著性水平,但随着盐胁迫程度增加,Pnmax显著降低,这与李菊艳等[26]在胡杨(Populus euphratica)幼苗上的研究结果基本一致,说明盐胁迫不利于裸果木幼苗同化产物的积累。光合响应曲线与纵轴的交点为Rd[27];LCP和LSP则分别是判断植物利用弱光和强光能力大小的重要指标[28]。从本研究可以看出:随着盐胁迫程度增大,裸果木幼苗的Rd、LSP和AQY呈下降趋势,而LCP呈上升趋势;NaCl浓度≤0.4%时,叶片的Pnmax、Rd、LSP和AQY降幅不明显,说明该盐分条件下,裸果木幼苗通过降低呼吸速率,减少对光合产物的消耗,表现出一定的抗盐性;而NaCl浓度≥0.6%时,幼苗的Pnmax、Rd、LSP和AQY大幅下降,这可能是过高的盐分使大量的Na+进入类囊体膜中,抑制PSI和PSII的活性,从而使光合器官的结构和功能受到破坏[29]。
3.3 盐胁迫对裸果木幼苗叶片叶绿素荧光参数的影响
叶绿素荧光参数对盐胁迫十分敏感,在反映光系统对光能的吸收、传递、分配、耗散和转换等方面起着重要的作用,被视为是研究植物光合作用与环境胁迫之间关系的内在探针[30-31]。Fv/F0和Fv/Fm分别表征PSII反应中心的潜在活性和PSII反应中心的最大光化学效率[32]。研究发现,光合作用受伤害的最原初部位与PSII紧密联系,叶绿体光合机构在高盐浓度下易被破坏,导致PSII原初光能光化学效率和PSII潜在活性受到抑制[33]。本试验也发现,裸果木幼苗叶片Fv/F0和Fv/Fm均随着NaCl胁迫浓度的增加而降低,这表明NaCl胁迫使叶片发生了光抑制,用于光化学反应的光能减小。试验结果与刘建新等[34]在黑麦草(Lolium perenne)上的研究结果一致。
正常条件下,植物能有效调节光能,维持自身正常生命活动;而环境胁迫使植物叶片气孔关闭,光合作用受阻,引起PSII与光电子需求失衡[35]。本试验中,裸果木叶片ΦPSII、qp和ETR均随着NaCl浓度的增加呈显著下降趋势,这说明NaCl胁迫下,裸果木叶片捕获的光能用于光化学反应比例降低,而转化为热能消耗的比例升高,从而导致光合作用可利用能量下降;但同期NPQ在盐胁迫≤0.6%时较对照高,而当NaCl浓度≥0.8%时显著下降,说明在低盐胁迫下叶片可以通过增加PSII反应中心非辐射热能量耗散来减轻光合机构的伤害,而高盐胁迫下PSII反应中心光合机构严重受损,本试验结果与唐玲等[36]在鸡爪槭(Acer palmatum)上的研究结果一致。
4 结论
1)盐胁迫降低了裸果木幼苗叶片的净光合速率、蒸腾速率、气孔导度和水分利用效率,低浓度盐胁迫(NaCl≤0.4%)下,叶片净光合速率和蒸腾速率下降不明显,使瞬时水分利用效率提高,主要是受气孔限制的影响,表现出一定耐盐性。随着盐浓度的增加,非气孔限制成为影响其光合速率下降的主要因子;2)NaCl浓度≥0.6%时,裸果木最大光合能力显著下降,光能利用范围明显缩小,PSII潜在活性、最大光能转化效率和光合电子传递均受到明显抑制,且盐胁迫程度越大,光合机构受损越严重。
