Mg掺杂UiO-66的制备及其塑料油品脱氯性能
2023-02-27翟永怡李瑞丽卜禹豪姬娅茹
翟永怡,李瑞丽,卜禹豪,姬娅茹
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
0 前言
废旧塑料制品对环境具有较大危害,其降解周期长,且燃烧后会产生大量有害物质。随着对废旧塑料制品的研究,人们发现废旧塑料热值较高,运用一定的技术及手段可使其重新利用[1-2]。塑料裂解是1个可逆过程,可以将石油化工原料制成的塑料制品通过裂解技术转化为燃料油[2-5]。现阶段聚氯乙烯塑料在市场的应用仍较为广泛,而聚氯乙烯与混合塑料分离十分困难[3-7]。高氯含量的油品燃烧时易产生有毒物质,且在二次加工过程中易转化成氯化氢而对后续加工过程使用的催化剂和设备产生严重危害[5-7]。目前,吸附脱氯法因其操作条件温和、生产成本低、脱氯效果好而被认为是最有前途的方法之一[8-12]。金属有机骨架材料(MOF)具有成本低、热稳定性好、比表面积大、吸附性能好等优点,已广泛应用于吸附、分离和催化等方面[13-14]。李瑞丽等已探讨过MOF在吸附脱氯方向具有很好的应用前景[8]。相比其他MOF,UiO-66 MOF表现出相对较高的热和化学稳定性,具有较高的分解温度和耐酸性(pH<2),且框架稳定[14]。据报道,掺杂金属对UiO-66材料改性是提高其吸附能力的有效方法。例如,苏婷[15]采用过渡金属改性UiO-66提高了吸附四环素性能。Niu等[16]用硝酸锂乙醇溶液浸渍UiO-66 制备了Li-UiO-66吸附剂,表现出了极高的CO2吸附能力和CO2/N2选择性。Yanga等[17]合成了锰掺杂UiO-66吸附剂,对废水处理具有良好的吸附能力。由此看来,金属掺杂改性UiO-66材料在吸附脱氯领域具有广阔的应用前景。
本文采用溶剂热法成功合成了1种新型掺镁UiO-66吸附剂,对吸附剂进行表征。通过循环实验评价了吸附剂吸附性能和再生性能。此外,通过吸附动力学、吸附热力学和吸附等温线等实验研究了有机氯化物在材料上的吸附行为以及吸附机理的推测。
1 实验部分
1.1 主要原料
1,4-对苯二甲酸(H2BDC)、八水氧化氯锆,分析纯,阿拉丁试剂(上海)有限公司;
硝酸镁、N,N-二甲基甲酰胺(DMF)、醋酸、甲醇,分析纯,天津市福晨化学试剂厂;
正十二烷、四氯化碳、三氯乙烯、四氯乙烯、1,2,4-三氯苯,分析纯,北京化工厂;
氯含量测定用标准物质,标准浓度20.0 mg/L,石油化工科学研究院;
实验用水为去离子水,实验室自制。
1.2 主要设备及仪器
XRD,XD-3A,日本岛津公司;
FTIR,EQUINOX55,德国布鲁克公司;
SEM,SU8010,日本日立公司;
微库仑综合分析仪,WK-2D,江苏江分电分析仪器有限公司。
1.3 样品制备
采用简单的溶剂热法制备金属掺杂UiO-66吸附剂;称取一定量Mg(NO3)2、八水氧化氯锆(0.644 4 g,2 mmol), DMF 120 mL, 醋酸15.5 mL,放入超声仪中浸泡0.5 h;待固体完全溶解,溶液清澈后,加入0.372 7 g对苯二甲酸,超声20 min,转移到150 mL聚四氟乙烯压蒸釜中,120 ℃反应24 h;反应完成后,固体产物用DMF和甲醇过滤洗涤3~5次;在真空烘箱中150 ℃离心干燥12 h后,得到最终产物M-UiO-66-n( M为金属,n=0.05、0.07或0.10,表示掺杂镁与锆的摩尔比);为了进行比较,在上述方法的基础上制备了不掺杂金属的UiO-66。
1.4 性能测试与结构表征
X射线衍射分析:Cu-Ka辐射(40 kV,40 mA),吸附剂的扫描范围为5°至60°;
FTIR分析:KBr用于压片,扫描范围为400~4 000 cm-1;
吸附实验:采用静态吸附法进行,选取4种塑料裂解油中典型的有机氯化物;将 CCl4、C2HCl3、C2Cl4和C6H3Cl3按氯含量质量浓度比为1/1/1/1溶解于正十二烷中,得到氯含量为400 mg/L模型油[11];用微库仑仪测定了模型油中有机氯化物的质量浓度;有机氯在模拟油中的脱氯率(R,%)按式(1)计算,有机氯平衡吸附量(Qe,mg/g)按式(2)计算[8]:
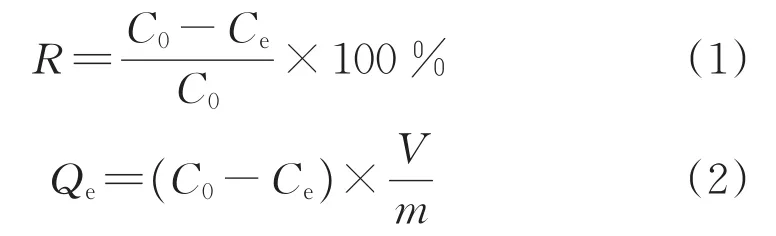
式中C0——模拟油中有机氯化物在初始时的质量浓度,mg/L
Ce——模拟油中有机氯化物在吸附平衡时的质量浓度,mg/L
V——吸附模拟油体积,L
m——吸附剂质量,g
吸附剂吸附性能评价:为考察吸附剂的重复使用性能,将吸附试验后的吸附剂用100 mL甲醇洗涤3次,真空干燥,得到脱附再生的吸附剂;在优化的吸附条件下,用再生吸附剂吸附脱除模拟油中的氯化物,考察再生吸附剂的重复使用性能。
2 结果与讨论
2.1 吸附剂的优选
文献显示,金属源的掺杂比例不同,会对吸附结果有不同的影响[18]。因此,分别制备Mg与Zr摩尔比分别为0.05、0.07和0.10 的Mg-UiO-66对模拟油进行吸附脱除实验,结果见图1。可以看出,在掺杂金属时,不同摩尔比的金属含量均会影响吸附剂对有机氯的吸附效果,当Mg与Zr摩尔比为0.07时,吸附剂对有机氯化物的吸附效果最好。随着掺杂Mg的浓度的不断提升,吸附效果逐渐下降,其原因是过量掺杂的Mg导致孔径变得狭窄,甚至引起堵塞,这使得材料比表面积以及微孔体积减小,进而对有机氯化物的吸附产生不利影响[18-19]。
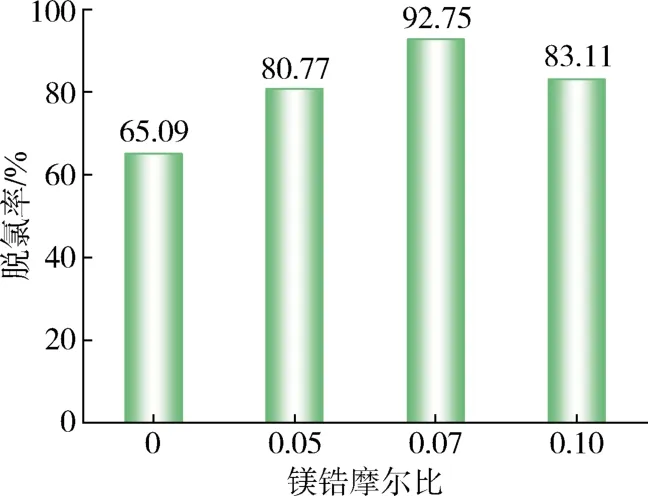
图1 掺杂不同镁锆摩尔比吸附剂吸附效果对比Fig.1 Comparison of adsorption effects of adsorbents doped with different molar ratio of magnesium to zirconium
2.2 吸附剂的表征
2.2.1 X射线衍射分析
UiO-66和Mg-UiO-66-n样品的XRD谱图如图2所示。当Mg掺杂到UiO-66中时,其主衍射峰的行为与UiO-66相似,且未发现Mg物种的衍射峰,这说明掺杂Mg的负载较低,分散性较高。此外,Mg掺杂没有引起UiO-66晶体的相变。随着Mg-UiO-66-n中Mg含量的增加,特征峰强度逐渐减小。说明掺杂的Mg元素可以合并到 UiO-66[18]的晶格中。
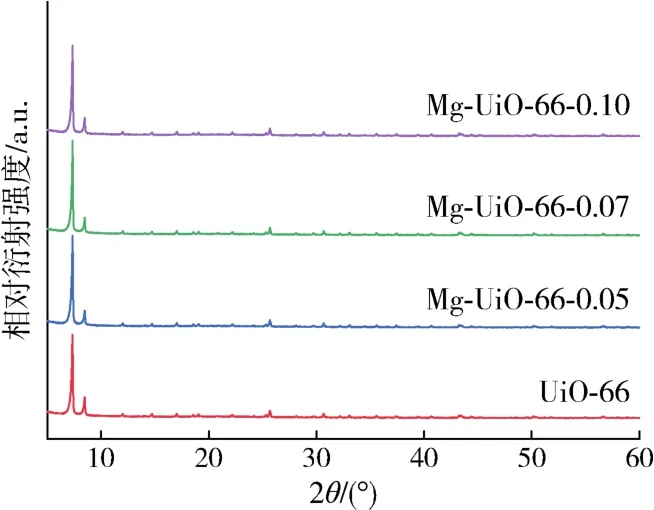
图2 不同吸附剂的XRD谱图Fig.2 XRD patterns of different adsorbents
2.2.2 红外分析
UiO-66和Mg-UiO-66-0.07的FTIR谱图如图3所示。3 400 cm-1处的强峰是由材料内部结晶间水的凝结和物理吸附水造成的。H2BDC配体中OH和CH振动引起的特征峰出现在 745 cm-1和 668 cm-1处。在552 cm-1处产生的特征峰揭示了Zr—(OC)的不对称拉伸振动[20]。在1 577 cm-1和 1 400 cm-1处的 2个锐带可以归因于结构中的羧酸基团[21]。在1 505 cm-1处的峰值对应苯环中C=C的典型振动。结果表明,Mg的掺杂对UiO-66的骨架没有影响[22]。
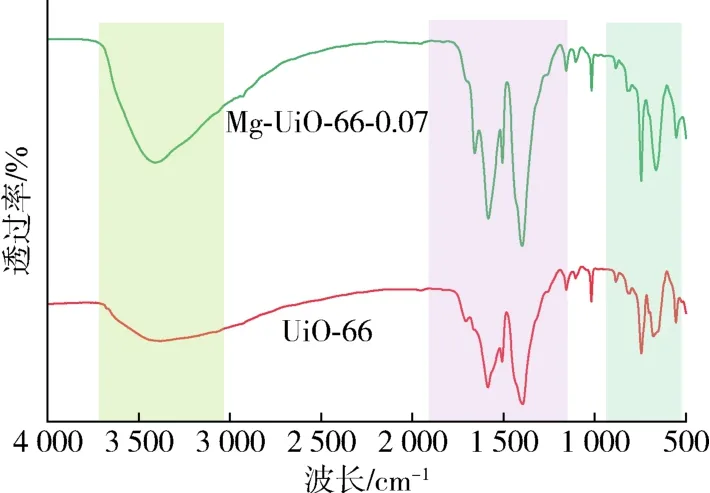
图3 不同吸附剂的FTIR谱图Fig.3 FTIR spectra of different adsorbents
2.2.3 SEM分析
图4为UiO-66和Mg-UiO-66-n的场发射SEM照片和Mg-UiO-66-0.07的能谱(EDS)图。纯UiO-66粒子的形状为正八面体。随着Mg掺杂量的增加,得到的Mg-UiO-66-n和UiO-66呈现出了相同相貌,均为八面体,但明显平均粒径变小和更好的分散性[图7(a)~(d)][19,23]。这是因为掺杂镁对 UiO-66进行改性时,其表面的部分有机连接剂溶解,Mg2+逐渐取代Zr4+与有机配体结合进入UiO-66材料中,形成了体积更小的Mg-UiO-66-n[19]。通过 SEM 获得了 Mg-UiO-66-0.07的EDS元素映射谱,结果表明C、O、Zr和Mg元素均匀分布在骨架上[22-24]。

图4 不同吸附剂的SEM照片和Mg -UiO-66-0.07的EDS图像Fig.4 SEM images of different adsorbents and EDS images of Mg-UiO-66-0.07
2.3 模拟油吸附脱氯条件的优化
2.3.1 氯化物初始质量浓度的影响
在吸附时间为4 h、吸附温度为40 ℃和剂油比为1/40的条件下,有机氯化物初始质量浓度对氯化物平衡吸附量的影响如图5所示。随着有机氯化物初始浓度的增加,Mg-UiO-66-0.07的吸附量也增大。由此可见,初始浓度是克服溶质在油-固相之间传质阻力的重要动力[24]。
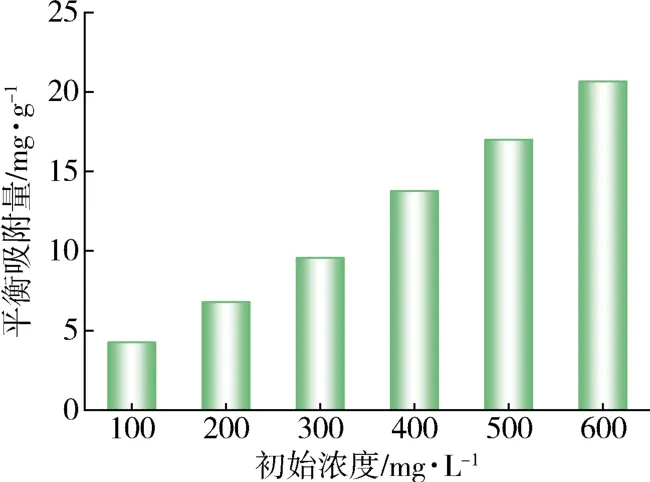
图5 有机氯化物初始浓度的影响Fig.5 Effect of initial concentration of organic chloride
2.3.2 吸附时间的影响
在吸附温度为40 ℃、剂油比为1/40的条件下,考察吸附时间对脱氯效果的影响。如图6所示,0~4 h,脱除率不断增大,而超过4 h后,脱除率达到95.03 %后基本不变。吸附过程主要分为3个阶段,在第一阶段,吸附过程主要发生在吸附剂的外表面活性位上;在第二阶段,氯化物缓慢扩散至吸附剂内部,因此该阶段吸附时间较长;在第三阶段,吸附过程达到平衡[8,24]。随着吸附过程的进行,有机氯化物逐渐占据吸附剂Mg-UiO-66-0.07表面的活性位点[25]。因此,最佳吸附时间为4 h。
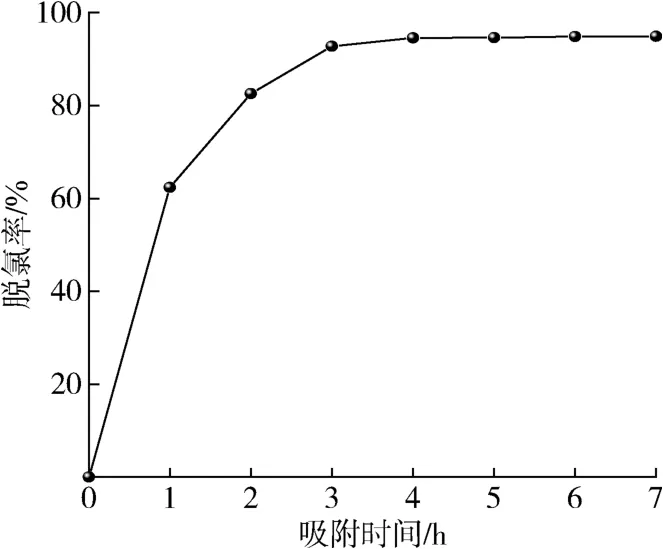
图6 吸附时间的影响Fig.6 Effect of adsorption time
2.3.3 吸附温度的影响
在吸附时间4 h、剂油比为1/40的条件下,考察吸附温度对脱氯效果的影响。如图7所示,脱除率与温度呈正相关趋势,在温度的升高的情况下脱除率也随之增加,该现象表明温度升高对吸附剂吸附有机氯化物有利[26]。由于温度越高导致能耗增加越多,而有机氯化物吸附率在吸附温度高于40 ℃时呈现较平和趋势,无大幅度增加,因此确定最佳吸附温度为40 ℃。
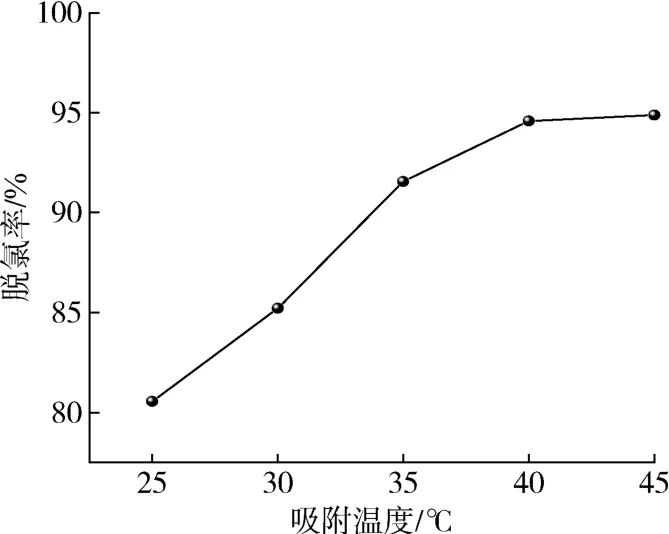
图7 吸附温度的影响Fig.7 Effect of adsorption temperature
2.3.4 剂油比的影响
在吸附温度为40 ℃、时间4 h的条件下,考察剂油比对脱氯效果的影响,实验结果如图8。脱除率随剂油比的增加呈现先增大后减小的趋势,其原因是吸附效率主要受有效吸附位点的数量影响,在使用较少吸附剂用量时,提供的活性位点数量较少,从而限制了高效吸附[11];而使用过多吸附剂时,会引起吸附剂之间的团聚,导致活性位点重叠,这将造成部分活性位点的浪费,使得吸附效率降低[8,18,27]。因此,当剂油比为 1/40时,吸附剂的效率最高。
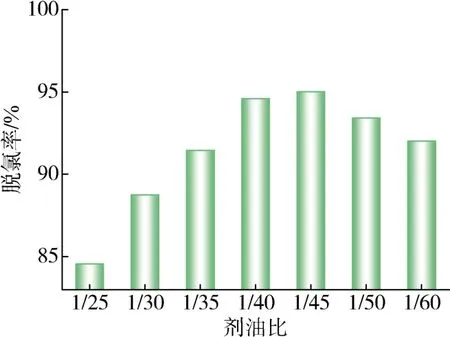
图8 剂油比的影响Fig.8 Effect of agent oil ratio
2.3.5 Mg-UiO-66-0.07的再生
吸附剂的稳定性和可回收性在吸附过程中起着重要作用。从图9可以看出,在5次吸附再生循环后,吸附剂Mg-UiO-66-0.07对有机氯化物的去除效率有所下降,依次为 95.03 %,94.66 %,93.95 %,93.35 %,92.89 %,这是由于有机氯化物在解吸后依旧吸附在吸附剂孔道中。但去除率仍高达90 %以上,说明Mg-UiO-66-0.07吸附剂具有良好的可重用性。吸附剂使用前后的XRD谱图分析结果如图10所示。可以看出,Mg-UiO-66-0.07的峰值位置在使用前后没有变化,但使用后强度有所下降,表现出良好的稳定结构[20]。以上结果表明Mg-UiO-66-0.07具有良好的吸附稳定性和再生性。
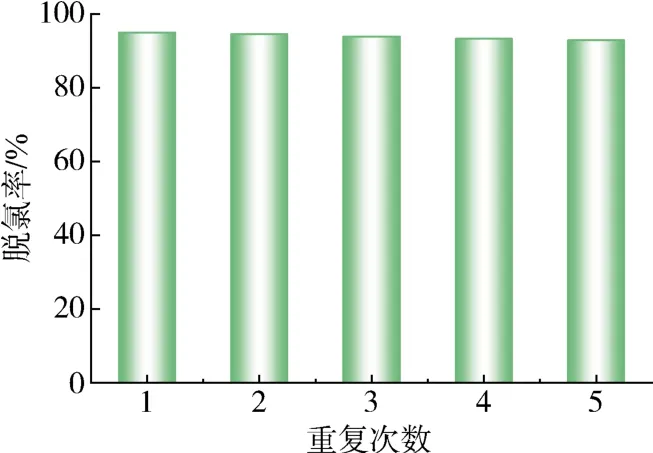
图9 Mg-UiO-6-0.07对有机氯化物的再生吸附性能Fig.9 Regencration adsorption performance of Mg-UiO-66-0.07 for organic chlorides
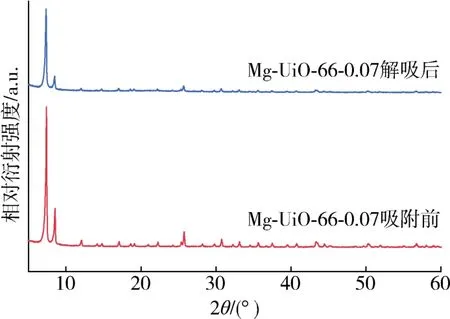
图10 Mg-UiO-66-0.07吸附前与解吸后XRD谱图对比Fig.10 Comparison of XRD patterns of Mg-UiO-66-0.07 before adsorption and after desorption
2.4 吸附动力学研究
本研究采用式(3)所示的拟一级动力学模型和式(4)所示的拟二级动力学模型,考察了Mg-UiO-66-0.07吸附剂对有机氯化物CCl4、C2HCl3、C2Cl4、C6H3Cl3的吸附动力学和吸附途径:
式中qe——平衡吸附量,mg/g
qt——t时吸附量,mg/g
t——吸附时间,min
k1——拟一级吸附动力学吸附常数,1/min
k2——拟二级吸附动力学吸附常数,g/(mg·min)
图11为Mg-UiO-66-0.07吸附剂对模拟油中有机氯的吸附拟一级和拟二级动力学模型。根据图11的信息,对拟一阶动力学模型和拟二阶动力学模型的参数进行计算,结果见表1。
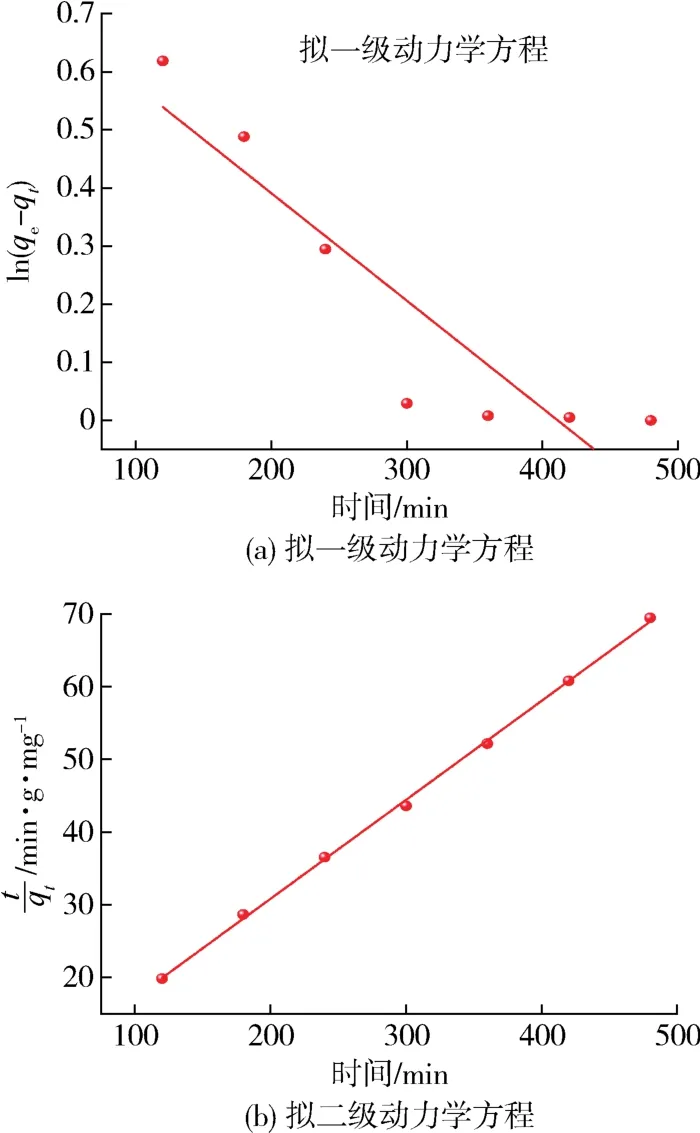
图11 动力学方程拟合曲线Fig.11 Dynamic equation fitting curves

表1 Mg-UiO-66-0.07吸附有机氯化物的拟一级、拟二级动力学参数Tab.1 Pseudo primary and pseudo secondary kinetic parameters of Mg-UiO-66-0.07 adsorption of organic chlorides
图12中的拟二级动力学模型曲线具有良好的符合性和线性相关性。而且,与拟一级动力学模型数据相比,拟二级动力学模型数据的回归系数R2明显更高,更接近于1,说明化学吸附是实验的控制步骤[28-29]。在吸附过程中,吸附剂与模拟油之间会发生电子交换或转移[29]。
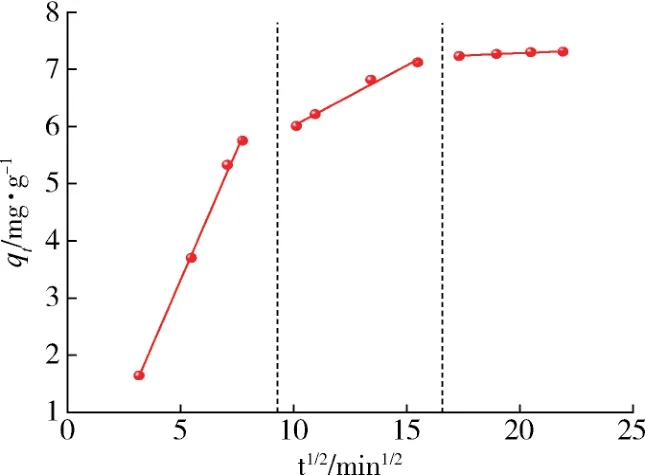
图12 颗粒内扩散模型拟合图Fig.12 Fitting diagram of particle internal diffusion model
为更好考察吸附剂对模拟油中有机氯的吸附效果影响,利用式(5)颗粒内扩散模型描述了吸附质在吸附剂颗粒中的扩散。由式(5)计算出表2中相关参数[30]:
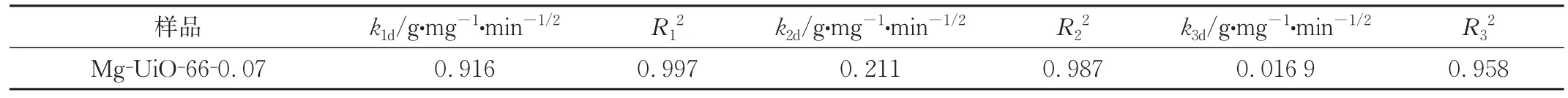
表2 Mg-UiO-66-0.07吸附有机氯化物的颗粒内扩散模型参数Tab.2 Parameters of particle internal diffusion model for Mg-UiO-66-0.07 adsorption of organic chloride

式中ki——内扩散速率常数,mg/(g·min1/2)
C——与边界层厚度有关的常数,mg/g
图12中所示,有机氯化物的颗粒内扩散由3个阶段组成,这表明了该过程包含了3个控制阶段。第一阶段的拟合曲线斜率大,再结合表2中该过程k1d>>k2d,说明初始阶段的快速吸附主要由边界层扩散控制[30]。第二阶段是有机氯化物逐渐扩散到吸附剂的孔隙中,该阶段吸附速率缓慢,为速率控制阶段,受颗粒内扩散控制。第三阶段吸附速率基本上为零,表明吸附位点饱和,为水平平衡阶段。在这一阶段,吸附质从较大的孔隙扩散到较小的孔隙,产生较小的k3d。拟合直线不经过原点,说明吸附速率的控制步骤不仅取决于颗粒内扩散,还受到颗粒外扩散和表面吸附的影响[31]。
2.5 吸附等温线的研究
为了更深入地分析有机氯化物在模拟油中的吸附方式和吸附机理,引入Langmuir和Freundlich等温线模型进行探索。Langmuir和Freundlich等温线方程如式(6)和(7)所示[32]:
式中Q0——吸附剂的最大吸附量,mg/g
KL——Langmuir平衡常数
KF——Freundlich 平衡常数
n——与温度体系有关的常数
图13为Mg-UiO-66-0.07吸附有机氯化物的Langmuir和Frundlich等温线。表3列出了2个模型的相关系数。Langmuir吸附等温线方程更适用于模拟油中有机氯化物的吸附和除去,因为该方程的R2大于Freundlich拟合方程的R2。Langmuir吸附等温线仅仅说明了在此过程中是单分子层均匀吸附的[32-33]。另外,Mg-UiO-66-0.07的kL均大于0,说明吸附过程是自发的,吸附剂对有机氯化物的亲和力很高[34]。
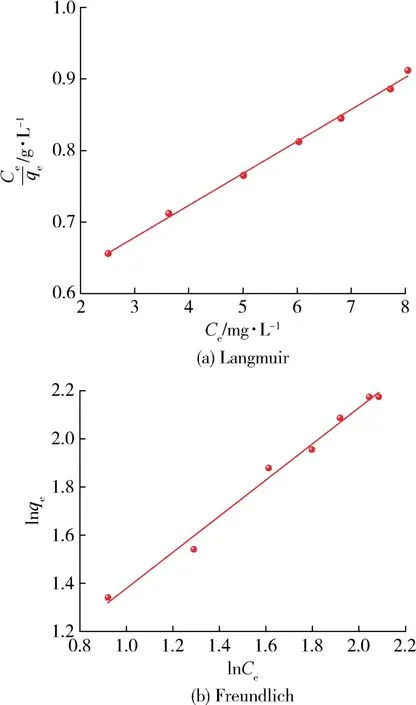
图13 Langmuir和Freundlich吸附等温线拟合曲线Fig.13 Fitting curves of Langmuir and Freundlich adsorption isotherms

表3 Mg-UiO-66-0.07在40 ℃吸附有机氯化物的吸附等温线拟合参数Tab.3 Fitting parameters of adsorption isotherm of Mg-UiO-66-0.07 adsorbing organic chloride at 40 ℃
2.6 吸附热力学研究
为了进一步揭示模拟油中有机氯化物在吸附剂上的吸附机理,对吸附热力学进行了研究。根据不同温度下模拟油中有机氯化物在吸附剂上的吸附等温线,见图14,计算了吸附吉布斯自由能(ΔG,kJ/mol)、焓变(ΔH,kJ/mol)和熵变[ΔS,J/(mol·K)]等热力学参数见表4。3个热力学参数的关系如式(8)、式(9)所示[35]:
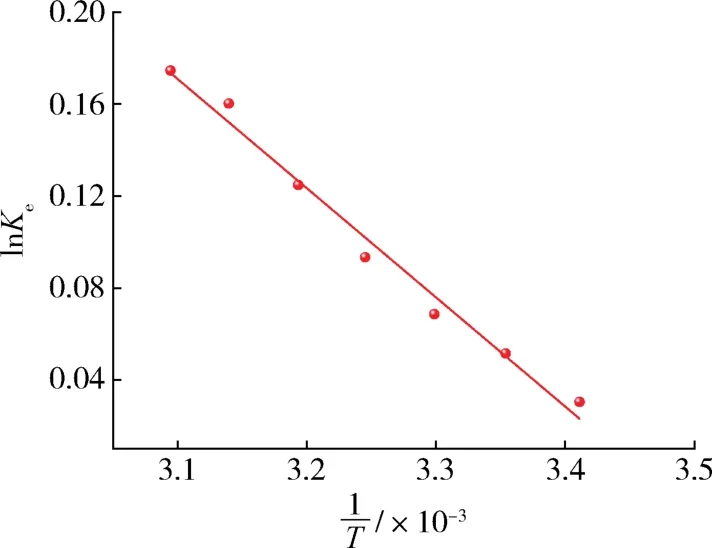
图14 热力学方程拟合曲线Fig.14 Thermodynamic equation fitting curve

表4 Mg-UiO-66-0.07在40 ℃吸附有机氯化物的热力学曲线拟合参数Tab.4 Thermodynamic curve fitting parameters of Mg-UiO-66-0.07 adsorption of organic chloride at 40 ℃
式中Ke——吸附平衡常数
ΔG——吉布斯自由能,kJ/mol
R——气体摩尔常数,8.314 J/(mol·K)
T——吸附温度,K
表4所示ΔG值均为负值,说明吸附过程的自发性,进一步说明吸附过程的可行性[33]。ΔH均大于零,说明吸附过程为吸热反应[35]。另外,ΔS是正值表明体系的无序程度增加[31]。
2.7 吸附机理的推测
Mg-UiO-66-0.07具有良好的脱氯性能可能基于以下几种原因[12,36]:(1)Mg-UiO-66-0.07是1种多孔材料,其对氯化物有物理吸附作用;(2)由动力学研究可知,Mg-UiO-66-0.07在对氯化物的吸附过程中化学吸附占主导作用,其机理是有机氯化物被吸附在吸附剂表面或孔道中,C—Cl键断裂,有机氯转化成无机氯,同时生成对应的烃类[37]。可能的反应方程式如式(10)~(12)所示,可能的机制如图15所示[38-39]。
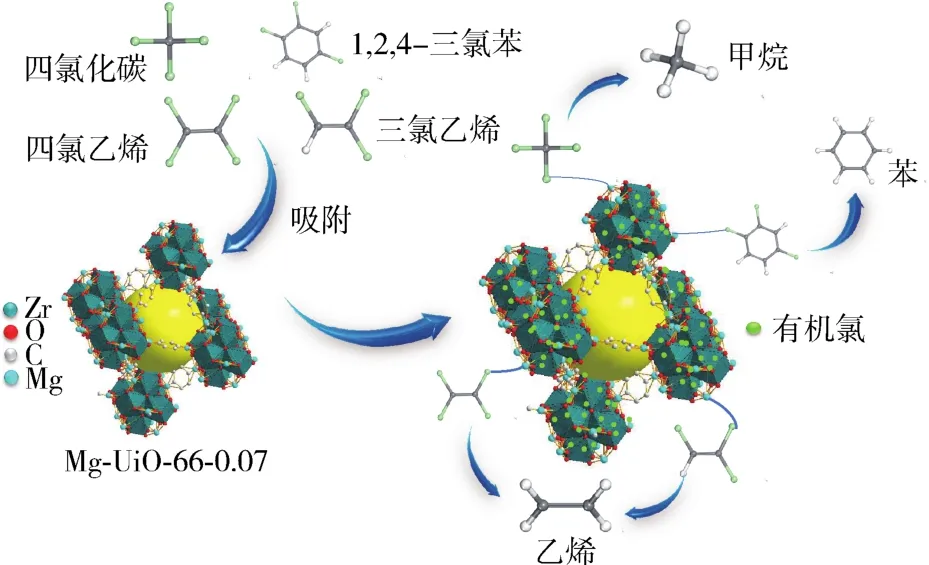
图15 吸附脱除氯化物的可能机理Fig.15 Possible mechanism of chloride removal by adsorption
3 结论
(1)通过金属掺杂改性后,UiO-66没有发生相变;掺Mg改性大大提高了其吸附性能;Mg-UiO-66-0.07的吸附性能受有机氯化物初始浓度、吸附时间、温度、剂油比的影响;最佳的吸附条件为吸附4 h,40 ℃,剂油比1/40,在此条件下,Mg-UiO-66-0.07对有机氯化物的脱除率高达95.03 %;
(2)吸附剂具有良好的吸附再生性能,经过5次脱氯再生循环后,Mg-UiO-66-0.07的脱氯性能仅略有下降,但仍在90 %以上;
(3)Mg-UiO-66-0.07吸附有机氯化物过程符合拟二级反应动力学模型和Langmuir吸附等温模型,化学吸附在有机氯化物吸附过程中占主导地位,Mg-UiO-66-0.07吸附剂具有均匀的吸附表面;模拟油中的有机氯化物在Mg-UiO-66-0.07上的吸附是自发的、吸热的。
