Rho相关卷曲螺旋蛋白激酶1在动脉粥样硬化血管壁中的表达及其与基质金属蛋白酶2及转化生长因子1的相关性
2023-02-27杨雅雯夏敏吴芬宋梦星陆文烨马占龙
杨雅雯,夏敏,吴芬,宋梦星,陆文烨,马占龙
(南京医科大学第一附属医院放射科,南京 210029)
动脉粥样硬化(atherosclerosis, AS)相关心血管事件如急性冠脉综合征、心肌梗死、脑卒中等在发达国家和发展中国家均有较高的致死率,预防AS患者急性心血管事件的发生对于提高患者生存率具有重要意义。Rho相关卷曲螺旋激酶(Rho associated coiled-coil forming protein kinase, ROCK)是三磷酸乌苷(guanosine triphosphate, GTP)结合蛋白家族分子RhoA的主要下游调节蛋白。研究报道,RhoA/ROCK通路的激活与心血管疾病如冠状动脉痉挛、高血压、动脉粥样硬化、动脉瘤等的发病、进展和预后密切相关。ROCK分为ROCK1和ROCK2,其中ROCK1被认为与心血管病理性纤维化、高血压、糖尿病等密切相关[1,2]。基质金属蛋白酶(matrix metalloproteinase,MMP)是一类能降解细胞外基质的酶,其上调导致胶原蛋白缺失发生AS斑块破裂、主动脉瘤、主动脉夹层等急性事件[3],其中2型MMP在血管平滑肌细胞(vascular smooth muscle cell,VSMC)中表达较为丰富。转化生长因子β1(transforming growth factor-β1,TGF-β1)促进细胞外基质沉积,在心肌纤维化和血管硬化方面有重要作用。
既往研究证明,冠状动脉痉挛患者外周白细胞中的Rho激酶活性增加[4],急性心肌梗死患者的MMP水平显著高于稳定型心绞痛患者[5],TGF-β1可导致动脉粥样硬化血管壁纤维化增厚及管腔狭窄,三者均参与到心血管不良事件。但ROCK1在动脉粥样硬化发生及发展过程中血管壁的表达及其与MMP2及TGF-β1的相关性尚未见详细研究报道。本次实验通过建立动脉粥样硬化动物模型,研究ROCK1在动脉粥样硬化血管壁中的表达特点及其与MMP2、TGF-β1的相关性,为急性心血管事件的预防提供新思路。
1 材料与方法
1.1 材料与仪器
SPF级雄性ApoE基因敲除小鼠,6周龄,体质量18~20 g,购自北京维通利华研究动物技术有限公司。野生型C57BL/6小鼠,6周龄,体质量18~20 g,购自南京医科大学动物研究中心。高脂饲料(含1.25%胆固醇)由南京协同医药生物工程公司提供。ROCK1抗体、MMP2抗体、TGF-β1抗体由北京博奥森生物技术有限公司提供,使用全自动生化分析仪(Chemray 240,深圳雷杜生命科技)测量血脂,使用光学显微镜及成像系统(eclipse Ci-e,日本尼康)观察病理标本。本实验得到实验伦理委员会批准。
1.2 建立动脉粥样硬化动物模型
实验组为30只ApoE基因敲除小鼠,高脂饲料喂养;对照组为30只C57BL/6小鼠,普通饲料喂养。2组分别于喂养的第10、16、22、28及34周测量血脂并取主动脉标本观察血管斑块形成情况。
1.3 实验方法
在监测时间点,实验组和对照组各随机选取5只小鼠,腹腔注射10%水合氯醛(5 ml/kg),麻醉生效后取眼球血测量血脂水平,之后过量麻醉处死小鼠,从主动脉弓至主动脉降部取1~1.5 cm主动脉作为标本,用生理盐水及磷酸盐(phosphate buffered saline,PBS)缓冲液反复冲洗标本,至表面无明显杂质残留之后,置于4%多聚甲醛溶液固定,常规石蜡包埋切片,片厚约4 μm。每个标本取3张切片做苏木精-尹红(hematoxylin-eosin,HE)染色,普通光镜下观察血管壁情况,若显示有斑块形成,则另取相应标本的切片做ROCK1、MMP2、TGF-β1单抗免疫组化染色(各3张),光学显微镜观察蛋白表达分布情况。
1.4 HE染色和免疫组化染色及相关指标定量
HE染色:石蜡切片脱蜡至水,入苏木素染色3~5 min,水洗反蓝,伊红液染色5 min,无水乙醇脱水,封片晾干,光学显微镜下观察,细胞核为蓝色,细胞质为红色。使用Image Pro Plus 6.0软件测量血管壁厚度、斑块面积、血管腔面积及斑块面积/血管腔面积。
免疫组化染色:石蜡切片脱蜡至水,入柠檬酸抗原修复缓冲液中进行抗原修复,PBS洗涤,入3%双氧水阻断内源性过氧化物酶,PBS洗涤,每张切片加一抗覆盖组织(一抗稀释度均为1∶200),PBS洗涤,洗后加二抗,PBS洗后再加二氨基联苯胺(diaminobenzidine,DAB)显色溶液,控制显色,苏木素复染细胞核,水洗返蓝,脱水封片晾干,光学显微镜下观察,细胞核为蓝色,DAB显出的阳性表达为棕黄色。使用Image Pro Plus 6.0软件计算免疫组化切片中阳性表达区的面积和相对灰度值(单位面积中的平均光密度值,作为免疫组化结果定量依据)。
1.5 统计学处理

2 结 果
2.1 2组小鼠血脂水平变化
在各个监测点上,与对照组相比,实验组的胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平明显升高,差异有统计学意义(P<0.05);与对照组相比,实验组的甘油三酯(triglyceride, TG)水平逐渐升高,但差异无统计学意义(P>0.05)。在第28与34周,实验组的高密度脂蛋白胆固醇(high-density lipoprotein cholesterol , HDL-C)水平明显高于对照组,差异有统计学意义(P<0.05;表1)。

表1 不同时期各组小鼠血脂水平
2.2 2组小鼠腹主动脉血管壁组织形态变化
对照组小鼠腹主动脉血管内均无斑块形成,血管壁结构正常。实验组小鼠在第10周见血管内膜局部隆起,内皮下脂质沉积,第16~34周均见主动脉管壁局部增厚,血管内均有斑块形成,在第34周最明显(图1)。随着饲养时间延长,血管壁厚度逐渐增加,斑块面积逐渐增大,斑块面积/管腔面积逐渐增大,差异均有统计学意义(P<0.05);喂养过程中,小鼠血管腔面积未见明显变化,差异无统计学意义(P>0.05;表2)。
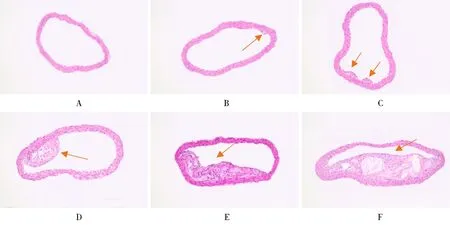
图1 2组小鼠腹主动脉血管壁形态学变化
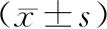
表2 实验组小鼠主动脉血管壁厚度及斑块情况
2.3 2组小鼠ROCK1的免疫组化结果
2组小鼠ROCK1免疫组化结果比较,对照组血管壁ROCK1的表达较少,主要集中在细胞核;实验组血管壁局部及斑块内均有较多的ROCK1表达,主要集中在斑块肩部及斑块侧的血管壁(图2,图3)。
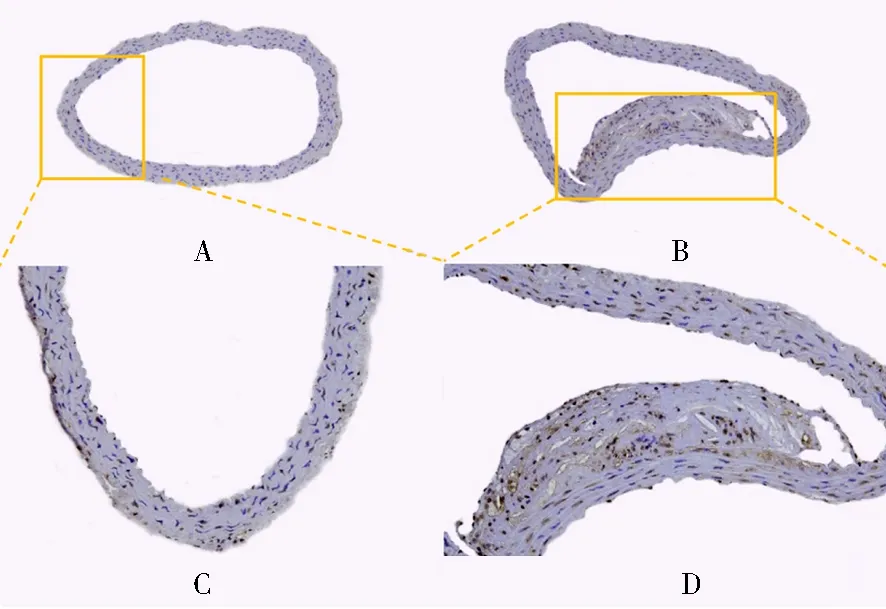
图2 2组小鼠ROCK1免疫组化结果
2.4 实验组不同时期ROCK1、MMP2及TGF-β1的表达和分布
不同时期血管壁斑块内均有ROCK1、MMP2及TGF-β1的表达,随着饲养时间延长,斑块内ROCK1、MMP2、TGF-β1表达均呈上升趋势,ROCK1的表达水平稍高于MMP2、TGF-β1的表达(图3)。
图3 实验组ROCK1、MMP2及TGF-β1免疫组化结果
2.5 实验组不同时期ROCK1、MMP2及TGF-β1表达与斑块面积的相关性
使用Image Pro Plus 6.0软件计算不同时期ROCK1、MMP2及TGF-β的表达量,采用线性相关分析三者与斑块面积的相关性。结果显示,建模过程中,ROCK1、MMP2、TGF-β1的表达与斑块面积呈正相关(r=0.979,0.801,0.720;P<0.01;图4)。Pearson相关与线性回归分析结果显示:ROCK1与MMP2、TGF-β1呈显著正相关(r=0.801,0.906,P<0.05;R=0.582,0.790,P<0.05)。
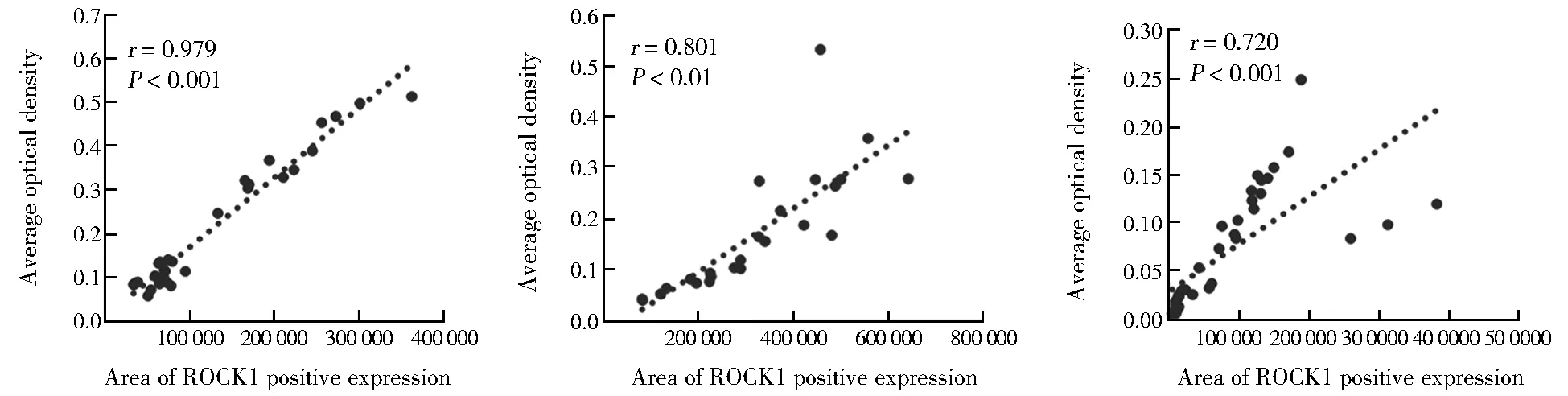
图4 实验组不同时期ROCK1、MMP2及TGF-β1表达与斑块面积的相关性
3 讨 论
动脉粥样硬化相关的心血管事件在全世界范围有着较高的发病率和死亡率[6],识别高风险AS患者对提高其生存率具有重要意义。本实验通过建立动脉粥样硬化模型研究ROCK1在动脉粥样硬化血管壁中的表达及其与MMP2、TGF-β1的相关性。
ROCK1是小GTP酶蛋白RhoA最重要的下游蛋白,血管壁中ROCK1过度激活会促进平滑肌细胞收缩和血管内皮源性舒张因子合成减少,继而导致血管痉挛[4]。研究显示,ROCK1导致的血管壁肌球蛋白轻链磷酸化的程度与冠状动脉痉挛的程度呈显著正相关[7],使用Rho激酶抑制剂能有效降低稳定型心绞痛患者的发作频率和减轻血管痉挛性心绞痛患者的冠状动脉血管痉挛[8]。可见,ROCK1蛋白是一种痉挛性收缩异常蛋白。此外,RhoA/ROCK1通路激活与高血压、糖尿病、肥胖症等目前世界公认的动脉粥样硬化高危因素有密切关系[9-11]。ROCK1激活导致血管内膜功能障碍、VSMC增殖迁移和表型转化、血管外膜炎症反应、泡沫细胞形成等,ROCK1被认为是促炎和促动脉粥样硬化分子。本研究结果显示,与正常血管壁相比,AS血管壁ROCK1蛋白表达水平较高,主要分布在斑块的肩部及斑块侧的血管壁中,提示动脉粥样硬化血管壁可能易于发生痉挛,随着斑块面积不断增大及血管壁逐渐增厚,ROCK1表达也增多,两者呈明显正相关,说明ROCK1可能促进动脉粥样硬化的进展。
ROCK在心脏纤维化和脉管系统的硬化方面发挥重要作用。ROCK通过调控细胞内应力纤维聚合促进纤维化相关信号途径如心肌素相关转录因子(myocardin-related transcription factor,MRTF)/血清应答因子(serum response factor,SRF)、Yes相关蛋白(Yes associated protein,YAP)/转录共激活因子PDZ结合基(transcriptional co-activator with PDZ-binding motif,TAZ)/TEA结构域转录因子(TEA domain transcription factor,TEAD)激活[12]。细胞因子TGF-β1是心血管纤维化过程的重要介质,其促纤维化作用包括经典及非经典通路。经典途径即TGF-β1磷酸化下游转录激活因子Smad2/3进而促进纤维化基因表达,抑制ROCK活性能抑制经典途径。非经典途径即TGF-β1通过激活ROCK1来调节F-肌动蛋白的聚合驱动相关基因表达[12]。可见,ROCK能独立也能与TGF-β1通路相互作用来促进心血管纤维化过程[12,13],ROCK抑制剂表现出抗重塑的作用[14]。
MMP是一组可以降解细胞外基质成分的蛋白酶类,其中MMP2主要降解胶原蛋白和弹性蛋白,尤其是纤维帽的基质成分,导致纤维帽变薄进而发生斑块破裂、血栓形成、心肌梗死等严重心血管事件[15]。主动脉瘤与血管壁炎症及高活性MMP有密切关系[16],使用Rho激酶抑制剂能显著抑制VSMC分泌MMP2,减少主动脉瘤形成[5],可能是ROCK1通过调节细胞中肌动蛋白的形成进而激活细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/P38丝裂原活化蛋白激酶家族(mitogen-activated protein kinase,MAPK)通路,促进MMP2的分泌。
本实验研究发现,与正常血管壁相比,AS血管壁中ROCK1表达水平更高,且随血管壁厚度及斑块面积增大而不断增高,同时ROCK1的表达与MMP2、TGF-β1的表达呈正相关。实验证明动脉粥样硬化小鼠血管壁中存在ROCK1蛋白的异常表达,ROCK1、MMP2、TGF-β1三者可能共同促进AS的进展,但具体机制需进一步研究。鉴于ROCK1蛋白的致血管痉挛作用,本实验结果提示动脉粥样硬化斑块可能容易发生痉挛,且在AS晚期痉挛风险可能更高。研究AS血管壁中ROCK1的活性对于提高AS患者的生存率具有重要意义。未来研究或许可以将ROCK1活性作为AS患者预后结果的生物标志物[17],或者应用分子影像学的知识制备特异性靶向ROCK1探针,根据血管壁局部磁共振信号的改变推算出ROCK1含量,对AS患者进行危险分层与预后评估,以便更好地预防急性心血管事件的发生,但这仍然需要进行大量长期的临床研究。
