基于高密度传感器的舌癌组织边界三维电阻抗成像方法
2023-02-26胡松佩徐德洪李彦刘凯韩伟姚佳烽
胡松佩 徐德洪 李彦 刘凯 韩伟 姚佳烽*
1(南京航空航天大学机电学院,南京210016)
2(南京工业职业技术大学,南京 210023)
3(南京大学医学院附属口腔医院,南京 210008)
口腔舌癌是头颈部常见的恶性肿瘤之一,恶性程度高,大多表现为口舌鳞状细胞癌(Oral tongue squamous cell carcinoma,OTSCC)。近年来,18~44 岁的年轻个体OTSCC 的发病率呈上升趋势,年轻女性OTSCC 的年度变化百分比显著增加[1]。吸烟与酗酒是舌癌最常见的诱因,相较于吸烟与酗酒,大约60%~70%的舌癌都与人乳头瘤病毒(Human papilloma virus,HPV)感染有关[2]。由于HPV 的流行,HPV感染近年也成为了舌癌发病的主要诱因之一,舌癌的发病率显著增加[3]。
目前,舌癌最常见的治疗方法有手术治疗、化疗[4]与光热疗[5]等方法,其中,手术治疗是依靠组织病理学诊断及病变大小完整地切除癌组织,是舌癌的主要治疗方法[6]。癌组织切除不完整会导致舌癌二次复发,降低患者的存活率,完整地检测出舌癌组织的边界是癌组织完整切除的前提。组织病理学诊断是舌癌手术中重要的辅助检测方法,需要临床医生切取病变组织样本,再对样本切片进行分析以观测组织是否残存癌组织,分析时间长且极大地依靠医生的诊断经验。其它辅助检测方法如核磁共振成像[7]、计算机断层成像[8]和口腔超声成像[9]等虽然能够检测出整个病变组织的全貌,但是对于肿瘤的具体边界需要富有经验的医生进行评估,实时性差、操作不便,并会对人体会产生辐射伤害。因此,有必要建立一种实时、便捷和无辐射的舌癌边界临床辅助检测方法。
电阻抗成像(Electrical impedance tomography,EIT)技术是通过被测物表面呈圆环状或方形状分布的电极以相邻激励相邻采集等激励模式向目标物激励电流,采集表面上的电压测量值,计算其二维平面的电导率分布并成像。组织发生病变时,内部细胞的生理结构、细胞数量和功能等发生巨大变化,表现出的电学特性即电导率也会有显著差异,因此,该技术可应用于生物医疗领域。Wu 等[10]提出了用于肺健康监测的EIT 成像方法,通过带有一圈16 个电极的电极绷带实现对人体肺健康状况的监测[10];Mansouri 等[11]提出了用于乳腺癌早期检测的EIT 成像方法,基于40 个电极系统与动态模式获得了最佳的成像效果;Murphy 等[12]提出了用于前列腺癌成像的EIT 检测方法,有望改善前列腺癌的诊断。
单平面电极的EIT 有很多局限性,由于电流的扩散,EIT 对电极上方和下方的区域敏感,对距离电极较远的区域不敏感,即单平面EIT 对于目标物的垂直信息不敏感[13]。许多研究者采用三维(3D)EIT 解决此问题。Wicaksono 等[14]通过将pH 转换模型(pH-Conversion model,pH-CM)集成到3D EIT 中,对胃中的酸度进行监测,仿真和实验评估的平均pH 误差分别为15.8%和8.5%;Yang 等[15]提出了用于细胞培养的3D EIT 成像技术,基于16 个电极的微型平面EIT 传感器完成了高质量的3D 细胞培养成像,可实时、非侵入地监测培养细胞,以便于细胞培养过程中生物行为及细胞动力学的研究;Javaherian 等[16]将稀疏重建梯度投影(Gradient projection for sparse reconstruction,GPSR)应用于3D EIT 成像算法中,解决了因3D EIT 成像体素过多导致的存储空间大以及重建时间长的问题,实现了肺功能的3D EIT 实时监测。
本研究建立了基于高密度传感器的舌癌组织边界3D EIT 方法,设计了底部中心1 个接地电极、顶部均匀布置16 个激励电极的高密度传感器。通过传感器的两层平面电极实现被检测组织的3D EIT 图像重建,并可对组织任一高度的切面进行2D EIT 图像绘制,有望应用于舌癌组织被切除手术中癌组织边界的实时检测,辅助医生实时评估癌组织的边界并规划其切缘。
1 传感器结构设计与3D EIT成像方法研究
1.1 高密度传感器结构设计
本研究提出了平面3D EIT 成像方法,设计了如图1 所示的高密度传感器,用于对嵌于正常组织内部的癌组织进行边界识别。高密度传感器由顶盖、弹簧、支撑柱、压板、底板和底座构成,顶盖、支撑柱、压板与底座均由树脂3D 打印加工而成。其中,支撑柱用于支撑底座和顶盖,并套在弹簧中支撑弹簧。弹簧的两端分别卡在顶盖与压板中,压板借助于支撑柱和弹簧可以上下移动。将被检测的组织置于压板与底板之间,以实现3D EIT 成像所需的两层平面电极,压板的高度取决于检测物的厚度。在压板上设置有4×4 的电极阵列即激励电极,其中,电极直径为2 mm,电极间距为6 mm,构成了22 mm×22 mm方形检测场域。选取弹簧探针作为激励电极,该探针由针头、弹簧和针管构成。其中,针头由黄铜制成,其表面经过镀金处理,将弹簧放置于针管内部以实现针头的伸缩,使得激励电极在检测凹凸不平的组织时可与组织表面紧密贴合。底板由PCB 加工而成,其中心处有一个直径为2 mm 的接地电极,对该电极进行了沉金处理,电极厚度为0.05 μm。接地电极为电流激励的负端,压板上的电极阵列均与该电极进行两电极激励。在进行电流激励时,电流可从组织表面流到底面,贯穿整个组织。层板与底板的其余区域均进行铺铜处理,以提高传感器的屏蔽效果,减小噪音干扰。
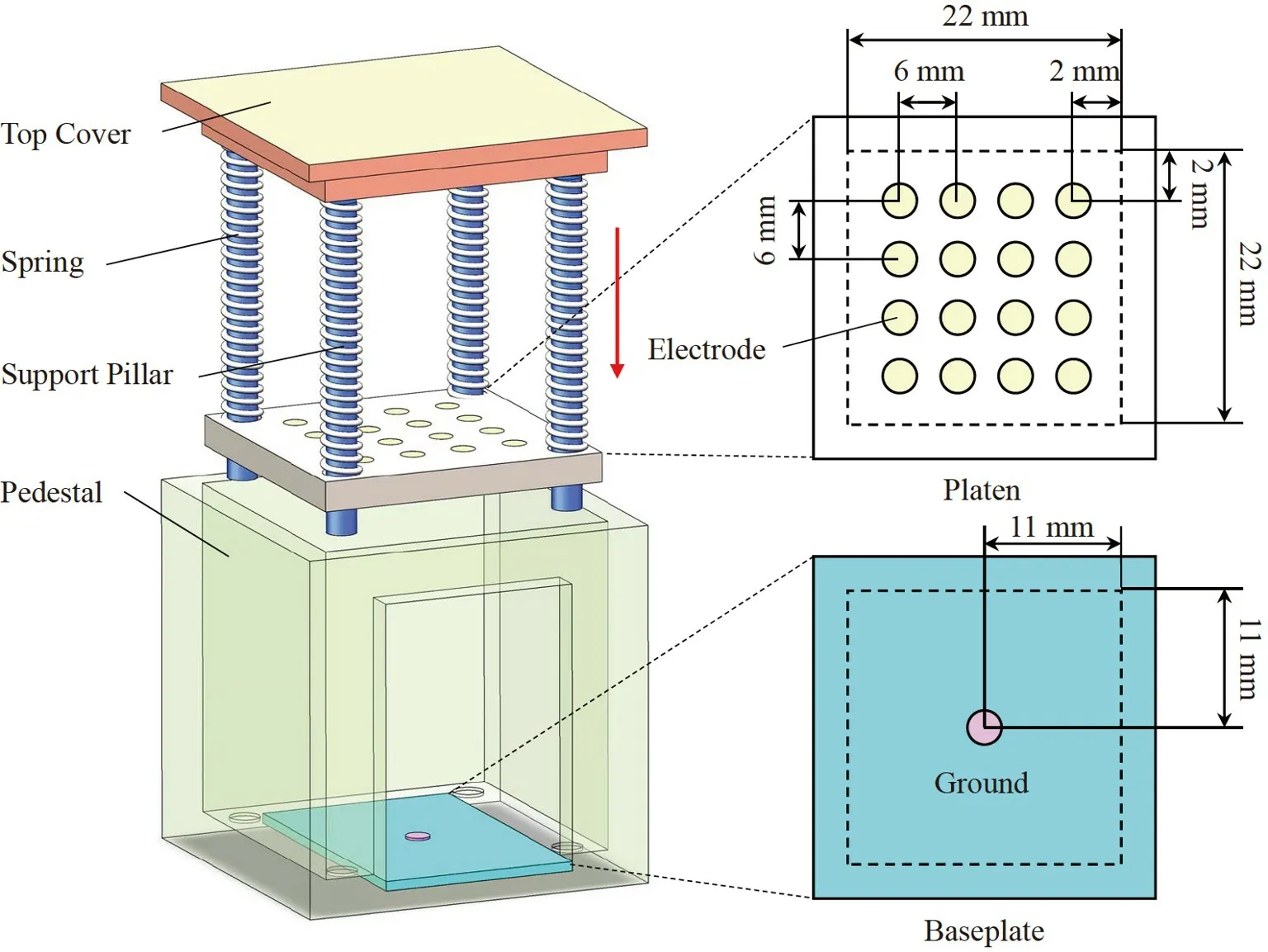
图1 高密度传感器的结构图Fig.1 Structure diagram of high-density sensor
1.2 3D EIT成像方法
图2 为3D EIT 检测流程图,将待测组织置于高密度传感器中的压板与底板之间,进行3D EIT 检测。通过传感器压板上的16 个激励电极分别与底板的接地电极激励,每次激励时依次采集其余15 个电极的电势,共采集16 × 15=240 个电势值,用于计算场域的电导率分布。其中,3D EIT 成像满足公式(1):

图2 三维电阻抗成像(3D EIT)检测流程图Fig.2 Detection flow chart of three dimensional electrical impedance tomography (3D EIT)
其中,Ω是测量域,(x,y,z)是测量域的点坐标,(x,y,z)是在点(x,y,z)处的电导率,(x,y,z)是在点(x,y,z)处的电势。每个电极施加的总电流边界条件如公式(2)所示:
其中,是第l个电极,L是电极个数,是电极间隙,n表示场域Ω的外单位法向量,s是电极表面,Il是第l个电极注入的电流。为了保证解(x,y,z)的存在且唯一性,应该满足边界条件即公式(3)~(5):
当激励电流为定值时,3D EIT 成像即为探索场域Ω的电导率分布σ与边界电势V的关系,可以表示为公式(6):
其中,是边界电势变化的向量,是电导率变化的向量,J是雅可比矩阵。J由公式(7)计算得到[17]:
其中,Ji,j是J的元素,i表示场域第i个有限元网格,j表示第j次一对电极激励时的独立测量,u与v是第j次一对电极分别注入电流时的电势分布。因此,可采用计算得到的J与测量得到的边界电势变化根据公式(8)逆向求解场域中的电导率变化:
其中,R() 是正则化项,λ是正则化因子。在成像方面,由改进的Tikhonov 正则化算法以逆向求解整个三维场域的电导率变化矩阵,按公式(9)计算:
其中,kt和kn为正则化系数,I为单位矩阵,D为对角矩阵,为边界电势变化,即用高密度传感器测得的240 个边界电势变化。通过有限元法对整个22 mm×22 mm×H方形场域进行网格划分,由8416 个网格点将场域划分成45337 个自由四面体网格,然后仿真计算整个场域的雅可比矩阵J,用于每个网格点的电导率计算,最终根据电导率变化矩阵绘制3D EIT 图像,并且通过3D EIT 仿真成像确定了本成像方法的空间分辨率,即目标物的最长边与场域的最长边之比不低于13.6%。
2 传感器3D EIT成像性能研究
2.1 舌体组织厚度对传感器3D EIT成像的影响
自然状况下,人的舌体厚度H约为6 mm[18]。为探究舌体厚度H对高密度传感器进行3D EIT 成像的影响,通过有限元的方法进行了3D EIT 成像仿真。仿真的背景域为舌体的正常组织,该域是高密度传感器检测的22 mm×22 mm×H的方体场域,其电导率为0.1 S/m。在场域中放入半径为2.5 mm、高为2 mm 的圆柱幻影作为舌癌组织,其电导率为0.01 S/m。对舌体厚度H分别为4、5、6、7 和8 mm 中的舌癌组织进行3D EIT 仿真实验,并选取传感器角落处P1、中心处P2以及边界处P33 个特殊位置研究了肿瘤组织在传感器不同位置的成像能力。3D EIT 图像重建结果如图3 所示,每两行展示了正常组织中的癌组织分别位于高密度传感器P1、P2和P3这3 处位置的3D EIT 图像重建结果,其中包括3D EIT 成像结果的俯视图与3D 视图。图3 中第一列为幻影的真实分布,后5 列为组织厚度H分别为4、5、6、7 和8 mm 时的3D EIT 图像重建结果。3D EIT 图像展示了场域中1/3 最大电导率变化值的等值面。成像结果表明,通过电导率的差异可捕捉癌组织的位置并呈现其轮廓,其中,P1、P2及P3位置的癌组织均可被正确评估,并能完整地展现出整个舌癌组织的边界。

图3 不同厚度舌体中的舌癌组织在高密度传感器P1、P2 与P3 处的3D EIT 重建图像Fig.3 3D EIT reconstruction images of tongue cancer in tongue tissue with different thickness at P1,P2 and P3 of high-density sensor
与图3 中3D EIT 重建图像相对应的图像相关系数(Image correlation coefficient,ICC)如表1 所示。ICC 按照公式(10)计算:
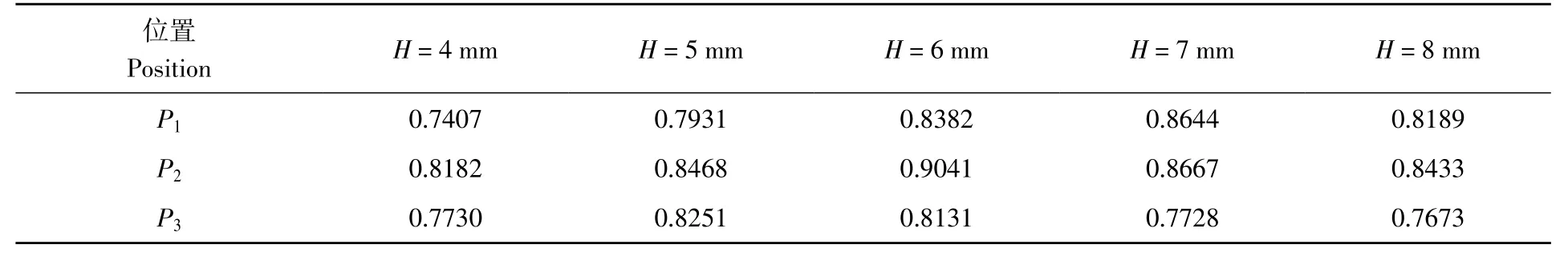
表1 3D EIT图像重建结果的图像相关系数(ICC)Table 1 Image correlation coefficient (ICC) of 3D EIT image reconstruction results
其中,是第i个网格点处真实的电导率变化量,是真实的平均电导率变化量,是3D EIT 重建的第i个网格点处的电导率变化量,是3D EIT 重建的平均电导率变化量,M是场域划分的网格点数量。ICC 值用于反映3D EIT 重建图像与幻影真实图像之间的相关程度,取值范围为0~1,ICC 值越大,说明3D EIT 重建图像与真实图像的吻合程度越高,图像重建质量越好。
为了更直观地探究传感器P1、P2及P33 个位置处的3D EIT 图像重建能力以及舌体组织厚度对3D EIT 图像重建的影响,绘制了不同厚度的舌体组织在P1、P2及P3处3D EIT 图像重建的ICC 分布折线图以及平均ICC 柱状图。如图4 所示,随着舌体厚度H增加,ICC 先增大后减小,舌体厚度对传感器P2处的图像重建质量无明显影响,P2处的图像重建质量明显高于P1和P3处的图像重建质量。此外,通过P1、P2及P3处图像重建的平均ICC 柱状图可以看出在H=6 mm 时平均ICC 值最高,表明舌体厚度为6 mm 时高密度传感器整体的3D EIT 重建效果优于其它厚度组织的重建效果,相对于6 mm 厚度的舌体,4 和8 mm 厚度舌体的3D EIT 成像误差小于3.3%。

图4 不同厚度舌体组织的3D EIT 图像重建ICC 分布Fig.4 ICC distribution of 3D EIT image reconstruction of tongue tissue with different thickness
为探究高密度传感器P2处的3D EIT 重建图像相较于P1和P3更加接近真实图像的原因,探究了传感器进行3D EIT 成像时整个检测场域的敏感度(S)分布,其中,S矩阵中的元素Sij可由公式(11)计算得到:
其中,I为激励电流,Ω为测量场域,i为有限元网格的个数,j为第j次独立测量,σi为第i个网格处的电导率,Uj为第j次独立测量的电势,u与v是第j次一对电极分别注入电流时的电势分布。
绘制了高密度传感器检测场域为22 mm×22 mm×6 mm 时的敏感度分布。如图5 所示,颜色条由蓝色渐变到红色,表明敏感度从低到高。以接地电极为中心呈圆弧状的红色区域是敏感度高的区域,从该区域往外敏感度逐渐降低。其中,P1、P2和P3处的敏感度分别为8.62×104、4.83×106和3.03×105。P2位置的敏感度大于P1与P3,与图3 高密度传感器3 个位置的3D EIT 重建能力相符,即传感器P2位置处图像重建能力最好。
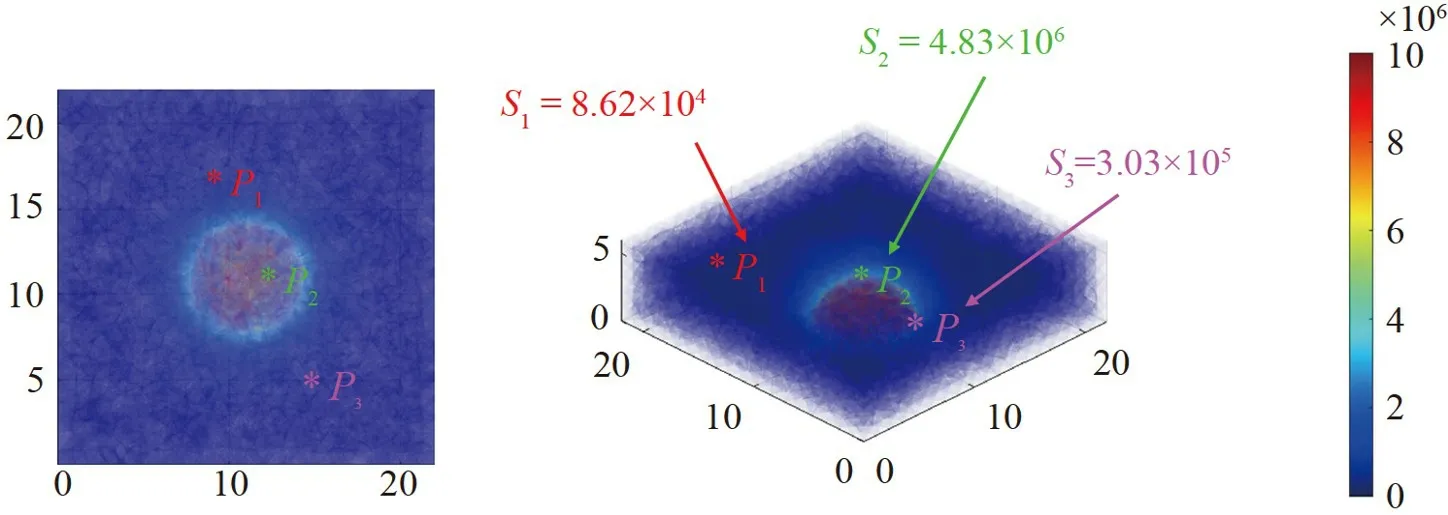
图5 高密度传感器检测场域的敏感度(S)分布Fig.5 Sensitivity (S) distribution of detection field of high-density sensor
2.2 不同浸润深度的舌癌组织的3D EIT成像性能
对高密度传感器P2处的不同浸润深度Ht的舌癌组织进行3D EIT 仿真,以探究高密度传感器对不同浸润深度的舌癌组织的3D EIT 成像能力。不同浸润深度下舌癌组织的3D EIT 图像重建结果如图6 所示,分别以侧视图和3D 视图两个视角展示了舌癌组织浸润深度2.0、3.5 和5.0 mm 时的3D EIT 成像结果,相应的图像相关系数分别为0.9109、0.9260 和0.9063,表明高密度传感器能够很好地捕捉到场域中癌组织深度的电导率变化,根据电导率变化正确评估癌组织的浸润深度及其三维边界。
图6 不同浸润深度癌组织的3D EIT 重建图像Fig.6 3D EIT reconstruction images of cancer tissues with different depths of invasion
3D EIT 图像的切片图展示了从高密度传感器检测场域的顶部到底部的水平切面图,其中包括h为0、0.5、1、…、5、5.5 和6 mm 所在高度的2D EIT 截面。2D 的EIT 图像清晰地展示了癌组织每一层所在的区域大小,并在相应深度下的切片图像能捕捉到癌组织,通过3D EIT 图像的切片图能够更直观地确定癌组织的浸润深度。上述结果表明,高密度传感器以及3D EIT 成像方法可以评估舌体中癌变组织引起的电导率变化,进而呈现出整个舌癌组织的3D 边界。
3 高密度传感器的3D EIT实验
3.1 实验设备
实验设备如图7 所示,包括笔记本电脑(PC)、IM3570 阻抗分析仪(日本HIOKI 公司)、34980A 数据采集仪(Keysight)、17 通路选通开关和高密度传感器。阻抗分析仪持续发出幅值为0.1 A 的交流电信号传输给数据采集仪,电脑向数据采集仪发出控制信号,控制数据采集仪选通17 通道选通开关,实现激励的电流信号与高密度传感器的传输,同时采集待测组织的响应电压信号。17 通路选通开关控制高密度传感器的16 个激励电极与数据采集仪的选通,1 个电极激励、同时依次采集其余15 个电极的电势,再进行1 个电极激励、同时依次采集其余15 个电极的电势,依次循环,直到最后1 个电极激励时其余电极的电势采集完成后,测量结束。数据采集仪共采集240 个响应电势值,最终将响应电势值传输给电脑,进行3D 场域的电导率计算及成像。

图7 实验设备图Fig.7 Diagram of experimental equipment
3.2 舌体模型制备
在之前的研究中,浸润在正常舌体组织中的舌癌组织的阻抗值大于周边正常组织[19]。因此,为了模拟发生癌变的舌体,选取电导率较大的牛肉组织制备舌体的正常组织,选取电导率较低的猪脂肪组织制备生长在舌体中的舌癌组织。切取厚度为10 mm 的方形牛肉块作为舌体中的正常组织,再用不同直径的圆形刀具在每块牛肉的中间位置切除厚度为5 mm 的牛肉组织,用不同直径的圆形刀具切出相应大小的猪脂肪组织作为舌癌组织,将猪脂肪组织填充进牛肉块中制备舌体模型。
选取5 块厚度均为10 mm 的牛肉块制备5 种舌体模型,再用直径分别为3、4.5、6、7.5 和9 mm 的圆形道具制备大小不同的舌癌组织。在舌体模型制备过程中,由于牛肉与猪脂肪均为软组织,将猪脂肪填充进牛肉后并不能保证猪脂肪仍是一个完整的圆柱体,因此,最终制成了5 种最大直径(dmax)分别为3、4.5、6、7.5 和9 mm 的舌体模型,如图8 所示。

图8 5 种不同尺寸的舌体模型Fig.8 Tongue cancer tissue models with five different dimensions
4 结果与讨论
4.1 3D EIT成像结果
对制备的5 个舌体模型分别进行了3D EIT 检测实验,5 个舌体模型中的癌组织dmax分别为3、4.5、6、7.5 和9 mm。将这5 个舌体模型分别放进高密度传感器进行检测,3D EIT 成像结果以及成像的切片图如图9 所示。3D EIT 图像呈现了场域中最大电导率变化值2/5 的等值面,等值面构成的区域则是舌癌组织,其中虚线圆柱轮廓是舌癌组织的理想边界,通过3D EIT 重建图像能够检测出嵌于舌体中的舌癌组织,并大致呈现其边界。从3D EIT 成像的切片图中可以清楚地判断舌癌组织的浸润深度,切片图展现了舌癌组织处于1、2、3、4、5 和6 mm 浸润深度下的2D 边界。其中,圆形的虚线框为舌癌组织所在截面应有的2D 边界,不同截面下的2D EIT 图像可以呈现出舌癌组织的2D 边界。
4.2 成像结果差异分析
通过组织之间的电导率差异可以识别dmax分别为3、4.5、6、7.5 和9 mm 的舌癌组织及其边界。对于尺寸较小(3 和4.5 mm)的舌癌组织,3D EIT 重建的边界有偏差,并不能正确识别舌癌组织的浸润深度,在截面高度为4 和5 mm 处未重建出舌癌组织真实的2D 边界,这是由于这两个尺寸的舌癌组织相较于全部检测的3D 场域而言体积过小,与3D 场域的最大面积比仅为1.86%和4.18%。
对于dmax分别为6、7.5 和9 mm 的舌癌组织,通过3D EIT 切片图像能够正确识别舌癌组织的浸润深度。在截面高度为1~4 mm 时的2D EIT 图像能正确评估舌癌组织的2D 边界;在截面高度为5 mm 时,EIT 成像呈现的边界小于理想边界。dmax为3 和4.5 mm 的舌癌组织在截面高度为1~3 mm 时的2D EIT图像能够正确评估舌癌组织的2D 边界;在截面高度为4~5 mm 时,EIT 成像呈现的边界小于理想边界,甚至未重建出舌癌组织的真实边界。与仿真成像结果相比,本研究的3D EIT 重建图像未能正确评估出舌癌组织的真实浸润深度,并且在接近场域上表面的截面0~1 mm 处未能重建出组织的真实2D 边界,可能是实验设备之间信号的传输不稳定或者信号受到了噪声干扰,使得测得的边界电势不均匀,因而造成图像重建误差偏高。
5 结论
提出了用于舌癌组织边界检测的3D EIT 成像方法,设计了高密度传感器,并利用其对舌体模型进行了3D EIT 成像。首先,有限元仿真实验结果证明了个体间的舌体厚度差异不会对3D EIT 成像产生影响,当人舌体厚度为6 mm 时,传感器的整体成像性最好。其次,高密度传感器能够很好地捕捉到场域中癌组织深度的电导率变化,并且通过3D EIT 图像的切片图能够展示癌组织每一层所在的区域大小,有助于临床诊断时更直观地确定癌组织的浸润深度。最后,通过对舌体模型进行的3D EIT 成像实验验证了3D EIT 重建方法的可行性,但是对实验设备之间信号的稳定传输以及噪声的处理还需要进一步改善,以更好地应用于临床中舌癌边界的检测。综上,本方法有望应用于舌癌组织临床手术中,为临床诊断和治疗提供一种舌癌组织边界的实时检测方法,辅助医生更精准地划定癌组织切缘,从而尽可能完整地切除舌癌组织,降低舌癌复发率。
