基于传感/信号分离的双极电极-电化学发光酶传感器检测胆固醇
2023-02-26刘利阳黄声秀姚清达杨伟强倪建聪
刘利阳 黄声秀 姚清达 杨伟强 倪建聪
(闽南师范大学化学化工与环境学院,漳州 363000)
胆固醇(Cholesterol,CHOL)也称胆甾醇,是多种疾病诊断的重要生理指标[1-2]。体内高水平的CHOL是诱发高血压[3]、动脉硬化[4]和心肌梗塞[5]等多种疾病的主要因素,而低水平的CHOL 也可能会导致低脂蛋白[6]、败血症[7]、甲亢[8]和肝病[9]等疾病。因此,准确、灵敏地检测体内CHOL 含量对临床诊断和疾病预防非常重要。目前,常用的CHOL 检测方法包括酶法[10]、比色法[11]、高效液相色谱(HPLC)法[12]、荧光法[13]、电化学法[14]、电化学发光(Electrochemiluminescence,ECL)法[15]等。其中,ECL 法是在电极表面施加一定的电压,使发光体电激发形成激发态,在回到基态过程中以光的形式释放能量,从而获得ECL 响应信号[16-17]。ECL 具有高灵敏、低背景、简单可控等特点,在临床分析诊断领域广泛应用[18-19]。但是,在检测生物样本时,ECL 传感过程易受到复杂基质的干扰,产生非特异性检测信号。双极电极(Bipolar electrode,BPE)是在外加电场驱动下导体两端发生极化的现象,将其与ECL 结合可以构建传感端和信号端分离的双极电极-电化学发光(BPE-ECL)检测方法[20]。如Lu 等[21]在印刷电极上设计一段碳基双极电极,其阴极端修饰的核酸探针在靶标赭曲霉毒素A 的存在下引发杂交链式反应并结合辣根过氧化物酶,催化苯胺/过氧化氢的聚合反应;阳极端信号池中的钌联吡啶/三正丙胺(Ru(bpy)32+/TPrA)发光体系的信号受阴极端催化过程的电子转移调控。通过构筑分离的传感检测池和信号收集池,可以避免样本基质对发光体系的直接干扰。BPE-ECL 传感模式近年来受到了广泛关注,并已被开发用于DNA[22]、癌症标志物[23]和细菌[24]等靶标的检测,但尚无将BPE-ECL 体系用于人体内CHOL 含量检测的报道。
本研究开发了一种酶催化的BPE-ECL 传感平台用于测定人血清中CHOL 的含量,此传感器具有传感/信号分离的特点。如图1 所示,利用光刻法在氧化铟锡(Indium tin oxide,ITO)导电玻璃电极上刻蚀出导电ITO(绿色部分)的双极电极及外接驱动电极,并在驱动电极负极和BPE 阴极电沉积纳米金(AuNPs,黄色部分);利用聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)在BPE 的阴极端和阳极端分别构筑独立的传感检测池和信号收集池(白色部分)。在BPE 阴极端电聚合壳聚糖(CS)并固定胆固醇氧化酶(Cholesterol oxidase,CHOx),在信号池中加入Ru(bpy)32+/TPrA 作为发光信号源。当检测池中存在CHOL 时,CHOx催化氧化CHOL 分解并生成H2O2;在外电压的驱动下,BPE 保持电荷守恒但两端发生极化[25],阴极端的H2O2发生还原反应,并将电子转移至BPE 阳极端,引发信号池中Ru(bpy)32+/TPrA 的氧化反应,从而产生较强的ECL 响应。随着检测池中CHOL 浓度增大,BPE 阴极端的CHOx 催化产生更多的H2O2,从而使信号池的ECL 信号更强,由此建立了一种传感/信号分离的CHOL 检测新方法。

图1 双极电极-电化学发光胆固醇酶传感器的构建及传感原理示意图Fig.1 Schematic of construction and sensing mechanism of BPE-ECL enzymatic biosensor for detection of cholesterol
1 实验部分
1.1 仪器与试剂
CHI 660E 电化学工作站(上海辰华仪器公司);BPCL-1-T 微弱发光仪(北京亚泊斯仪器公司);FR224CN 电子天平(上海奥斯豪仪器有限公司);JSM-IT510 扫描电子显微镜(日本电子株式会社公司);DZF-6050 真空干燥箱(上海驰唐实业有限公司);KDC-40 高速离心机(美国瓦里安公司);ITO 电极(华南湘城科技有限公司);Direct-Q 超纯水仪(美国Millipore 公司)。
CHOL、CHOx、Ru(bpy)32+、TPrA、HAuCl4、K3Fe(CN)6、K4[Fe(CN)6、正性光刻胶(AZP4620)和PDMS 购自上海阿拉丁试剂有限公司;HNO3、HCl、HAc、NaOH、KCl、戊二醛(GA)、抗坏血酸(AA)、尿酸(UA)、柠檬酸(CA)、多巴胺(DA)、葡萄糖(Glu)、维生素E(VE)、CS 和磷酸盐缓冲溶液(PBS)购自国药集团化学试剂有限公司;人血清样本由福建省漳州市医院提供,患者知情同意,相关研究经过伦理委员会批准。所用试剂均为分析纯;实验用水均为超纯水(18.2 MΩ·cm)。
1.2 实验方法
1.2.1 ITO电极的图案化制备
参照文献[26],利用光刻法对ITO 电极进行图案化处理。将ITO 电极粘附在甩胶机的旋转圆盘上,并涂覆正性光刻胶,以3000 r/min 甩胶40 s 使之均匀;将ITO 电极置于110 ℃烤胶机上加热3 min,冷却至室温后,将光刻掩版置于ITO 电极表面并在紫外灯下曝光4 min;将ITO 电极浸没在0.7%NaOH 溶液中显影;将光胶图案化的ITO 电极浸入HNO3/HCl/H2O 刻蚀液(4∶5∶5,V/V)中,刻蚀掉暴露的ITO 层,超声20 min 除去表面的光胶,即可得到导电部分图案化的ITO 电极。
1.2.2 BPE传感器的制备
在驱动电极负极和BPE 阴极电沉积AuNPs。在检测池与信号池中分别加入100 μL HAuCl4溶液(2.4 mmol/L,含0.1 mol/L KCl),施加6.0 V 的外电压300 s,然后用水将ITO 电极冲洗干净。
将PDMS 预聚物和固化剂按质量比10∶1 进行混合,搅拌,真空脱气30 min 后倒入模具,于60 ℃固化3 h。用打孔器将固化后的PDMS 制成方形池(直径10 mm,孔深3 mm),并粘贴于ITO 双极电极部分的两端,即制得BPE 传感器。
1.2.3 CHOx的固定
在检测池中加入CS 的1%乙酸溶液,信号池中加入100 mmol/L PBS 缓冲液,施加‒0.4 V 的外电压200 s,即可在BPE 的阴极端电聚合上CS 薄膜。在BPE 阴极端滴加20 μL CHOx(1.0 mg/mL)与2 μL 戊二醛(1%)的混合溶液,待电极干燥后,重复该操作3 次。
1.2.4 CHOL的ECL检测
在检测池中加入100 μL 含不同浓度CHOL 的PBS 溶液(100 mmol/L,pH=7.0),在信号池中加入100 μL 含1 mmol/L Ru(bpy)32+和5 mmol/L TPrA 的PBS 溶液(100 mmol/L,pH=7.0)。将传感器在37 ℃孵育25 min 后进行ECL 测试,每个样品均进行3 次重复测试。ECL 检测条件:BPCL 工作电压为800 V;循环伏安法(Cyclic voltammetry,CV)扫描电压范围为1.0~4.0 V,扫速为100 mV/s。采用本方法检测血清中的CHOL,同时进行加标回收实验,并与HPLC 检测结果进行比较。
2 结果与讨论
2.1 不同修饰电极的表征
BPE 阴极端位于检测池内,其上负载的CHOx 催化CHOL 水解生成H2O2,其表面修饰情况对传感器的性能有重要影响。利用扫描电镜(SEM)对BPE 阴极端修饰过程进行了表征。由图2A 可见,裸ITO 电极表面非常洁净;由图2B 可见,BPE 阴极端电沉积AuNPs 后,AuNPs 比较致密且基本覆满电极表面。电沉积AuNPs 避免了ITO 电极在高负电位下损坏,并加快电子转移速率。为了给CHOx 提供有效负载位点,在BPE 阴极端电聚合一层CS 薄膜得到CS/AuNPs/ITO,在电极的表面和截面(图2C)均可见CS 薄膜均匀地覆盖在BPE 阴极端。采用滴涂的方式将CHOx 固定在BPE 阴极端得到CHOx/CS/AuNPs/ITO,滴涂后的CHOx 呈圆球形且几乎将电极表面覆满,上层表面还具有凹陷的活性位点(图2D),表明CHOx 成功修饰在BPE 阴极表面。

图2 BPE 阴极端修饰电极表面的扫描电镜(SEM)图:(A)ITO;(B)AuNPs/ITO;(C)CS/AuNPs/ITO;(D)CHOx/CS/AuNPs/ITO。插图为对应的电极截面图Fig.2 Surface and cross-sectional scanning electron microscopy (SEM) images of modified BPE cathode:(A) Bare ITO;(B) AuNPs/ITO;(C) CS/AuNPs/ITO;(D) CHOx/CS/AuNPs/ITO.Insets are corresponding cross sections of different electrodes
采用电化学方法研究BPE 阴极端的传感性能。[Fe(CN)6]3–/4–探针在不同修饰BPE 阴极上的CV 曲线如图3A 所示,与裸ITO(曲线a)相比,电沉积AuNPs 的电极界面(曲线b)具有更高的电化学信号,说明AuNPs 的沉积增强了电极的导电性;电聚合CS 后,CS/AuNPs/ITO(曲线c)的电化学响应信号降低,这是由于CS 导电性较差,阻碍了电极表面的电子传递;滴涂CHOx 后,CHOx/CS/AuNPs/ITO(曲线d)的电化学信号进一步降低,说明CHOx 成功固定在电极表面。电化学交流阻抗谱(EIS)表征结果如图3B 所示,裸ITO(曲线a)的Nyquist 曲线在高频区呈现较小的半圆,表明电极的电子传递阻抗(Ret)较小,探针[Fe(CN)6]3‒/4‒在该界面的电子传递速率较快;电沉积AuNPs 后,阻抗谱图中半圆直径减小(曲线b),表明AuNPs 有利于促进电子传递;由于CS 导电性差,CS/AuNPs/ITO 的半圆直径明显增大(曲线c);CHOx/CS/AuNPs/ITO的半圆直径进一步增大(曲线d),表明大量不导电的酶固定在电极表面。以上EIS 结果表明,BPE 阴极传感端已成功构建。
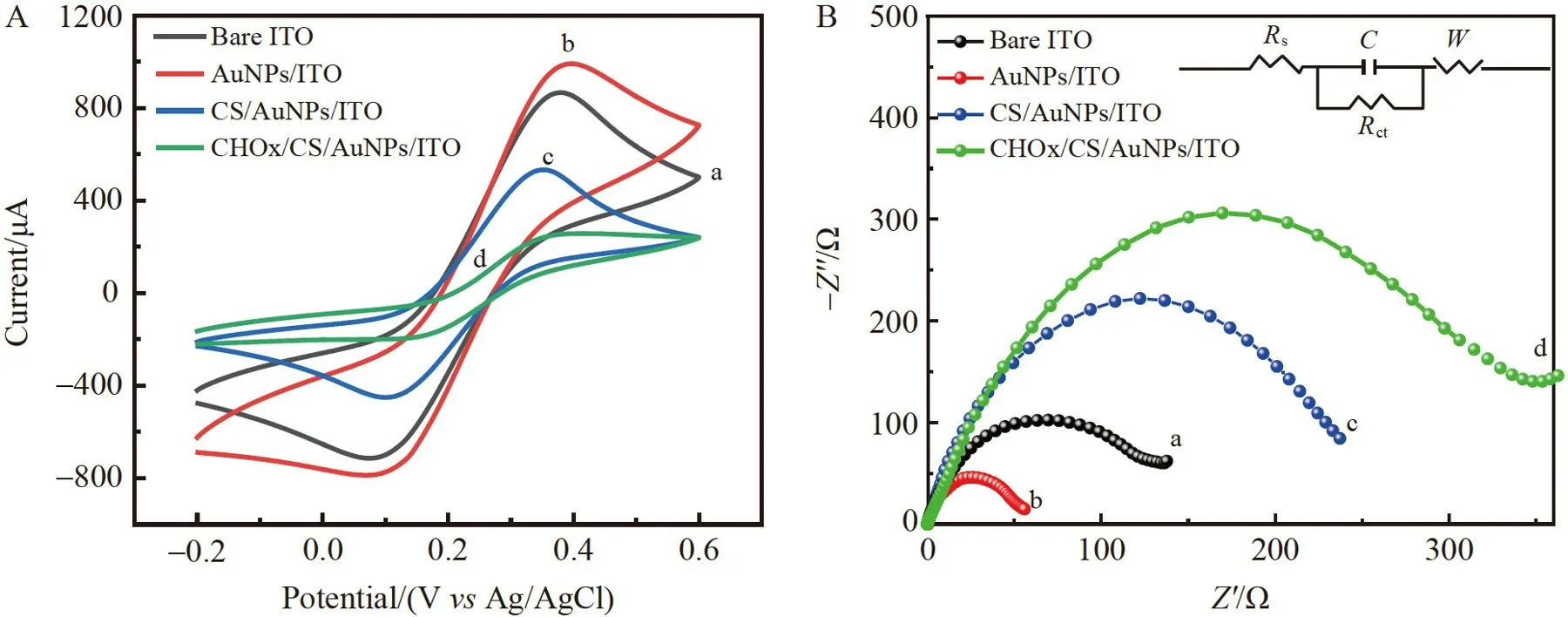
图3 BPE 阴极端不同修饰电极在含1.0 mmol/L 的[Fe(CN)6]3–/4–的0.1 mol/L KCl 溶液中的(A)循环伏安(CV)图和(B)交流阻抗(EIS)图:(a)ITO;(b)AuNPs/ITO;(c)CS/AuNPs/ITO;(d)CHOx/CS/AuNPs/ITOFig.3 (A) Cyclic voltammetry (CV) and (B) electrochemical impedance spectroscopic (EIS) characterization of different BPE cathodes in 100 mmol/L KCl solution containing 1.0 mmol/L [Fe(CN)6]3–/4–: (a) Bare ITO;(b) AuNPs/ITO;(c) CS/AuNPs/ITO;(d) CHOx/CS/AuNPs/ITO
2.2 实验条件的优化
为了使传感器性能达到最佳,对检测池BPE 阴极端的CHOx 的固载量、酶催化反应的温度、缓冲液pH 值和反应时间进行了优化。首先考察了BPE 阴极端CHOx 固载量对传感器性能的影响。如图4A 所示,随着滴加的CHOx 酶固定液浓度增加,ECL 信号逐渐增大,表明CHOx 固载量增多,能够有效催化CHOL 并产生大量的H2O2,使阳极端的ECL 信号增强;当酶固定液浓度超过1.0 mg/mL 时,ECL 信号基本维持稳定。因此,后续实验中选择CHOx 酶固定液浓度为1.0 mg/mL。催化反应温度的影响如图4B 所示,ECL 信号随着催化反应温度上升而增强,并在37 ℃时达到最大值,之后随温度增加而逐渐下降。这是因为酶催化反应通常有一个最适温度。本研究中CHOx 催化反应的最适温度为37 ℃。检测池中溶液pH 值对传感器的ECL 信号的影响如图4C 所示,随着检测池溶液pH 值逐渐升高,ECL 信号先上升,在pH >7.0 后下降。因此,选取pH=7.0 的PBS 缓冲溶液进行后续实验。酶的催化反应时间也是影响电极ECL 信号的重要因素,如图4D 所示,在5~25 min 的时间范围内,随着酶催化反应时间延长,ECL 信号不断增大,这是因为催化反应时间越长,CHOx 催化CHOL 生成的H2O2越多;但是,酶催化反应时间超过25 min 后,ECL 信号反而减弱,这可能是一部分H2O2分解所致。综合考虑响应信号和检测时效,选择25 min 作为CHOx 最佳催化反应时间。

图4 (A)CHOx 浓度、(B)催化反应温度、(C)pH 值和(D)催化反应时间对传感器ECL 信号强度的影响;检测池:1 mmol/L CHOL 溶液;信号池:1 mmol/L Ru(bpy)32++5 mmol/L TPrAFig.4 Effects of (A) concentration of CHOx,(B) temperature,(C) pH value and (D) incubation time on ECL signal intensity.1 mmol/L cholesterol in sensing cell;1mmol/L Ru(bpy)32++5 mmol TPrA in reporting cell
2.3 传感器的分析性能
在最优的实验条件下,对不同浓度的CHOL 溶液进行了检测。随着检测池中CHOL 溶液浓度增大,BPE 信号池ECL 信号逐渐增大(图5A)。以ECL 信号强度为纵坐标、CHOL 浓度的对数值为横坐标,绘制工作曲线,如图5B 所示,ECL 强度与CHOL 浓度(1 μmol/L~10 mmol/L)的对数具有良好的线性关系,线性方程为I=2372.4×lg[C/(μmol/L)]+1081.4(R2=0.998),检出限为0.13 μmol/L(S/N=3)。与文献报道的其它CHOL 检测方法相比(表1),本方法检测时间短、检出限低、线性范围宽。本方法采用的BPE 传感信号分离模式有效避免了发光试剂与待检测溶液的干扰,可获得灵敏且稳定的检测信号。

表1 不同CHOL检测方法性能比较Table 1 Comparison of analytical performances of different CHOL assays

图5 (A)传感器对不同浓度CHOL 的ECL 响应信号;(B)ECL 信号强度随CHOL 浓度对数值变化的线性关系曲线。检测池CHOL 浓度(a →l):1、5、10、25、50、100、250、500、1000 μmol/L,2.5、5、10 mmol/L;信号池:1 mmol/L Ru(bpy)32++5 mmol/L TPrAFig.5 (A) ECL response of different concentrations of CHOL;(B) Linear relationship between ECL intensity and logarithmic concentrations of CHOL.Concentrations of CHOL (a →l) are 1,5,10,25,50,100,250,500,1000 μmol/L,2.5,5,10 mmol/L,respectively.1 mmol/L Ru(bpy)32++5 mmol TPrA in reporting cell
2.4 传感器的抗干扰性、重现性与稳定性
为了考察此BPE-ECL 酶生物传感器的选择性,在检测池中加入10 mmol/L 的AA、UA、CA、DA、Glu 和VE 等潜在干扰物,并与1 mmol/L CHOL 溶液的阳极ECL 信号进行对比。由图6A 可见,此传感器对CHOL 溶液具有良好的ECL 响应,而对上述干扰物无明显ECL 响应,说明此传感器对CHOL 具有良好的选择性。在检测池分别加入1、100 和1000 μmol/L CHOL 溶液,进行3 次重复检测,结果如图6B 所示,各浓度下ECL 响应信号的相对标准偏差(RSD)分别为2.2%、1.4%和1.8%,说明传感器具有良好的重现性。如图6C 所示,在检测池中加入100 μmol/L CHOL 溶液,8 次连续扫描的ECL 信号的RSD 为2.3%,表明此传感器具有良好的稳定性。
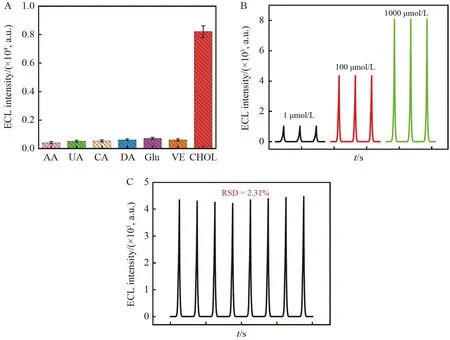
图6 传感器的(A)选择性(CHOL 浓度为1 mmol/L,干扰物浓度为10 mmol/L)、(B)重现性(CHOL 浓度分别为1、100 和1000 μmol/L)和(C)稳定性(100 μmol/L CHOL)实验结果,信号池中均为1 mmol/L Ru(bpy)32++5 mmol/L TPrAFig.6 (A) Selectivity (1 mmol/L CHOL,and 10 mmol/L each interferent),(B) reproducibility;(1,100 and 1000 μmol/L CHOL,respectively)and(C)stability(100 μmol/L CHOL)of the sensor.All reporting cells contain 1 mmol/L Ru(bpy)32++5 mmol/L TPrA
2.5 实际样品分析
利用此传感器对3 个人血清样本中的CHOL 浓度进行测试,并进行加标回收实验,评估此传感器对实际样品的检测性能,结果如表2 所示,加标回收率在98.4%~104.0%之间,RSD <4.7%。将此传感器检测结果与HPLC 检测结果进行比对,二者无明显差异,表明此传感器可准确测定复杂血清样品中的CHOL 浓度。

表2 人血清样品中CHOL的检测结果Table 2 Detection results of CHOL in human serum samples
3 结论
基于BPE-ECL 技术构建了一种酶传感平台并用于CHOL 的检测。构筑了空间独立的传感检测池和信号收集池,将CHOx 固定在BPE 阴极端,催化CHOL 分解,由产生的H2O2在阴极端的还原过程诱导阳极端的Ru(bpy)32+/TPrA 发生氧化反应,从而产生ECL 检测信号,实现了对不同浓度CHOL 的检测。将此传感器用于人血清中CHOL 的检测,表现出良好的准确性和抗基质干扰能力。这种传感/信号分离的模式避免了样本基质对发光信号的直接干扰,在生物传感检测领域具有良好的应用前景。
