LncRNA DANCR调控骨髓间充质干细胞成骨分化的研究进展
2023-02-26刘凯张聿轲冬梅王建忠
刘凯 张聿轲 冬梅 王建忠
1.内蒙古医科大学,内蒙古自治区 呼和浩特 010030 2.内蒙古医科大学第二附属医院,内蒙古自治区 呼和浩特010020
骨质疏松症(osteoporosis,OP)是一种中老年人易患的以骨密度下降、骨质量降低、骨微结构退化为特征的全身骨代谢障碍性疾病[1]。2018年全国性流行病学调查结果显示我国 50岁以上人群骨质疏松症患病率为19.2%[2]。OP发生主要是成骨细胞(osteoblast,OB)骨形成和破骨细胞(osteoclast,OC)骨吸收失衡,使骨量减少和(或)骨微结构破坏,导致骨脆性增加、骨强度下降、皮质骨变薄,进而发生病理性骨折[3]。目前,OP治疗以药物为主,通过减少骨吸收或增加骨形成治疗OP[4]。然而效果并不理想,亟需新的治疗干预措施。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)具有自我更新和分化为成骨细胞、脂肪细胞或软骨细胞等的能力,被广泛应用于再生骨科[5]。通过促进BMSC成骨分化维持骨代谢平衡可改善骨密度,为OP治疗提供了新策略[6]。长链非编码RNA(long noncoding RNA,lncRNA)是一种长度超过200 nt无蛋白质编码能力的核糖核酸,与骨代谢相关疾病密切相关,通过调控骨细胞增殖、分化、凋亡等细胞代谢途径参与OP进程[7]。其中lncRNA分化拮抗非蛋白编码RNA(differentiation antagonizing non-protein coding RNA,DANCR)是维持表皮干细胞或成骨细胞未分化状态所必需的分子,也是促进组织再生的潜在靶点[8],可能作为潜在的生物靶点和临床干预手段为OP的诊断与治疗提供新视角。而DANCR调控BMSC成骨分化影响OP进程的机制尚未完全阐明。本文就DANCR在BMSC成骨分化中的作用及相关机制进行综述,为探索DANCR作为诊断与治疗OP的新分子靶点提供理论依据。
1 DANCR与BMSC成骨分化概述
DANCR编码基因位于人类染色体4q12上,全长915 bp,在表皮祖细胞群体和分化细胞的研究中,其表达量在角质形成细胞的终末分化过程中会显著下调[9]。DANCR可在骨肉瘤等多种肿瘤中调节细胞增殖凋亡、迁移侵袭等细胞功能,是一种区分癌症患者和健康人群诊断和预后的生物标志物[10]。同时,DANCR可能通过激活细胞自噬抑制血管平滑肌细胞的成骨分化来减轻动脉钙化[11]。此外,DANCR也是牙齿组织来源的干细胞分化的调节因子,参与牙周韧带干细胞 (periodontal ligament stem cells,PDLSC)等干细胞的成骨分化,对于牙齿组织再生修复具有重要的意义[12]。BMSC是一种存在于骨髓中的间充质干细胞,因易从成体组织中分离且具有广泛的增殖和分化成各种细胞谱系的能力作为主要研究对象,在维持正常骨稳定方面起着重要作用。BMSC成骨分化受到抑制可导致骨形成减少,是OP重要发病因素之一。BMSC成骨分化的过程中受到众多因素的影响,其中DANCR可以通过竞争内源性RNA(competing endogenous RNA,ceRNA)、作为转录辅助因子等机制调控BMSC成骨分化来参与OP的发生与发展,是OP诊断和治疗的潜在手段[8]。
2 BMSC参与OP治疗
在OP发展过程中,常伴有BMSC成骨成脂分化失衡,导致骨骼中OB的数量减少和质量降低,骨髓脂肪增加,使得骨形成减少和骨微架构受损,增加骨折和骨折愈合困难的风险[13]。抑制BMSC中Zust同源增强子2(EZH2)的活性或降低EZH2基因表达都可以导致脂肪生成减少和成骨增加,而抑制DANCR表达可作用于EZH2促进BMSC成骨分化[14]。表明靶向抑制DANCR表达在一定程度上可以恢复机体BMSC成骨成脂分化平衡,进而延缓OP的发生发展。BMSC移植在原发性与继发性OP的治疗中都具有明显的效果。目前已有多项临床前研究探讨自体和异体BMSC移植在各种动物模型中的作用。在糖皮质激素诱导的OP小鼠模型中注射同种异体的BMSC,基于供体BMSC在受体骨髓中定植和发挥作用可以促进OB的形成[15]。将自体 BMSC移植到卵巢切除术(Ovariectomy,OVX)兔模型中后,治疗组骨连接增多,骨刚度增强,小梁厚度增加并且有新形成的类骨质的显微结构[16];在山羊绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)模型中也获得了类似的效果[17]。动物模型研究表明,自体和异体BMSC移植在OP的治疗方面有广阔的前景。在临床试验中也有移植自体BMSC治疗OP的研究。在西班牙圣母玛利亚医院以自体BMSC为干预的临床试验(注册号:NCT 02566655,静脉输注岩藻糖基化骨髓间充质细胞治疗骨质疏松症)中,操作者在移植前30 d左右从患者体内收集自体BMSC,培养扩增并进行岩藻糖化后静脉注射到OP患者体内。10例患者接受不同剂量注射,24个月后,用生化指标测量骨吸收等相关指标,测量骨密度并用组织形态学评估骨结构[18]。然而,由于BMSC总数随年龄增长而下降,使用自体BMSC治疗老年患者OP存在一些不确定性,目前该临床试验尚未报告具体结果[19]。由此可见,增加正常BMSC含量或在分子水平靶向调控BMSC分化方向,刺激其向OB分化并合成新骨可能是治疗OP的一种潜在方法。
3 DANCR调控BMSC成骨分化
OB和OC是骨组织细胞的主要成分,支撑着骨的主要代谢活动,二者代谢平衡对于OP有重要的影响。DANCR可以通过多途径调控BMSC及OP相关细胞成骨分化影响OP的进程(表1、图1)。同时,DANCR在其他多种间充质干细胞成骨分化中也起到关键作用。

表1 DANCR调控OP相关细胞成骨分化的研究总结Table 1 Summary of studies on DANCR regulating osteogenic differentiation of OP related cells
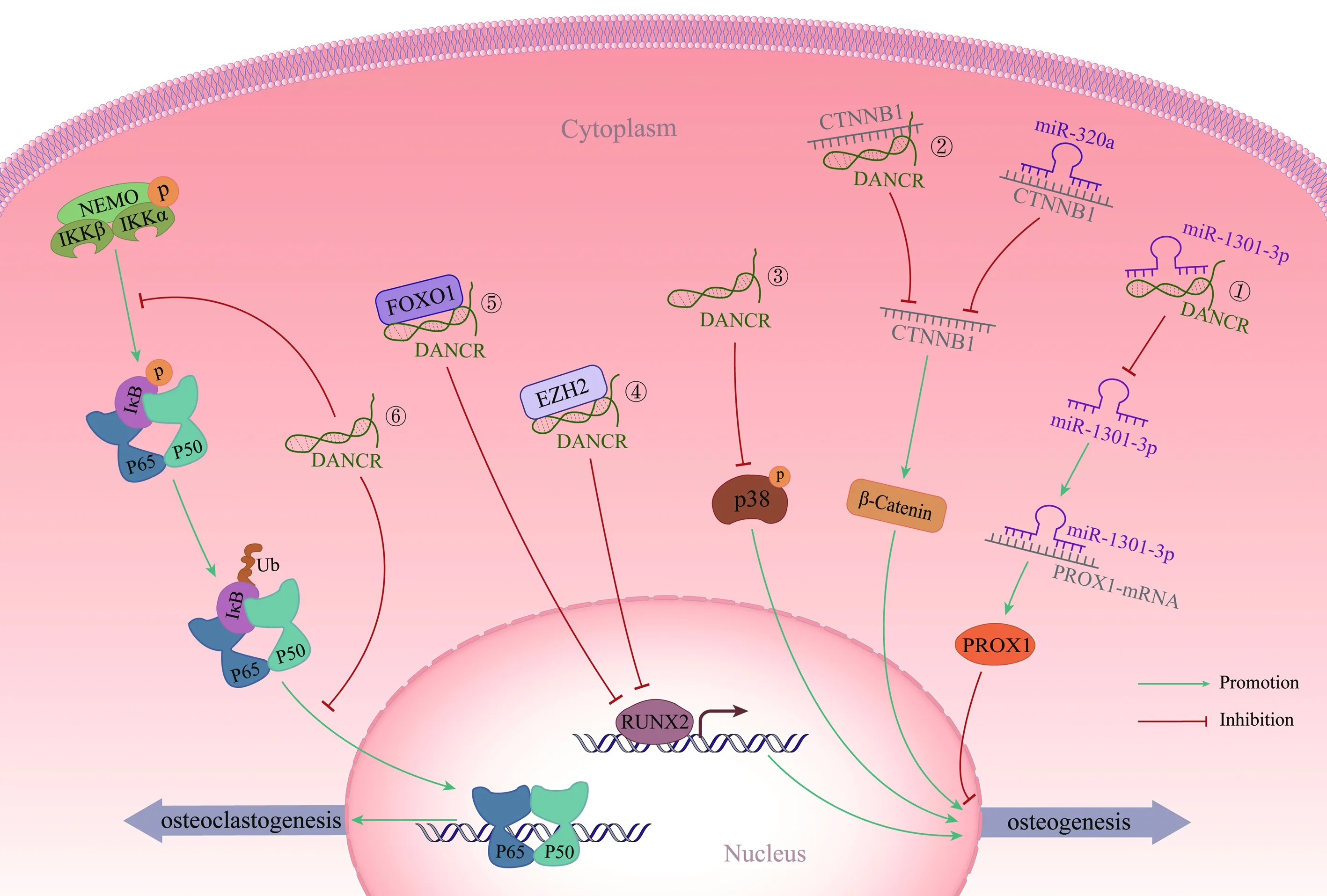
图1 DNACR调控成骨分化示意图Fig.1 Schematic chart of osteogenic differentiation regulated by DANCR注:①~⑤代表DANCR通过多途径影响细胞成骨分化,⑥代表DNACR影响破骨细胞生成。
3.1 调控miR-320a/CTNNB1/Wnt通路影响成骨分化
Wnt/β-catenin信号通路通过刺激OB生成和减少OC分化在骨稳态中起重要作用,抑制Wnt/β-catenin信号通路可以减少成骨分化[20]。在成骨过程中,当Wnt信号被激活时,β-catenin的磷酸化被抑制,使β-catenin聚集并转入细胞核内,进一步促进MSC中成骨细胞钙化早期转录因子锌指转录因子(Osterix,Osx)及矮小相关转录因子2基因(Runt-related transcription factor 2,RUNX2)的表达,促进OB的早期分化[21]。编码β-catenin蛋白的基因CTNNB1的异常表达是Wnt信号通路改变的常见原因,该分子与OP密切相关[22]。miR-320a在多种疾病中抑制CTNNB1的表达并调节Wnt/β-catenin信号通路[23]。PMOP患者的BMSC中DANCR和miR-320a表达上调,CTNNB1表达下调。加入miR-320a抑制剂后可以激活Wnt/β-Catenin信号通路,增加BMSC中Runx2、Osx等的表达,加速成骨矿化。而在BMSC中过表达DANCR后,抵消了miR-320a抑制剂对成骨分化和β-catenin通路的激活作用。虽然DANCR和miR-320a的表达水平没有相互影响,但过表达DANCR或miR-320a都降低了CTNNB1荧光素酶活性和β-catenin的表达,并且二者对于CTNNB1的影响存在协同效应[24]。此外,通过敲除MC3T3-E1小鼠成骨细胞系中的DANCR基因可以激活经典Wnt/β-catenin 信号通路,增加Osx和Runx2等促分化相关标志物表达水平,促进成骨分化[25]。
3.2 调控p38/MAPK通路影响成骨分化
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族在细胞生理调节中起到重要作用,其激活是成骨分化的重要触发因素,主要包含氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外信号调节激酶1/2(ERK1/2)和p38等MAPK分支通路[26]。MAPK家族可调控BMSC的分化、矿化和增殖[27]。激活MAPK通路可有效提高OB的活性并促进骨基质的分泌与钙化,利于机体骨形成[28]。在肝癌细胞中,DANCR可以通过海绵吸附作用调节miR-125b-5p并激活MAPK通路,从而促进肝癌细胞的增殖[29]。而沉默DANCR通过激活p38/MAPK信号通路抑制骨肉瘤细胞的迁移和侵袭[30]。比较未分化和成骨分化的BMSC中DANCR的差异表达谱发现,在成骨分化过程中,BMSC中DANCR的表达水平显著降低[31]。进一步研究发现,在成骨补充培养液培养基中培养BMSC能增强ERK1/2、JNK和p38的磷酸化,但真核表达载体转染细胞时,只有磷酸化p38的表达水平明显降低,用p38特异性抑制剂处理真核表达载体转染的BMSC后发现ALP活性与矿化基质沉积被抑制,表明敲降DANCR可以通过p38/MAPK而非JNK/MAPK、ERK1/2/MAPK通路促进BMSC的成骨分化[31]。
3.3 调控miR-1301-3p/PROX1轴影响成骨分化
miR-1301-3p与多种癌症的发生发展相关,在前列腺癌细胞和组织中显著上调,促进前列腺癌干细胞的扩增[32]。最新研究发现,miR-1301-3p在细胞成骨分化的过程中也起到至关重要的作用。Circ8500可通过海绵吸附miR-1301-3p上调肽基精氨酸脱亚胺酶4(peptidyl arginine deiminase 4,PADI4)的表达,促进成骨细胞基质矿化[33]。此外,miR-1301-3p可以通过促进矿化来加速大鼠BMSC向OB的分化[34]。Prospero相关同源异形盒蛋白1 (prospero homeobox 1,PROX1)是一种转录因子,过表达后可诱导人类脂肪干细胞分化为淋巴管内皮样细胞[35]。多数据库联合生信分析后发现DANCR可调节多个与BMSC相关的 miRNA,其中miR-1301-3p在BMSC成骨分化的过程中逐渐上调。此外,PROX1蛋白表达水平在BMSC成骨分化的过程中逐渐降低,实验表明DANCR在BMSC中起到了海绵吸附miR-1301-3p的作用。生信分析发现PROX1 mRNA可能是miR-1301-3p的靶标。DANCR过表达后增加了BMSC中PROX1蛋白表达水平,降低了ALP、Runx2和Osx等成骨标志物的水平,抑制了BMSC的成骨分化,但过表达miR-1301-3p可以逆转这种效果,表明上调DANCR可以通过miR-1301-3p/PROX1轴抑制BMSC的成骨分化[36]。
3.4 调控EZH2和FOXO1影响成骨分化
EZH2和Fork box转录因子1(FOXO1)是DANCR的直接结合靶点。EZH2是参与转录抑制的转录因子,为影响BMSC成骨分化的关键因素[37]。在小鼠模型中,EZH2可通过作用于周期蛋白依赖性激酶抑制因子2A(cyclin-dependent kinase inhibitor 2A,CDKN2A)控制成骨过程中的骨形成和细胞周期[38]。FOXO1可通过减少氧化应激和凋亡来恢复OB的分化和功能[39]。DANCR在PMOP小鼠体内的表达升高,沉默DANCR后EZH2下调,而Runx2上调,同时增加了ALP活性和钙沉积。DANCR能够作为转录辅助因子将EZH2招募到Runx2基因启动子上,通过抑制Runx2基因的表达进而抑制OB分化。此外,沉默DANCR可以促进PMOP的OB增殖分化以及骨样细胞的形成[40];在人胎儿成骨细胞系hFOB1.19中,下调DANCR后同样发现Runx2基因的表达增加并促进了成骨分化[41]。FOXO1同样可与Runx2启动子相互作用以促进成骨分化[42]。FOXO1水平在BMSC成骨分化过程中逐渐上升,用RNA结合蛋白免疫实验检测DANCR与FOXO1的关联性表明DANCR可与FOXO1直接结合。泛素化检测结果表明,降低DANCR 基因表达可抑制S期激酶关联蛋白2(S-phase kinase-associated protein 2,skp2)介导的FOXO1泛素化,导致Runx2表达水平下降从而抑制BMSC成骨分化[43]。
3.5 调控其他间充质干细胞成骨分化
DANCR调控成骨分化的领域十分广泛,除了BMSC,还可以调控多种干细胞成骨分化。如通过海绵吸附miR-1275调节基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)的表达,参与滑液来源的间充质干细胞的软骨分化[44]。此外,DANCR是(SRY-related HMG-box 4,Sox4)的靶分子,Sox4可直接与编码DANCR基因的启动子结合并增加其表达,促进 SMSC软骨分化,增加软骨生成[45]。黄韧带来源的间充质干细胞(ligamentum flavum derived mesenchymal stem cells,LF-MSC)参与了黄韧带钙化的发生,可以增加黄韧带中软骨细胞含量和钙沉积。DANCR表达水平下调可导致黄韧带细胞增殖减少,但增强了LF-MSC的软骨分化和钙化[46]。下调DANCR可通过激活经典的Wnt信号通路促进PDLSC成骨分化[47]。上调DANCR可通过海绵吸附miRNA-758靶向抑制Notch2-Wnt/β-catenin信号通路,进而抑制PDLSC的成骨分化[12]。一项旨在评价PDLSC中DANCR水平表达的研究表明,降低DANCR可减少压缩力通过OC形成和牙根吸收[48]。另一项研究指出创伤性压应力可以抑制MC3T3-E1成骨细胞系上DANCR的表达,从而激活NF-κB信号通路,最终导致成骨分化的抑制,与之前的结论存在分歧,该研究者推测这种差异可能与DANCR在不同物种中的不同生物学功能有关[49]。
4 DANCR是OP潜在的诊断及治疗靶点
DANCR可以调控成骨分化的证据不仅存在于分子实验,在临床论证中也有相关性数据,表明其可能具有作为临床诊断指标和治疗新靶点的潜在价值。一项研究取30例PMOP妇女和20例非PMOP妇女的骨髓标本,发现PMOP组BMSC中DANCR水平高表达[24]。另一项研究取了44例骨折患者和24名健康体检者的血清标本,发现骨折患者血清中DANCR高表达[25]。此外,DANCR在循环单核细胞中表达上调,在OP患者中增加其骨吸收活性,被确定为PMOP的潜在生物标志物[50]。随着医学检验技术不断进步,或可通过检测血液、骨髓等标本中DANCR水平诊断OP。
芝麻素是一种从花椒植物中分离而来的木脂素,是芝麻油中的一种常见成分(约含0.25%)。天然芝麻素为右旋体,芝麻素也可通过人工合成,有作为药物量产的潜力,具有较高的医用价值[51]。芝麻素既可通过调节PI3K/Akt信号通路影响细胞凋亡,也可通过调节MAPK、Wnt/βcatenin等信号通路促进 BMSC成骨分化,同时可通过抑制NF-κB通路抑制OC生成,在OP、OA及激素性股骨头坏死等骨科疾病中起到重要的作用[52-54]。OVX小鼠血清中DANCR水平升高,芝麻素治疗后OVX小鼠股骨远端松质骨显微结构明显改善,且OVX引起升高的血清DANCR水平也被降低。DANCR是芝麻素介导的骨形成和吸收的关键调节因子,芝麻素可通过下调DANCR表达激活Wnt/β-catenin信号通路,进一步促进成骨分化;也可通过抑制IκBα磷酸化和NF-κBp65核易位抑制NF-κB信号通路,从而抑制破骨细胞的形成,表明芝麻素以一种DANCR依赖的方式在OB激活和OC细胞失活中发挥双重功能作用,且DNACR可能具有作为OP治疗靶点潜力[55]。
5 总结和展望
OP是一种常见的全身性骨骼疾病,主要特征是骨组织微结构损坏和骨量减少,进而引起骨脆性及骨折风险的增加,严重影响患者的生活质量。BMSC移植及靶向治疗是OP的热门研究方向。DNACR既可以通过影响Wnt/β-catenin、MAPK等信号通路以及作用于多种转录因子促进BMSC成骨分化,又可以通过抑制NF-κB信号通路从而抑制破骨细胞形成,通过维持骨代谢平衡参与OP进程。整体来看,DANCR在BMSC的成骨分化过程中起到负向调控的作用,从临床样本实验来看,DANCR具有作为OP诊断标志物的潜在能力,同时有望在未来参与靶点药物治疗OP的精准医疗。然而,由于DANCR在疾病和组织中表达具有广泛性,在临床诊断和治疗中特异性较低,且有关DNACR与OP的研究尚处于起步阶段,具体调控通路交互复杂,尚有诸多问题有待进一步探讨。
