骨痨愈康丸通过JAK3/STAT3信号通路对佐剂性关节炎大鼠炎症反应的影响
2023-02-26李金益宋敏田杰祥王凯范凯
李金益 宋敏,2* 田杰祥,2 王凯 范凯
1.甘肃中医药大学中医临床学院,甘肃 兰州 730000 2.甘肃中医药大学附属医院骨科,甘肃 兰州 730000
类风湿关节炎(rheumatoid arthritis,RA)是好发于手、足等小关节以关节滑膜炎性改变、血管翳生成、软骨与骨破坏为主要病理表现的自身免疫性疾病,其病因及发病机制尚未完全揭示[1]。RA病情缠绵难愈,治疗周期长,发病率高,如不能及时治疗,会引起关节畸形、功能丧失,最终导致残疾。RA的治疗尚无特效药物能有效治愈,因此寻求高效、安全、经济的治疗手段是风湿病学界研究的重要方向。中医药在RA的防治中疗效确切、安全性高,具有良好的应用前景。骨痨愈康丸是甘肃中医药大学附属医院研制的院内制剂,以补肾通络法为治则研制,具有补肾活血、通络止痛的功效,已在临床使用数十年,在缓解RA症状、改善患者的生活质量方面疗效确切。前期研究[2-3]表明,骨痨愈康丸能够降低相关细胞因子水平来抑制全身炎症反应,保护关节,增加骨密度,有效改善患者病情,但具体作用机制尚未阐释清楚。因此,本研究通过建立CIA大鼠模型,观察骨痨愈康丸对模型大鼠关节肿胀度和踝关节软骨及滑膜组织中JAK3/STAT3信号通路相关蛋白表达的影响,从JAK3/STAT3信号通路角度探讨骨痨愈康丸对RA的干预机制,以期为骨痨愈康丸防治RA的进一步研究提供参考资料。
1 材料与方法
1.1 材料
1.1.1实验动物及药物:选取SPF级Wistar大鼠60只,雌雄各半,体质量(220±20)g,动物生产许可证号SCXK(甘)2020-0001,由甘肃中医药大学实验动物中心提供。饲养于温度(22±2)℃、相对湿度(50±10)%环境,每日光照时间12 h,自由进食饮水,适应性饲养7 d。本实验通过了甘肃中医药大学伦理委员会审批,文件批号:2021-002。骨痨愈康丸(甘肃中医药大学附属医院,60 g/480丸,甘药制备字:Z20190001000)。
1.1.2试剂及仪器设备:酪氨酸激酶抑制剂AG490(MCE 批号:65923);牛Ⅱ型胶原蛋白(Bovine Type Ⅱ Collagen 批号:190078);完全弗氏佐剂(Freund’s Adjuvant Complete,Sigma,批号:LB29884);ELISA试剂盒;HE染色试剂盒(北京索莱宝科技有限公司,货号:G1120);BCA蛋白定量试剂盒(北京索莱宝公司,批号:PC0020);SP-9001兔SP试剂盒、DAB显色试剂盒(厂家:中杉金桥);TRIeasyTMTotal RNA Extraction Reagent(YESEN,货号:10606ES60,批号:HB170809);HifairⅢ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)(YESEN,货号:11123ES60,批号:H11255080);Hieff qPCR SYBR Green Master Mix(High Rox)(YESEN,货号:11203ES08,批号:H4104640)。高速冷冻离心机(德国Eppendorf,型号:5424R);酶标仪(美国Bio Rad公司,型号:iMark);恒温培养箱(上海精宏设备公司,型号:DNP-9022);包埋机(上海精宏设备公司,型号:101-1AB);切片机(德国,型号:LEICA2016);台式电热恒温鼓风干燥箱(天津市泰斯特仪器有限公司,型号:101-1AB);显微镜(Leica DM2500);NanoDrop核酸浓度测量仪(美国Thermo,型号:ND-ONE-W);实时定量PCR仪(美国Thermo,型号:StepOne Plus)。
1.2 方法
1.2.1实验分组:将60只大鼠适应性喂养1周后,随机分为正常对照组(10只)和造模制备组(50只)。除正常对照组外,将其他各组大鼠制备成CIA模型[4]。将牛Ⅱ型胶原蛋白和完全弗氏佐剂按1∶1比例在冰浴环境下充分混合,使用匀浆器充分摇匀,产生最终浓度为1 mg/mL的混合乳剂。对每只大鼠背部脊柱两侧、尾根部多点行皮下注射,每只大鼠注射混合乳剂0.3 mL,促使背部和尾根部发生致敏反应。初次免疫1~2周后,再对每只大鼠尾根部及双后足足垫分别注射0.1 mL混合乳剂加强免疫,2周后模型制备完成。采用关节炎指数(AI)评分评估模型大鼠炎性反应情况[5],观察大鼠双后足,按0~4级进行评分,AI≥2提示造模成功。将模型制备成功大鼠随机分为4组:CIA组、GL组、GL+AG490组、AG490组。
1.2.2干预方法:参考《中药药理研究方法学》[6],根据人和大鼠计量折算系数确定给药量。AG490组与GL+AG490组给予足背静脉注射配制好的酪氨酸激酶抑制剂AG490(剂量为1 mL/只),GL组和GL+AG490组给予骨痨愈康丸506 mg/(kg·d)灌胃。Control、CIA、AG490组给予同体积0.9 %生理盐水灌胃。灌胃4周后取材。
1.2.3指标检测
1.2.3.1关节组织病理学观察:取大鼠左侧踝关节,用乙醇棉球消毒关节区域,逐层分离皮肤、肌肉组织,暴露踝关节,解剖关节软骨和滑膜,用4 %多聚甲醛固定。运用苏木精-伊红染色法将滑膜组织进行常规石蜡包埋、切片、染色,光镜下观察软骨和滑膜病理变化。
1.2.3.2血清生化指标检测:于末次灌胃后,各组大鼠禁食不禁水24 h,通过腹腔注射1 %戊巴比妥钠麻醉大鼠,行“三线定位法”心脏采血[7]。取血后,在4 ℃下以3 000 r/min离心20 min,按照ELISA试剂盒规范检测各组大鼠血清中TNF-α、IL-6、IL-17含量水平。
1.2.3.3免疫组化法检测JAK3、STAT3的蛋白表达:取大鼠踝关节,消毒,取出所需软骨和滑膜组织,固定,石蜡包埋切片,贴片。免疫组化染色,石蜡切片脱蜡和水化,自来水冲洗2次,PBS洗5 min ×3次;修复,3%的过氧化氢孵育15 min;加一抗,37 ℃复苏35 min,PBS洗5 min ×3次;加二抗,37 ℃孵育30 min,PBS洗5 min ×3次;加三抗,37 ℃孵育30 min;PBS洗5 min ×3次;DAB显色8 min,镜下观察,苏木素复染,室温,60 s,自来水冲洗,梯度乙醇脱水,二甲苯透明,封片。
1.2.3.4RT-PCR法检测JAK3、STAT3mRNA的表达:取大鼠右侧踝关节,消毒,逐层分离皮肤、肌肉、剥离出软骨和滑膜组织,-80 ℃保存。分别研磨软骨和滑膜组织提取总RNA,运用RT-PCR法检测,其引物序列如表1。结果采用2-△△CT法分析数据。
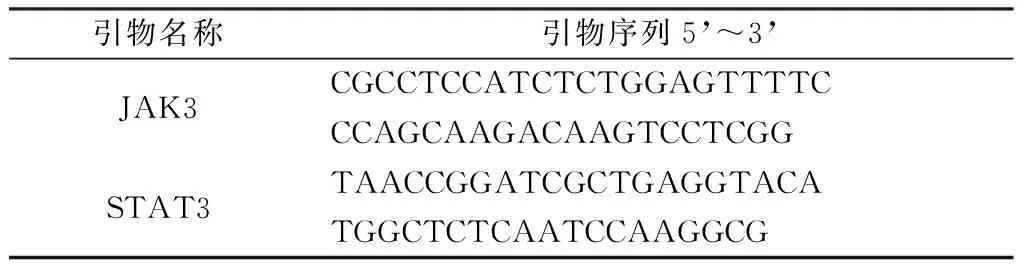
表1 引物序列Table 1 Primer sequences
1.3 统计学处理

2 结果
2.1 骨痨愈康丸对模型大鼠足趾厚度的影响
造模完成后,大鼠双后足足趾及踝关节出现红肿等炎症反应。与Control组相比,CIA、GL、GL+AG490、AG490组大鼠右足足趾厚度显著增厚(P<0.05);经过4周灌胃治疗之后,GL、GL+AG490、AG490组大鼠右足足趾厚度逐渐降低(P<0.05);其中,GL+AG490组改善最为明显。见表2。

表2 各组大鼠右足足趾厚度的比较
2.2 骨痨愈康丸对模型大鼠血清中TNF-α、IL-6、IL-17含量的影响
与Control组相比,CIA、GL、GL+AG490、AG490组大鼠血清中TNF-α、IL-6、IL-17含量显著升高(P<0.05);与CIA组相比,GL、GL+AG490、AG490组大鼠血清中TNF-α、IL-6、IL-17含量明显降低(P<0.05)。其中,GL+AG490组最为明显(P<0.01)。见表3。
表3 各组大鼠血清中TNF-α、IL-6、IL-17含量的比较
2.3 骨痨愈康丸对模型大鼠关节软骨和滑膜组织病理学的影响
各组大鼠关节软骨和滑膜病理切片HE染色显示,Control组软骨层发育正常,厚度均匀,软骨细胞形状呈圆形,排列规则,滑膜表面光滑无增生,无炎性浸润,染色均一,组织结构完整;CIA组软骨层变薄,部分软骨细胞核染色较轻,出现组织缺损,软骨细胞减少,滑膜增厚,细胞体积增大且炎性浸润明显,组织排列紊乱;GL组软骨层大部分缺损,但细胞排列疏松,分布散乱,染色较深,滑膜表面光滑,增生较少,细胞排列整齐;GL+AG490组软骨层厚度均匀,软骨细胞较多,排列较均匀紧密,滑膜变薄,滑膜细胞减少,排列趋向整齐,染色趋向均一;AG490组组织损伤,细胞较疏松,软骨层稍厚,滑膜层细胞较少,排列均匀,结构完整,无增生,表面光滑。见图1。

图1 各组大鼠关节组织病理学变化(HE染色,×200)Fig.1 Histopathological changes in the joints of rats in each group (HE staining, ×200)
2.4 骨痨愈康丸对模型大鼠关节软骨和滑膜组织JAK3、STAT3蛋白表达的影响
免疫组化法检测结果显示,与Control组相比,CIA组软骨和滑膜中JAK3、STAT3蛋白表达显著升高(P<0.01);经治疗后,GL、GL+AG490、AG490组软骨和滑膜中JAK3、STAT3蛋白表达由不同程度的降低(P<0.05)。其中,GL+AG490组效果最为明显。见表4。
表4 各组大鼠关节软骨和滑膜组织中JAK3、STAT3蛋白表达比较
免疫组化结果显示,Control组软骨和滑膜中阳性细胞较少,着色较浅;CIA、GL、GL+AG490、AG490组软骨和滑膜中阳性细胞由不同程度的增多。与Control组相比,CIA组软骨和滑膜中阳性细胞数量明显增多,着色较深;经治疗,GL、GL+AG490、AG490组软骨和滑膜中阳性细胞减少,着色较淡。其中,GL+AG490组软骨滑膜中阳性细胞减少最为明显。见图2、图3。

图2 骨痨愈康丸对模型大鼠关节JAK3蛋白表达的影响(×400)Fig.2 The effect of Gulao Yukang Pills on the expression of JAK3 protein in the joints of model rats (×400 )
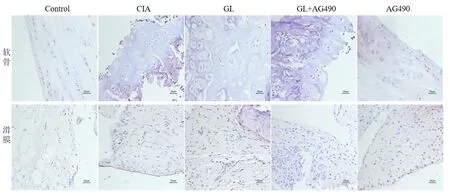
图3 骨痨愈康丸对模型大鼠关节STAT3蛋白表达的影响(×400)Fig.3 The effect of Gulao Yukang Pills on the expression of STAT3 protein in the joints of model rats (×400)
2.5 骨痨愈康丸对模型大鼠关节软骨和滑膜组织中JAK3、STAT3mRNA表达的影响
与Control组相比,CIA组大鼠关节软骨和滑膜组织中JAK3、STAT3mRNA表达明显升高(P<0.01);与CIA组相比,GL、GL+AG490、AG490组大鼠关节软骨和滑膜组织中JAK3、STAT3mRNA表达显著降低,其中GL+AG490组降低最为明显(P<0.05),见表5。
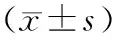
表5 各组大鼠关节软骨和滑膜组织中JAK3、STAT3mRNA表达比较
3 讨论
RA是一种常见的自身免疫性疾病,属于中医“痹证”范畴,《素问·痹论》曰:“风寒湿三气杂至,合而为痹也。”其中寒、湿二邪在RA发病过程中尤为重要。寒性收引凝滞,阻滞经脉,气血痹阻,表现为关节冷痛、僵硬;湿性重浊黏滞,阻碍气血,运行不畅,表现为肢体疼痛重着。寒湿夹杂,而致RA病情反复,缠绵难愈。《济生方·痹》曰:“皆因体虚,腠理空虚,受风寒湿气而成痹也。”指出正气虚弱为RA发生的根本原因;《黄帝内经·素问·直解》曰:“痹,闭也,血气凝涩不行也。”说明瘀为RA对关节破坏的关键因素[8]。祖国医学[9]认为多虚多瘀是RA特点,肾虚为本、血瘀为标,以补肾通络法为更本治疗法则。基于此治则研制骨痨愈康丸,本方由鹿角霜、全蝎、肉桂、蜈蚣、龟板、黄芪、鸡血藤、三七、阿胶、炮姜、清风藤、甘草、大枣组成,具有补肾活血、通络止痛之功效。骨痨愈康丸在减轻RA患者临床症状、改善骨质破坏、延缓病情发展等方面有独特的疗效[10]。
Janus激酶/信号转导和转录激活因子信号通路(janus kinase-signal transducer and activator of transcription,JAK/STAT)作为应激的炎症信号通路在RA炎症反应中有着重要的调节作用,与关节软骨和滑膜联系尤为密切,在RA的发病过程中有着重要影响,是近年来对于介导细胞因子信号转导方面研究较多的信号通路[11-12]。Janus激酶(JAK)是一类细胞内非受体酪氨酸激酶,通过与信号转导和转录激活因子(STAT)的相互作用,在细胞因子受体信号通路中发挥重要作用。JAK3/STAT3信号通路与多种免疫性炎症性疾病的发病机制有关,广泛参与RA关节滑膜组织增生、血管翳形成、炎症反应、细胞凋亡等病理过程[13]。
现代医学[14]认为RA的发病机制与免疫细胞(T细胞、B细胞等)和细胞因子(IL-4、IL-6、IL-10、IL-17、TNF-α等)密切相关,细胞因子刺激关节滑膜组织,诱发炎症反应。TNF-α、IL-6、IL-17等促炎细胞因子在RA的发病机制中有着至关重要的作用。TNF-α通过激活靶细胞诱导炎症反应并且与IL-6协同刺激B细胞和T细胞,促使分泌细胞免疫球蛋白,促使RA的发生;IL-17在RA的发展过程中一直处于较高水平,推动RA病情的发展[15-16]。JAK3作为JAK/STAT信号通路的重要组成部分,在免疫性疾病的发展过程中一直扮演着重要的角色,具有促进淋巴细胞的增殖和抗炎作用,JAK3功能紊乱或缺失会导致淋巴细胞免疫功能的丧失[17]。STAT3作为RA发病的起关键致病因子,具有抑制成纤维细胞的凋亡、促进血管生成的作用。STAT3功能紊乱会促进RA滑膜细胞增殖、血管翳生成、炎症反应加剧,进一步损害关节软骨[18]。
本研究结果显示,与CIA组相比,GL、GL+AG490组通过4周骨痨愈康丸灌胃治疗,模型大鼠关节畸形程度减轻,活动度增加,能够明显降低模型大鼠足趾肿胀度,有效缓解RA的症状;同时能够显著降低模型大鼠血清中促炎因子水平,减轻RA对关节的炎性刺激。通过病理切片显示,经过骨痨愈康丸的治疗,模型大鼠关节软骨侵蚀减轻、滑膜细胞减少、滑膜层变薄,有效减轻了RA对关节滑膜和软骨侵蚀与破坏,具有保护关节的作用。经免疫组化与RT-PCR实验分析得出骨痨愈康丸能够有效下调JAK3、STAT3蛋白及mRNA的表达,抑制JAK3/STAT3信号通路的激活,与JAK受体酪氨酸激酶抑制剂AG490具有相同的作用。
综上所述,骨痨愈康丸可能通过抑制TNF-α、IL-6、IL-17的表达来降低诱导炎症反应,抑制激活JAK3蛋白,进而阻断与STAT3的激活与磷酸化,降低STAT3蛋白活性,抑制RA的进一步发展。骨痨愈康丸可能通过下调JAK3、STAT3蛋白及mRNA表达,参与JAK/STAT信号通路的调控,从而减轻RA对关节软骨的侵蚀、抑制滑膜增生、减轻关节炎症反应。这可能是骨痨愈康丸防治RA的机制之一,但具体分子生物学机理仍需更深入的研究。
