骨质疏松性椎体骨折级联的风险因素
2023-02-26樊宇宇丁立祥宋红星侯宇易蒙王普石乔军杰方秀统
樊宇宇 丁立祥 宋红星 侯宇 易蒙 王普石 乔军杰 方秀统
首都医科大学附属北京世纪坛医院,北京 100080
随着世界人口老龄化的进程,骨质疏松性骨折成为一个日益增长的医药、社会和经济问题。据估计,在全球范围内,骨质疏松性骨折每3 s发生一次。椎体骨折是最常见的骨质疏松性骨折。作为一种骨质疏松性骨折,椎体骨折的发病率随年龄呈指数增长,它增加了其他脆性骨折的风险,并导致较高的社会成本和死亡率,椎体骨折患者的死亡风险是无椎体骨折患者的2.7倍。这种死亡率的增加与椎体骨折的数量和严重程度都有关[1]。
一个椎体发生骨折后,继发其他椎体再骨折的风险增加4~7倍,随着椎体骨折数目的增加,风险呈指数增长[2]。Habibi等[3]报道117例胸腰椎骨折的患者在6个月内有11例出现新发的椎体骨折。Ganguly等[4]发现既往椎体骨折患者发生新的椎体骨折的风险是其他患者的5倍,且有陈旧性椎体骨折的患者在随访过程中,每100例患者中有26.2例发生骨折。这种先前发生过椎体骨折的患者椎体骨折的发生率更高,这种连续发生的椎体骨折被称为“椎体级联骨折”(vertebral fractures cascade,VFC)。VFC发生的原因复杂,风险因素众多。在一些研究中,糖皮质激素的使用、先前骨折的部位、程度、数目、一些内分泌疾病、椎体成形术、抗骨质疏松药物的使用等都是VFC发生的相关风险因素。本研究通过收集患者的临床资料,进一步分析骨折部位、糖尿病、慢性阻塞性肺疾病、体质量指数等是否为VFC发生的风险因素。以确保医疗机构可以有效地整合椎体骨折预防的途径,让更多患者得到有效治疗,以减少继发骨折的发生。
1 资料与方法
1.1 临床资料
回顾性分析2015年1月1日至2020年12月31日在首都医科大学附属北京世纪坛医院诊断为骨质疏松性椎体骨折的444例患者的临床资料,其中存在骨质疏松性椎体级联骨折的患者共136例。纳入标准:(1)第一次椎体骨折发生在2015年1月1日之后,再次骨折发生在2020年12月31日之前;(2)椎体骨折的发生没有明显的暴力外伤史。排除标准:病理性椎体骨折的患者,包括多发性骨髓瘤及椎体原发及转移癌的患者。所有患者对于本次研究均知情同意。
1.2 研究方法
统计所有患者的年龄、性别、体质量指数(body mass index,BMI)、骨折的部位、骨密度(bone mineral density,BMD)、是否有糖尿病、是否有慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、是否有口服糖皮质激素史。按照是否发生椎体级联骨折分为两组:椎体骨折级联组和非椎体骨折级联组。分析两组患者间年龄、性别、BMI、骨折的部位、骨密度、是否有糖尿病、是否有COPD、是否有口服激素史的差异,分析椎体骨折级联反应发病的风险因素。
其中将椎体骨折级联定义为在统计期间曾两次及以上发生椎体骨折的患者;患有糖尿病定义为曾在医疗机构诊断为糖尿病,包括1型糖尿病(diabetes mellitus type 1,T1DM)和2型糖尿病(diabetes mellitus type 2,T2DM);口服激素史定义为曾因各种疾病长期口服糖皮质激素激素治疗(每日剂量大于等于强的松当量10 mg,治疗时间大于等于12个月);胸腰段骨折定义为首次骨折部位在胸10至腰2节段;为了区分骨质疏松症的严重程度,本研究将骨密度测定中,椎体(L1-L4)T值≤-3.0 SD的病例分开,使用第一次骨质疏松性椎体骨折时测定的骨密度,将T值≤-3.0 SD定义为严重骨质疏松。
1.3 统计学分析
先对患者数据进行描述性分析,其中连续变量采用中位数(四分位数间距)形式,分类变量统计其百分比。为了确定各种风险因素和椎体级联骨折是否存在关系,采用非参数检验对连续变量进行分析,采用二元Logistic回顾模型分析分类变量风险因素。对单因素分析中P<0.1的变量进行多因素分析以评估危险因素。P<0.05则认为差异有统计学意义。统计分析使用SPSS 25.0版本。
2 结果
2.1 椎体骨折级联发生的风险因素特点
在非椎体骨折级联组,共有308例患者,其中女性有231例(75.0%),年龄(77.58±9.07)岁,既往有糖尿病史的有53例(17.2%),曾口服激素治疗史的有72例(23.4%),有COPD病史的26例(8.4%),骨折部位发生在胸腰段的共185例(60.1%),T值≤-3.0的有116例(37.7%),BMI≥28 kg/m2的有116例(37.7%)。在椎体级联骨折组的患者中,有108例(79.4%)女性,既往有糖尿病史的有33例(24.3%),曾有口服激素治疗史的有46例(33.8%),有COPD病史的20例(14.7%),骨折部位发生在胸腰段的有109例(80.1%),T值≤-3.0的有63例(46.3%),BMI≥28 kg/m2的有63例(46.3%)。
2.2 各类风险因素对椎体骨折级联发生的影响
如表1所示,在单因素分析中,椎体骨折级联的危险因素包括既往有糖尿病史(P=0.084)、既往口服糖皮质激素治疗史(P=0.022)、患有COPD(P=0.048)、骨折发生在胸腰段(P<0.001)、严重骨质疏松(T值≤-3.0)(P=0.087)、BMI≥28 kg/m2(P=0.012)。采用非参数检验对年龄进行分析,说明两组间无明显差异(P=0.506)。且性别在两组间差异无统计学意义(P=0.314)。多因素风险分析中,椎体骨折级联的风险因素包括有糖尿病史(风险比为1.689,P=0.047)、既往口服糖皮质激素治疗史(风险比为1.839,P=0.010)、患有COPD(风险比为2.103,P=0.026)、骨折发生在胸腰段(风险比为2.686,P<0.001)、BMI≥28 kg/m2(风险比为1.769,P=0.010)。见表2。
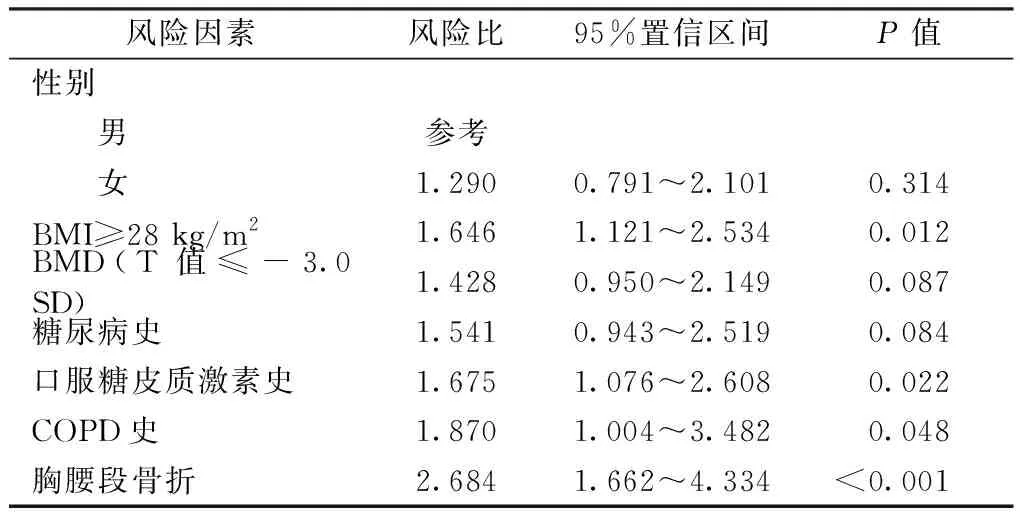
表1 单因素分析中椎体骨折级联的危险因素
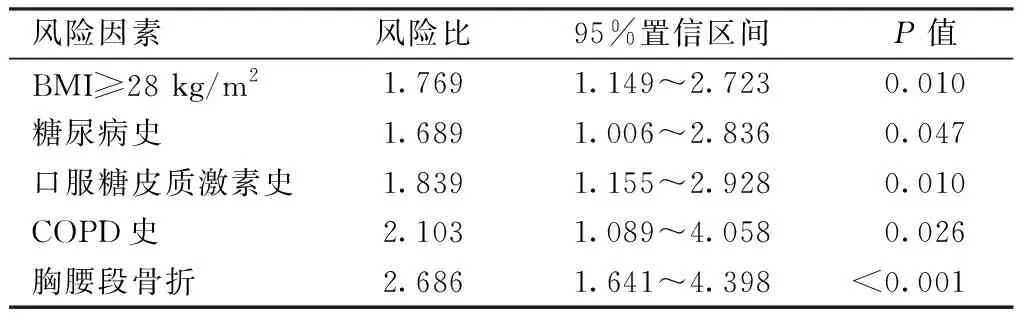
表2 多因素分析中椎体骨折级联的危险因素
3 讨论
本研究在多因素分析的危险因素评估中,有糖尿病史、既往口服糖皮质激素治疗史、患有COPD、骨折发生在胸腰段、BMI≥28 kg/m2确定为骨质疏松性椎体级联骨折的危险因素,重骨质疏松在多因素分析中不显著。
在之前的观念中,认为肥胖对骨折具有保护作用,因为肥胖会导致更高的BMD以及跌倒时软组织填充的保护作用。然而,最近的研究正在挑战肥胖对所有骨折都有保护作用的概念[5-7]。Paik等[8]研究表明,低体重与更低的椎体骨折独立相关。腰围越大,椎体骨折的风险越高。一项荟萃分析表明,在调整BMD后,较高的BMI与女性脊椎骨折风险显著增加相关[9]。这些发现表明,脂肪分布是VFC的一个重要预测因子,避免中枢性肥胖以及保持肌肉质量可能会降低老年女性患VFC的风险。本研究中,BMI≥28 kg/m2无论在单因素风险分析还是多因素风险分析中,均为VFC的显著风险因素,这与上述各报道结论部分一致。本研究没有单独分析在不同性别中BMI与VFC发生的相关性,且本研究数据中女性个体约占总样本的3/4,故结果可能具有一定的偏差,之后的研究可以更进一步。
一些研究发现,T1DM患者的面骨密度和体积骨密度均显著低于非糖尿病患者。相反,T2DM患者则均高于对照组。尽管T1DM和T2DM的BMD存在差异,但大型病例对照研究、系统评价和荟萃分析表明,这两种类型的糖尿病都与骨折风险增加有关[10-11]。Ha等[12]一项对6 548 784名韩国受试者进行的大规模、纵向、基于人群的队列研究表明,糖尿病患者的骨折风险高于非糖尿病受试者。在T1DM中,骨质疏松可能由于成骨细胞活性缺陷、胰岛素对骨骼合成代谢作用的缺失、骨-胰腺负反馈回路的去调节以及高血糖导致骨基质内晚期糖基化终产物(AGE)聚集,从而导致骨密度降低[13]。在T2DM中,与肥胖相关的脂肪因子和炎症因子的作用以及胰岛素和IFG-1升高引起的合成代谢效应可能导致骨量增加,但骨小梁评分(TBS)降低。TBS是T2DM患者骨小梁质量恶化的标志,已被认为有助于糖尿病患者骨折风险评估[14-15]。Koromani等[16]研究表明,T2DM患者与非T2DM患者相比,其股骨颈和腰椎的BMD较高,但TBS较低,这与年龄、性别、药物使用和BMI无关。Yamamoto等[17]的研究也表明,在2型糖尿病患者和由各种病因(包括1型糖尿病和类固醇治疗)引起的糖尿病人群中,TBS降低与椎体骨折风险增加之间存在关联。本研究中,既往有糖尿病史在单因素和多因素分析中均定为VFC的危险因素。说明在VFC发生过程中,患有糖尿病是VFC的独立风险因素。本研究由于数据统计有限,仅统计所有患者是否患有糖尿病,并没有进一步研究糖尿病的类型对VFC发生的影响,之后的研究可以对此进行进一步研究。
COPD和骨质疏松症有一些共同的危险因素,如吸烟、体重低、营养不良和缺乏运动。慢性阻塞性肺病骨量丢失的病因尚不完全清楚;很可能是多因素造成的,包括女性性别、皮质类固醇的使用、性腺功能减退、吸烟、缺乏运动、维生素D缺乏和慢性炎症[18-19]。本研究中,COPD为VFC的独立风险因素。之前的研究中,COPD可能与骨质疏松、跌倒高风险相关。在Gazzotti等[18]的研究中,COPD组骨质疏松症的发生率为29.7%,对照组为18.3%。COPD组椎体骨折发生率为18.6%,对照组为9.0%,导致骨折的跌倒频率分别为36.3%和7.3%。在Adas-Okuma等[20]的研究中,与对照组相比,患有COPD的受试者的BMD较低,骨质疏松症的几率增加了2.6倍。骨折的几率也比对照组个体高出近5倍。发生椎体骨折且既往患有COPD的患者,应高度重视其再次发生椎体骨折。
本研究在单因素和多因素风险分析中,骨折发生在胸腰段均为VFC发生的显著风险因素。更重要的是,骨折发生在胸腰段(T10~L2)是发生新椎体骨折的最重要的危险因素(风险比为2.686,P<0.001)。发生在胸腰段的骨质疏松性椎体骨折可导致胸部和腰部的后凸畸形。脊柱后凸度增加与脊柱骨盆参数恶化相关,即导致矢状面不平衡。进而患者的重心向前移动,行走时身体前倾,行走困难。因此,骨盆(包括脊柱)向后旋转以移动重心。在这个过程中,椎体前柱受力过大,会增加压缩性骨折的可能性[21]。在胸腰段椎体发生骨质疏松性椎体骨折后,其他椎体的弯曲力矩会随着整体矢状线的改变而改变。更高的扭矩可能与更高的椎体负荷以及随之而来的骨折风险增加有关[22]。Langella等[23]研究表明,脊柱对中不良与胸腰椎连接椎体骨折以及缺乏强有力的代偿机制(如胸椎后凸降低和下腰椎前凸过度)密切相关,从而导致椎体骨折级联的发生。对于椎体骨折发生在T10~L2的患者,要高度警惕该区域内骨折的再次发生。
BMD降低是骨质疏松的一个重要表现,同时绝大多数发生椎体骨折的病人其BMD都是降低的。在单因素分析中,严重骨质疏松被确定为一个重要的危险因素,而在多因素分析中没有,说明在危险因素之间的补偿过程中,其他因素在骨折的发展中发挥着更重要的作用。
长期糖皮质激素(glucocorticoid,GCs)治疗是骨质疏松性骨折的主要危险因素,也是继发性骨质疏松症的最常见原因。GCs对骨脆性的影响主要通过其对成骨细胞、骨细胞和破骨细胞的直接影响来实现[24]。GCs诱导的骨质疏松症的骨丢失是双向的,第一年内BMD降低6%~12%,随后每年约3%的骨丢失较慢。在GCs治疗开始后的前3个月内,骨折风险迅速增加[25-26]。在本研究中,长期使用糖皮质激素为VFC发生的独立风险因素,在之前的报道中也有相同的结果。在Koh等[27]的研究中,1 896 159例受试者经过2年的随访过程中,共有4 793例(0.25%)出现骨折,包括3 988例脊椎骨折和880例髋部骨折。与非使用者组相比,低剂量组、中等剂量组、高剂量组的脊椎骨折风险分别高出1.39倍、2.43倍和1.94倍。GCs使用的剂量、频率、持续时间以及用药方式等可能导致椎体骨折风险不同程度的增加[28-29],之后的研究可以从这些方面进行。
4 结论
本研究表明,有糖尿病史、既往口服糖皮质激素治疗史、患有COPD、骨折发生在胸腰段(T10~L2)、BMI≥28 kg/m2被确定为椎体骨折级联的独立危险因素,其中骨折发生在胸腰段(T10~L2)被确定为发生新椎体骨折的最重要的危险因素。医生在临床工作中对首次发生骨质疏松性椎体骨折进行诊治时,需要更多地关注患者是否有发生VFC的风险因素,以确保更多的患者及时得到干预,从而减少后续骨折的发生。此外,通过了解VFC患者的骨折风险因素,医生可以最有效地利用现有资源和定制治疗。
