免疫调控因子与骨密度评价绝经后骨质疏松症疗效的研究
2023-02-26尹纪伟毛未贤马倩倩高远
尹纪伟 毛未贤 马倩倩 高远
吉林省一汽总医院,吉林 长春 130011
骨质疏松症(osteoporosis,OP)是一种以骨量降低和骨组织微结构破坏为特征、导致骨脆性增加且易于骨折的代谢性疾病[1]。有数据[2]统计我国40岁以上人口的OP患病率达12.6%,女性明显高于男性,且我国女性患OP尤其是绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)的发病率远远高于欧美国家,与日韩等其他亚洲国家持平。由此可见,社会及个人都应重视PMOP这一公共健康问题。本研究拟探讨阿仑膦酸钠联合骨化三醇治疗PMOP患者后其免疫调控因子转化生长因子-β( TGF-β)、白细胞介素 17 ( interleukin-17,IL-17)、肿瘤坏死因子-α( tumor necrosis factor-α,TNF-α)与骨密度(bone mineral density, BMD)的相关性,以期为临床监测骨质疏松症治疗效果提供更多的观察指标。
1 资料和方法
1.1 资料
1.1.1研究对象:选取2019年5月至2020年6月在吉林省一汽总医院就诊的PMOP患者,按OP诊断标准[3]筛选入组88例,平均年龄(63.4±7.2)岁。排除继发性OP患者,如库欣综合征、吸收不良综合征与吸收不良相关的各种胃肠道疾病(如克罗恩病、慢性胰腺炎等)、类风湿关节炎、痛风等;排除甲状腺及甲状旁腺功能亢进或减退、成骨不全、低钙血症等影响骨代谢及血清钙代谢疾病者;排除半年内应用过影响雌激素水平药物者、接受过卵巢手术者、长期应用糖皮质激素者。
1.1.2实验仪器与试剂:美国Hologic Discovery WA型双能X线骨密度仪;美国Biotek公司Synergy H4全自动酶标免疫分析仪;细胞因子ELISA酶联免疫试剂盒(联科生物)。
1.2 方法
1.2.1骨密度测定:采用美国Hologic Discovery WA型骨密度仪检测受试者腰椎正位(L1~4)、股骨颈及全髋BMD。检测前应用体模校正,测量误差< 0.5%。
1.2.2采血:抽取受试者5 mL外周静脉血,促凝,当日离心分离血清,- 20 ℃冻存,用于检测免疫调控因子。
1.2.3免疫调控因子检测:采用美国Biotek公司Synergy H4全自动酶标免疫分析仪测定血清IL-17、TNF-α和TGF-β1。
1.3 统计学方法

2 结果
2.1 治疗前后受试者各部位骨密度测量结果比较
经阿仑膦酸钠联合骨化三醇治疗后,本研究中PMOP患者腰椎(L1~4)及股骨颈骨密度较治疗前普遍升高,差异有统计学意义(P<0. 05);全髋骨密度平均值较治疗前也稍有提高,但在统计学上无明显差异(P>0. 05)。见表1。
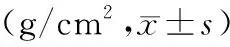
表1 治疗前后受试者各部位BMD测量结果比较
2.2 治疗前后受试者IL-17、TNF-α和TGF-β1检测结果比较
经阿仑膦酸钠和骨化三醇联合用药治疗后,受试者IL-17、TNF-α的检测结果较用药前下降,差异有统计学意义(P<0. 05);TGF-β1的检测结果显示升高,比较差异有意义统计学(P<0. 05)。见表2。
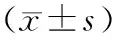
表2 治疗前后受试者IL-17、TNF-α、TGF-β的检测结果比较
2.3 受试者TGF-β1、IL-17、TNF-α与腰椎(L1~4)BMD的相关性分析
结果显示,受试者TGF-β1水平与腰椎(L1~4)BMD呈正相关(P<0. 05),IL-17、TNF-α水平与腰椎(L1~4)BMD呈负相关(P<0. 05)。见表3。

表3 IL-17、TNF-α和TGF-β1与腰椎(L1~4)BMD的相关性分析
3 讨论
在我国PMOP的发病率达50%,因其骨脆性增加的特性,PMOP患者较绝经后非骨质疏松人群更易发生骨折,而一旦发生骨折,其生存质量将严重受到影响[4]。连续监测骨密度是临床实践中监测评价疗效的重要手段[3]。国际临床骨密度测量学会、《原发性骨质疏松诊疗指南2017》、美国国家骨质疏松基金会都推荐将骨密度测量作为骨质疏松治疗过程中的常规监测指标[5-6]。本研究发现,接受治疗的受试者腰椎、股骨颈BMD均较治疗前升高,差异有统计学意义(P<0.05)。
女性绝经后因雌激素水平下降,导致机体免疫系统处于持续低度活化的状态,该状态又可导致机体促炎性状态的发生。TGF-β1、IL-17和TNF-α均通过参与调节骨骼系统和免疫系统代谢,影响成骨和破骨细胞的数量和活性,最终引起PMOP[7]。TNF-α是一个极其重要的骨吸收因子,PMOP患者雌激素水平下降可导致TNF-α水平增加,从而间接激活破骨细胞,致使骨丢失加快[8]。有研究表明[9],TNF-α可激活破骨祖细胞的分化以及破骨细胞前体细胞的有丝分裂,从而使新的破骨细胞数量增加。此外,TNF-α还可间接激活骨吸收陷窝的形成,致使破骨细胞骨吸收功能增强[10]。破骨细胞分化需要某些细胞因子的参与,而TNF-α可影响其中某些参与破骨细胞分化的细胞因子发挥其功能。IL-17通过诱导核因子-kB受体活化配体的表达,刺激破骨细胞并抑制成骨细胞,造成骨丢失,从而在破骨细胞的增殖、分化、活化过程中发挥着正向促进的作用[11]。有研究[12]发现,降低雌激素水平可诱导IL-17的产生,补充使用雌激素可降低IL-17的产生,由此推断出雌激素缺乏诱导IL-17的产生为PMOP发生的一个发病机制。CJ等[13]的研究也发现,降低IL-17的水平或抑制IL-17的受体均可降低骨量的丢失,证明IL-17与PMOP的发病有关。TGF-β既可以激活成骨细胞,使其增殖分化,促进骨生成,也可以阻止甚至逆转破骨细胞的凋亡[14]。邓盎等[15]研究发现,可通过调控雌激素受体β基因表达与否来调控成骨细胞TGF-β的表达,从而发挥对骨代谢的调控作用。TGF-β还可影响胶原合成,参与调节骨和软骨形成,促进骨修复[16]。Selvamurugan等[17]研究发现,TGF-β信号传导途径是促进成骨细胞分化、刺激骨形成的重要途径。由此可见,TGF-β具有很强的成骨和修复骨组织的作用,这一生化特点可使骨密度增加。有研究[18]发现,阿仑膦酸钠可诱导抑制骨吸收因子的产生,降低TNF-α水平,继而抑制破骨细胞发挥破骨作用,减少骨量丢失。维生素D3的重要代谢产物为骨化三醇,可有效促进人肠道主动吸收利用钙、磷等重要矿物质,促进未成熟破骨细胞逐渐转化为成熟细胞,刺激破骨细胞活性,促进骨骼矿化,增加BMD[19]。
本研究探讨了PMOP患者经阿仑膦酸钠和骨化三醇治疗后其免疫调控因子与骨密度的变化,并分析了二者的相关性。治疗后受试者血清免疫调控因子(TNF-α、TGF-β、IL-17)较治疗前变化显著,其中TNF-α、IL-17较治疗前降低,且与骨密度呈负相关,TGF-β较治疗前升高,进行相关性分析发现其与骨密度呈正相关。本研究结果显示,免疫调控因子与骨密度有相关性,可作为PMOP患者治疗疗效的观察指标,对治疗有效率评价具有重要的临床意义。
