含钌吸收液沉钌实验研究
2023-02-22陈辉杨皖明杨阳袁钢白平平朱刘
*陈辉 杨皖明 杨阳 袁钢 白平平,4 朱刘,,3
(1.广东先导稀贵金属材料有限公司 广东 511500 2.先导薄膜材料(广东)有限公司 广东 511517 3.广东省薄膜材料工程技术研究中心 广东 511517 4.广东省高性能溅射靶材技术与应用企业重点实验室 广东 511517)
引言
钌及其化合物具有良好的催化性能和抗高温耐腐蚀等特性,被广泛用于电子、化工与其他高科技术领域[1]。其中,因钌粉制备的钌靶材能够增加计算机硬盘的记录容量,使之成为生产硬盘的关键材料[2],其纯度、粒度和形貌是影响钌靶性能的重要因素[3]。
目前,工业上提纯钌粉主要包括溶解含钌物料、氧化蒸馏、吸收结晶、煅烧还原等步骤。结晶一般采取氯化铵沉淀法,通过加入氯化铵使钌与溶液分离,是钌从液体到固体的重要环节,是影响钌粉粒度与形貌的关键步骤。部分文献[4-5]研究了氯化铵沉钌条件对沉钌率和钌粉粒度与形貌的影响。现有方法不能实现钌与溶液的完全分离,且不能很好地控制钌粉的粒度和形貌,需要进一步进行研究,提高生产效率和产品质量[6]。
1.实验部分
(1)实验试剂与仪器
实验所用氯钌酸溶液成分见表1。

表1 氯钌酸溶液ICP-AES分析结果(g/L)
实验仪器为:管式气氛炉、酸碱浓度计、水浴锅、抽滤装置、电感耦合等离子体发射光谱仪(ICPOES)和扫描电子显微镜(SEM)等。
(2)实验原理
钌氧化蒸馏的产物被盐酸吸收形成了含钌吸收液,RuO4主要被还原成H3RuCl6和H2RuCl6。由于钌的低价铵盐易溶,会降低氯化铵沉钌的效率,故加入H2O2,使溶液中的钌转化为Ru(Ⅳ),再加入氯化铵使钌沉淀形
成(NH4)2RuCl6晶体,反应式如下:盐酸吸收RuO4:
(3)实验方法
依据设定的条件,取一定量的氯钌酸溶液,开启搅拌与加热,加入H2O2和盐酸,每组配置成100mL溶液,钌浓度为20g/L。加入NH4Cl固体进行反应,结束后抽滤得到沉钌母液和氯钌酸铵晶体。将氯钌酸铵晶体放入管式炉中烘干。利用ICP-OES检测沉钌母液中的钌含量,依据公式(5)计算沉钌率,同时利用SEM观察得到的氯钌酸铵晶体粒度与形貌,实验流程如图1所示。
式中,m和v是氯钌酸溶液中钌的质量浓度(g/L)和体积(L);m1和v1是沉钌母液中钌的质量浓度(g/L)与体积(L)。
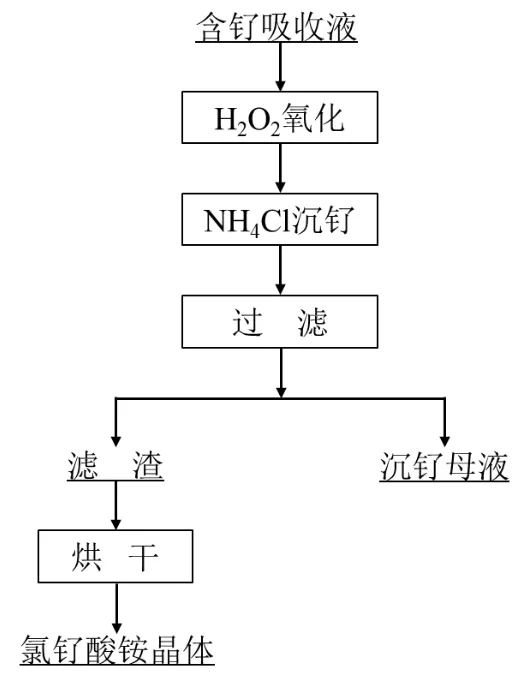
图1 实验流程图
2.结果与讨论
(1)(NH4)2RuCl6溶解实验

表2 25℃与80℃时盐酸浓度对(NH4)2RuCl6溶解度的影响
盐酸含量分别为0M、2M、4M、6M,氯化铵质量浓度分别为0g/L、20g/L、40g/L、80g/L;每组实验加入1g(NH4)2RuCl6固体配置成50mL溶液,搅拌2h后过滤,检测滤液中的钌含量。实验测定了(NH4)2RuCl6在不同盐酸浓度和不同氯化铵浓度下的溶解度,在25℃与80℃时,(NH4)2RuCl6在不同盐酸浓度下的溶解度分别如表2所示;在25℃时,(NH4)2RuCl6在不同盐酸浓度与不同氯化铵浓度下的溶解度如图2所示。
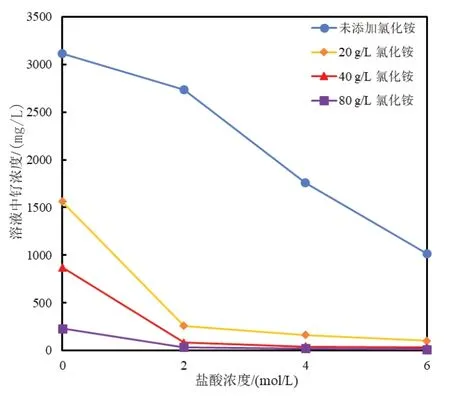
图2 25℃时盐酸浓度与不同氯化铵浓度对(NH4)2RuCl6溶解度的影响
由表2可知,(NH4)2RuCl6在室温下易溶于水,且其溶解度随着盐酸浓度增加而降低。可能原因是盐酸浓度的增加会抑制其溶解。由图2显示,氯化铵对(NH4)2RuCl6的溶解有极大的抑制作用。可能是由于共离子效应,添加的氯化铵越多,(NH4)2RuCl6的溶解度越低。随着盐酸与氯化铵浓度的增加,(NH4)2RuCl6溶解度先急剧降低,后趋于平缓。
(2)游离氯化铵浓度
向氯钌酸溶液中加入H2O2,并控制盐酸含量为6M,添加氯化铵至游离NH4Cl质量浓度依次为0g/L、5g/L、10g/L、20g/L、30g/L、40g/L(游离NH4Cl是指加入超过依据反应(4)计算的氯化铵理论量的量)。在室温条件下,反应1h。游离NH4Cl浓度与沉钌率的关系如图3所示,游离NH4Cl质量浓度为40g/L时产物SEM图像如图4所示。
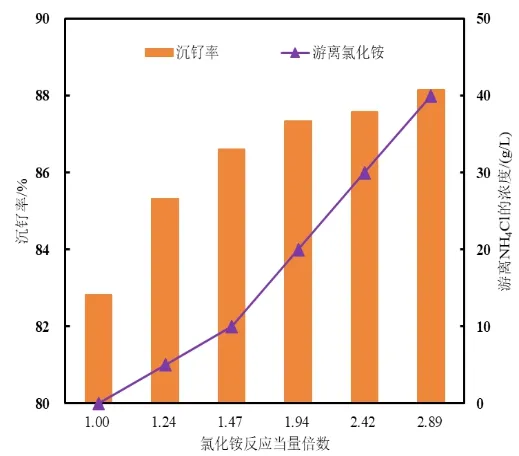
图3 游离NH4Cl浓度对沉钌率的影响

图4 游离NH4Cl浓度为40g/L下产物SEM图
由图3可见,随着游离NH4Cl浓度增加,沉钌率逐渐上升,之后增幅逐渐变小。可能是随着NH4Cl浓度增加,逐渐达到了充分生成(NH4)2RuCl6的临界点,同时其对(NH4)2RuCl6溶解度的影响幅度变小,导致沉钌率的上升幅度降低。当游离NH4Cl质量浓度达到40g/L时,沉钌率达到最大值。
由图4可见,加入氯化铵固体形成的(NH4)2RuCl6晶体颗粒尺寸分布不均匀、团聚现象明显;但增加游离NH4Cl浓度能形成较多细小的晶体颗粒。可能是晶体结构不一致,颗粒尺寸小是生成(NH4)2RuCl6单体,颗粒尺寸大是发生聚合反应(6)生成(NH4)4Ru2OCl10二聚体[7]。游离NH4Cl浓度升高,过饱和度增加,产生更多的晶核数量,从而形成较多细小的晶体颗粒。
聚合反应:
(3)溶液盐酸浓度
取4份氯钌酸溶液,先加入H2O2,再控制盐酸含量依次为2M、4M、6M、8M,添加NH4Cl至游离NH4Cl质量浓度为10g/L,在室温条件下,反应1h。溶液中盐酸浓度与沉钌率的关系如图5所示,溶液盐酸含量为6M时产物SEM图像如图6所示。
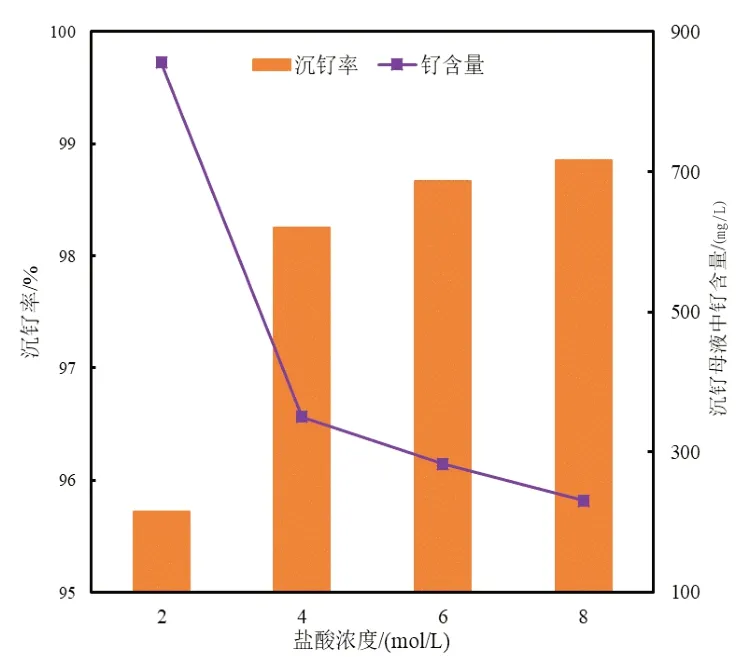
图5 盐酸浓度对沉钌率的影响

图6 盐酸浓度为6M的产物SEM图
由图5可见,随着盐酸浓度增加,沉钌率先上升后基本趋于平稳。可能是盐酸浓度增加,降低了(NH4)2RuCl6在溶液中的溶解度,进而使沉钌率上升;继续增加盐酸浓度对(NH4)2RuCl6溶解度的影响变小,沉钌率几乎不变。
由图6可见,提高盐酸酸度使得(NH4)2RuCl6晶体颗粒尺寸大小各异,分散性较差。溶液pH值一般是通过影响产物溶解度、改变体系杂质的活性和产物晶面的增长速度来改变产物形貌[8]。可能是含钌氯化物在不同盐酸浓度条件下存在的形式不同,导致生成不同粒度形貌的晶体。
3.结论
本文对含钌吸收液沉钌过程中沉淀条件对沉钌率及晶体粒度和形貌的影响进行了研究,结果如下:
(1)氯钌酸铵易溶于水,其溶解度随着盐酸和氯化铵浓度增加而降低;升高温度能提高氯钌酸铵的溶解度;盐酸含量为6M时,室温与高温条件下的溶解度基本一致[9]。
(2)在一定范围内,增加游离NH4Cl和盐酸浓度能较大幅度提高沉钌率;提高反应温度和反应时间可略微提高沉钌率。
(3)增加游离NH4Cl浓度和反应时间能产生更多晶核,形成更多的细小颗粒;改变盐酸浓度影响晶体的粒度与形貌;提高反应温度能细化晶体颗粒。
