圈养与散放、野生鸟类肠道菌群差异的Meta分析
2023-02-22伍一宁邹红菲
王 焕,伍一宁,2,邹红菲,王 贺
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.黑龙江省科学院自然与生态研究所,哈尔滨,150040)
肠道微生物是指在宿主肠道内定殖全部微生物区系,包括细菌、真菌、古细菌、病毒和原生生物等。肠道微生物与宿主长期协同进化、密不可分,发挥着多种多样的功能,包括物质合成与代谢、生物屏障、免疫调控及宿主防御等[1]。
鸟类的生活史特征多种多样,如迁徙行为、飞行能力、饮食、交配系统、寿命和生理学等,都可能影响肠道微生物群落[2-4],Zhang 等[5]总结了18 种迁徙水鸟的肠道菌群数据,发现高丰度的棒状杆菌(Corynebacterium)可能有助于候鸟最大限度地积累脂肪,高丰度的梭杆菌属(Fusobacterium)可能与宿主的食肉性饮食相关。
目前,对自然条件下野生鸟类胃肠道微生物群落的研究报道较少[2],鸟类肠道菌群研究主要基于人工圈养环境下采集的鸟类盲肠提取物或粪便样品等。动物被置于圈养环境中,代谢率、身体状况、激素分泌和其他功能会发生变化[6]。
本研究利用已发表的15 篇文献及本课题组的1项研究共33 组有效数据,通过Meta 分析圈养与野生、散放与圈养对鸟类肠道微生物群落组成的影响,为濒危鸟类人工种群的野化放归提供理论依据。
1 研究方法
1.1 文献检索
2021年7月开展研究,文献主要来自2个电子数据库(Web of Science和CNKI),检索策略及主要关键词和短语包括:圈养(captive breeding/ranching/feed in a pen/stable breeding)、野生(wild/uncultivated/feral/wildness)、鸟类(birds/aves/birdlife/avian)和肠道微生物(intestinal microbe/intestinal bacteria/intestinal microflora/gut microbiota);饲养模式(feeding pattern/yard feeding pattern/feeding patterns/raising model)、鸟类和肠道微生物。在搜索所有候选文章后,依次纳入和排除标准进一步筛选。
1.2 文献选择
入选文献需符合标准:全文英文或中文研究文献;文献中的研究物种为鸟类;粪便样本或盲肠提取物等消化道样本用于肠道菌群分析;16S rRNA 的高通量测序方法;包含野生与圈养或圈养与散放鸟类肠道微生物比较内容。
1.3 数据提取
确定纳入的文献之后,提取的主要信息有作者、发表年份、鸟类物种、样本种类、肠道微生物研究方法、野生与圈养或圈养与散放条件下鸟类肠道微生物群落组成(优势菌门及优势菌属),提取文献中已直接发表的数据统计分析,图片数据通过Web Plot Digitizer 4.5提取。
1.4 数据分析
Meta分析是将来自不同研究的结果合并成一个单独估计值的统计方法[7]。提取肠道优势菌门、菌属的平均相对丰度,将这些连续变量表示为平均值±标准偏差(SD),为连续变量结果选择95%置信区间的加权平均差(weighted mean difference,WMD)作为效应指标。I2统计值和Q检验用于评估异质性。当统计学异质性不显著时使用固定效应模型(I2≤50%,或P>0.05)进行Meta 分析;当异质性显著时使用随机效应模型分析(I2>50%,或P≤0.05),获得汇总估计值。此外,通过逐一剔除纳入的研究,再进行效应量合并的敏感性分析评估Meta 分析结果是否稳定,寻找异质性的来源。如果敏感性分析前后的结果没有本质上的改变(无改变或者变化不大),说明Meta分析的结果较为可信,反之则说明存在影响效应量的潜在重要因素,在解释结果和下结论时应非常慎重[8]。利用R 4.0.4 的Meta 软件包进行数据分析,若置信区间包含0,说明两组差异不显著,若置信区间全部>0,说明试验组丰度显著增高,反之则说明试验组显著减少;采用SigmaPlot 14.0 软件作图展示Meta分析的结果。
2 结果
2.1 选择研究对象
通过数据库检索共确定了1 624 项研究,还有9项通过参考文献反向补充以及1 项本课题组的研究。根据筛选标准确定了39 项研究,排除数据不足文献后最终将15 篇文献[9-23]及本课题组的1 项研究纳入Meta分析。共提取有效数据33组,其中野生与圈养鸟类肠道优势菌门12组,优势菌属8组;散放与圈养鸟类肠道优势菌门8组,优势菌属5组。共有15种鸟类被纳入研究,包括褐几维鸟(Apteryxaustralis)、斑头雁(Anserindicus)、东方白鹳(Ciconiaboyciana)、鸿雁(Ansercygnoides)、丹顶鹤(Grusjaponensis)和多种鸡形目(Galliformes)等。
2.2 圈养与野生鸟类肠道菌群的比较
2.2.1 肠道优势菌门的变化
在门水平上,敏感性分析表明所列结果均稳定。Meta 分析结果表明圈养过程会导致厚壁菌门(Firmicutes)的丰度显著增加(WMD=0.16[0.03,0.30],P=0.020);拟杆菌门(Bacteroidetes)的丰度显著下降(WMD=-0.07[-0.10,-0.04],P<0.001);绿弯菌门(Chloroflexi)的丰度显著下降(WMD=-0.10[-0.15,-0.05],P<0.001),Meta 分析包含的数据较少,结果不够稳定;变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)和脱铁杆菌门(Deferribacteres)的变化没有统计学差异(图1A)。
2.2.2 肠道优势菌属的变化
在属水平上,敏感性分析结果稳定。Meta 分析结果表明圈养过程会导致梭菌属(Clostridium)的丰度显著下降(WMD=-0.17[-0.26,-0.08],P<0.001);拟杆菌属(Bacteroides)的丰度显著下降(WMD=-0.06[-0.08,-0.04],P<0.001);双歧杆菌属(Bifidobacterium)的丰度显著下降(WMD=-0.01[-0.02,0.00],P<0.001);粪球菌 属(Coprococcus,WMD=0.02[0,0.04],P=0.050)和布劳特氏菌属(Blautia,WMD=0.07[0.02,0.11],P=0.005)的丰度显著增加;乳杆菌属(Lactobacillus)、放线菌属(Actinomyces)和史雷克氏菌属(Slackia)的变化没有统计学差异(图1B)。

图1 圈养相比野生鸟类肠道菌群组成的变化Fig.1 Comparison of intestinal flora composition between captive and wild birds
2.3 散放与圈养鸟类肠道菌群的比较
2.3.1 肠道优势菌门的变化
在门水平上,拟杆菌门分析中的1组数据会造成较高的异质性,剔除后I2由99%降为68%,且P值由0.520变为0.003[9];放线菌门中剔除一组研究后I2由81%降为0,且P值由0.170变为0.001[23]。Meta分析结果表明,散放会显著增加鸟类肠道优势菌门中拟杆菌门(WMD=0.07[0.02,0.12],P=0.003)和放线菌门(WMD=0.04[0.02,0.06],P<0.001)的丰度,而厚壁菌门、梭杆菌门和变形菌门的丰度没有显著变化(图2A)。
2.3.2 肠道优势菌属的变化
在属水平上,乳杆菌属中研究的1 组数据会造成较高的异质性,剔除后I2由58%降为0,P值由0.640 变为0.100,且菌属数据较少,敏感性较高[10]。Meta 分析结果表明,散放条件下鸟类肠道菌群中Olsenella的丰度显著低于圈养条件下(WMD=-0.02[-0.04,0],P=0.020),但Olsenella的包含数据较少,结果不够稳定;Turicibacter、柯林斯氏菌属(Collinsella)、拟杆菌属和乳杆菌属的变化没有统计学差异(图2B)。
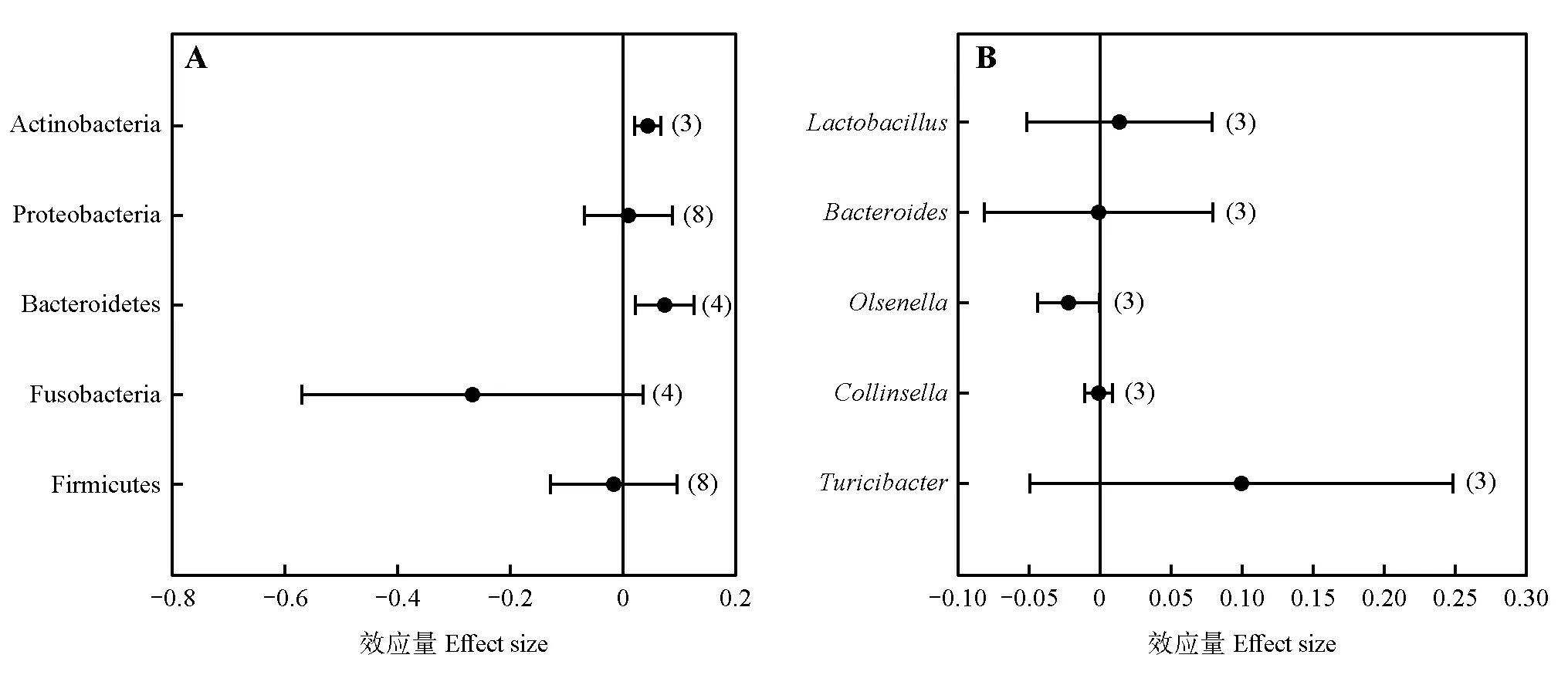
图2 散放相比圈养鸟类肠道菌群组成的变化Fig.2 Comparison of intestinal flora composition between free-range and captive birds
3 讨论
3.1 圈养与野生鸟类肠道菌群的差异
圈养与野生状态下鸟类的优势菌门Meta 分析结果表明,圈养过程会导致厚壁菌门的丰度显著增加,而拟杆菌门的丰度显著下降。拟杆菌门是大多数脊椎动物胃肠道中的常见细菌,主要参与碳水化合物的代谢和脂质的水解,帮助宿主从饮食中获取营养[24-25],有助于丙酸盐、α-淀粉酶和其他负责淀粉和聚合物质分解酶的合成[26],丙酸盐有助于肝脏中的糖异生,促进饱腹感和降低胆固醇[27]。野生鸟类通过拟杆菌门产生更多的丙酸盐以促进糖异生和提升饱腹感来应对野外食物不够充足的情况,而圈养条件下鸟类食物充足,不需要更高丰度的拟杆菌门。圈养鸟类肠道中厚壁菌门的增加及拟杆菌门的减少可能与圈养条件下高糖高脂的饮食及鸟类体重的增加相关。绿弯菌门在圈养环境中丰度显著下降,绿弯菌门是一类通过光能自养和光能异养等方式产生能量的细菌,广泛分布于土壤、湖泊和海洋等环境中[28],Wu 等[13]是绿弯菌门Meta 分析中唯一可以评估的文献,研究的物种东方白鹳是典型的湿地鸟类,推测野生东方白鹳肠道中较高丰度的绿弯菌门可能来自湿地环境,通过饮食等将该细菌水平传播至体内。
圈养与野生状态下鸟类的优势菌属Meta 分析结果表明,圈养条件下梭菌属、拟杆菌属和双歧杆菌属的丰度更低,而粪球菌属和布劳特氏菌属的丰度更高。梭菌属广泛分布于自然界,其中一些细菌对大多数脊椎动物具有致病性,黑美洲鹫(Coragyps atratus)以腐肉为食,微生物区系显示梭菌属和梭杆菌门的比例非常高[29]。野生鸟类肠道中梭菌属的比例较高,具有患病风险,可能是野外环境水源等污染,而圈养鸟类饮食更加干净卫生,也会定期注射疫苗,所以圈养鸟类肠道中梭菌属的丰度更低。拟杆菌属除了具有广泛的机制利用结肠中的复杂多糖以产生对宿主有益的短链脂肪酸外[30],基因组的高度可塑性,经常通过基因重排、基因复制和横向基因转移进行重组,很容易适应不同的生态位[31],推测高丰度的拟杆菌属有助于野生鸟类适应复杂多变的野外环境。双歧杆菌属于放线菌门,产生乳酸作为葡萄糖发酵的主要产物,对宿主肠道生态系统产生有益影响[32],通过“双歧分流”产生醋酸盐,保护宿主免受肠道致病性感染[33],野生鸟类肠道中双歧杆菌属的丰度更高可能与饮食多样,活动量大,体型较瘦有关,而圈养鸟类普遍缺乏足够的活动量,导致体重增加,抗生素的使用更为频繁,圈养环境下的特定压力(如热应激)等导致肠道内双歧杆菌属的丰度更低。粪球菌属在圈养鸟类体内丰度更高,圈养条件下高脂高糖的饮食以及缺乏活动量导致体重增加引起了该菌属在肠道中的富集。布劳特氏菌属的相对丰度与内脏脂肪面积呈显著负相关,通过调节G 蛋白偶联受体(G protein-coupled receptor,GPR)41 和43 减少肥胖[34],圈养鸟类体内该菌属的丰度更高,可能是肠道微生态系统为了避免圈养鸟类过于肥胖进行的一种微生物的适应与调节方式。
3.2 散放与圈养鸟类肠道菌群的比较
散放与圈养鸟类肠道菌群优势菌门的比较中,Ocejo 等[9]的圈养肉鸡样本是在一项实验研究的框架下获得的,是评估日粮中添加干乳清粉、丁酸钙或两者的组合对肉鸡生产性能等的影响,推测是这两种物质的组合添加提高了圈养肉鸡拟杆菌门的丰度,造成了高异质性。Ferrario 等[23]的高异质性可能是散放组样本的来源造成的,散放样本来自5 只鸡,其中3 只母鸡来自室外运行的鸡舍内但紧邻圈养肉鸡,也许是与圈养肉鸡的近距离接触造成了两种模式的样本比较接近,形成了高异质性。圈养过程导致鸟类肠道菌群中拟杆菌门丰度的显著下降,但散放模式会显著增加拟杆菌门的丰度。散放模式下鸟类肠道菌群的拟杆菌门丰度与野生鸟类更为接近,说明散放作为珍稀鸟类野化放归的过渡阶段起到了重要的作用,散放有利于珍稀鸟类的野化放归。同时,散放也显著增加了放线菌门的丰度,放线菌门是肠道微生物群的4 个主要门之一,尽管只占很小的比例,但在维持肠道内环境稳定方面起着关键作用[32]。散放相比圈养增加了鸟类肠道中放线菌门的丰度,可能是散放减轻了鸟类在圈养条件下的应激,放线菌门的双歧杆菌丰度降低与压力有关,但在该项Meta 分析中菌属丰度太小且数据较少,无法获取双歧杆菌属在两种饲养模式下的变化。
散放与圈养鸟类肠道菌群优势菌属的比较中,其中一组数据的异质性高可能是由于蛋鸡的饮食造成的,散放和笼养蛋鸡的日粮都主要为豆粕,含大豆的饮食与笼养环境的协同作用可能影响蛋鸡乳杆菌属的丰度[10]。Meta分析结果表明散放条件下鸟类肠道菌群中Olsenella的丰度显著低于圈养条件下,由于只有1 组有效数据,该项结果不够稳定。Olsenella是将碳水化合物主要发酵成乳酸的放线菌类成员[35],乳酸菌通常被视为各种动物宿主的健康促进菌[36],帮助消化,维持肠道菌群平衡,降低血清胆固醇和提高免疫力等,可能弥补圈养条件下活动量的不足,适应微生物的调节。
本研究得到一些关于圈养与野生、散放与圈养条件下鸟类肠道菌群的变化结果,但存在一定的局限性。宿主遗传和饮食被认为是影响肠道微生物群落的两个关键因素[37],由于鸟种不同,食性习性的差异导致肠道菌群的每项研究结果存在差异,在数据整合分析上受到限制,导致样本量较小,散放与圈养条件下双歧杆菌属的Meta 分析结果无法评估,鸟种的不同是异质性的主要原因。Meta分析的样本量有限,很多结果无法使用漏斗图评估发表偏倚,但仍然可以提供科学证据。
本研究证实了圈养与野生鸟类在肠道菌群组成上存在较大差异;散放会消除一部分圈养的影响,与野生鸟类肠道菌群更加接近,但也存在一定差异,可能与人工辅助有关,此结果为珍稀鸟类的人工种群野化放归前益生菌的合理选择提供了依据。
