基于丝蛋白纳米颗粒负载抗癌药物递送系统的研究进展
2023-02-21吴建兵李靖雯周欣楠孙银银王永峰
吴建兵, 李靖雯, 周欣楠, 孙银银, 王永峰
(1.常熟理工学院 纺织服装与设计学院,江苏 苏州 215500; 2.中国科学院 苏州纳米技术与纳米仿生所国际实验室,江苏 苏州 215123)
癌症已严重威胁人类生命健康,随着全球老年化进程加快,癌症发病率和致死率都在迅速上升,给家庭和社会带来沉重负担[1]。手术切除和放射疗法是目前最直接、最有效的治疗手段,但仅适用于局部和非转移性肿瘤。早期癌症具有隐匿性,当病人出现不适症状时已发展到中晚期,只能依靠化学疗法控制[2]。抗癌化疗药物在人体分布具有随机性,癌细胞被杀伤的同时也会损伤正常细胞。除此之外,抗癌药物存在血液循环清除快、易脱靶,生物利用度低等问题[3]。因此化学疗法的弊端逐渐显现,包括给药次数多,周期长,且对器官毒副作用大,易诱发神经病变、自身免疫系统及泌尿生殖系统功能障碍。从而导致其疗效不佳,病人顺应性差[4]。如何针对中晚期癌症病人,灵活选择对患者顺应性高、抗毒副作用低、生物利用度高、耐受性好的治疗方法是目前医学界亟须解决的关键问题。利用肿瘤组织与正常组织环境的差异,包括血管密度、渗透性及细胞外基质中特异性蛋白等来设计多功能靶向给药系统,使得药物能在较长时间内滞留在肿瘤微环境中,促使癌细胞彻底凋亡且不再复发、转移是抗癌药物精准高效治疗的有效策略。
抗癌药物递送系统是将抗癌药物装载在无机或有机高分子聚合物基质中,通过不同给药途径进入人体,再经血液循环将药物递送至癌变部位,在较长时间内维持药物治疗浓度,充分发挥药物疗效的技术[5]。因此,在稳定药物活性、精准靶向给药、控制药物释放、降低药物毒性、提高药物疗效等方面具有突出优势。递送载体尺寸决定了给药方式,纳米级一般经静脉注射后通过全身血液循环到达肿瘤部位[6];而微米级需要通过局部给药锁定在靶向实体瘤中,长时间不断地向肿瘤微环境中释放药物,维持药物浓度[7]。相比于微米级载体,纳米级可直接经被、主动方式进入癌变细胞内,靶向更精准,可显著提高药物生物利用度[8]。被动靶向是指递送载体能在血液循环中利用肿瘤组织与正常组织中的血管密度及渗透性差异自发滞留,或作为异物被免疫系统中的巨噬细胞吞噬等途径进入细胞中;主动靶向是指在递送载体表面先修饰靶向分子,再与肿瘤微环境中的特异性受体结合后经胞吞作用进入细胞中,完成药物释放,促使癌细胞凋亡,作用方式如图1[9]所示。
抗癌药物在靶向递送过程中,存在一系列问题,包括易与血浆蛋白之间发生非特异性吸附,易被肾脏排泄或被肝脏中的网状内皮系统(Reticuloendothelial system, RES)摄取,使得靶器官中的药物浓度低,生物利用度差。将抗癌药物负载在纳米脂质体中减少肾排泄较易被实现[10],而如何减少并避免药物被肝脏RES摄取仍是重大挑战。目前使用高分子聚合物纳米颗粒进行药物递送是解决该问题的高效方法之一[11]。载体材料的稳定性和生物相容性是抗癌药物递送系统研究的前提和基础。作为抗癌药物递送的纳米颗粒在制备及功能化设计时需要考虑四条原则:1) 稳定抗癌药物活性、降低抗癌药物在血液循环中的损失及对正常组织的毒副作用;2) 需对其进行化学修饰,避免直接被人体代谢器官例如肝脏中的免疫细胞及血管内皮细胞等清除,延长其在血液循环中的滞留时间;3) 充分利用肿瘤微环境促使纳米微粒透过内皮富集作用,加快其透过血管内皮,再渗透至靶向部位;4) 持久可控释放,加快肿瘤细胞凋亡同时降低耐药性风险[12]。目前载体材料来源主要包括天然聚合物和合成聚合物两种。合成聚合物主要以聚乙烯醇(Polyvinyl alcohol,PVA)[13],聚乙二醇(Polyethylene glycol,PEG)[14],聚己内酯(Polycaprolactone,PCL)[15],聚乙醇酸(Polyglycolic acid,PGA)[16],聚乳酸羟基乙酸共聚物(Poly lactic-co-glycolic acid,PLGA)[17]为主,尽管合成聚合物在抗癌药物递送系统中的研究取得突破进展,但在实际应用中仍存在问题。如PLGA等聚合物材料体内降解时的酸性产物会与大分子抗癌药物发生酰化反应[18];在药物制剂高温灭菌过程中,PLGA等会发生降解,无法对抗癌药物起到稳定和保护。另外,在纳米颗粒制备过程中添加有机溶剂、引发剂等化学物质,药物制剂存在安全隐患[19]。相比合成聚合物,天然聚合物可塑性强,可通过物理或化学方法灵活、高效负载抗癌药物,稳定抗癌药物活性的同时,实现抗癌药物的可控、精准释放,且能在自然环境中进行酶降解,降解产物对人体和环境均无害[20]。基于此,本文重点对作为天然聚合物热点材料之一的丝蛋白,从丝蛋白的结构与性能、丝蛋白纳米颗粒(Silk fibroin nanoparticles,SF NPs)的制备方法机理及优缺点、理化性能(粒径、表面电荷、稳定性)对抗癌药物装载、释放的影响及其用于被、主动靶向中的具体研究进展进行详细阐述,为发展基于SF NPs负载抗癌药物实现高效递送及治疗研究提供思路。
1 丝蛋白的结构与性能
国内外已有多项研究证实,蚕丝或蜘蛛丝中的丝蛋白具有优异的生物相容性、极低的免疫原性,且已经作为生物材料被广泛运用[21-22]。蜘蛛丝力学和防水性能优异,但同类相食,产量低、成本高,来源受限[23]。目前,家蚕和柞蚕是丝蛋白最主要的两类来源(图2)[24]。蚕丝蛋白由18种氨基酸组成,基本结构是由相对分子质量约为350 kDa的重链、25 kDa的轻链及起连接作用的二硫键构成的二聚体。蚕丝蛋白(Silk fibroin,SF)由疏水结晶区和亲水非结晶区交替构成(图3)[24],其中,结晶区由α-螺旋、β-折叠(亚稳定状态正交晶系的Silk Ⅰ-平行β-折叠、稳定状态单斜晶系的Silk Ⅱ-反平行β-折叠)两种蛋白质二级结构构成。

图2 丝蛋白的关键优势特性Fig.2 Key advantageous properties of silk proteins
相比无定形态和Silk Ⅰ,Silk Ⅱ的构象最稳定(图4)[25]。SF二级结构可相互转换,全水相下的SF以无规卷曲为主,其在外界因素影响下,例如温度[26]、湿度[27]、pH值[28]、剪切力[29]、金属离子[30]、溶剂种类[31]等条件可促使无规卷曲向β-折叠转变。因此利用这些特性可调控SF中无定形、Silk Ⅰ、Silk Ⅱ三者之间的比例,增加SF NPs中Silk Ⅱ的比例有助于疏水性抗癌药物,包括姜黄素、紫杉醇装载效率的提升[12],且载体基质的稳定性、降解性、抗癌药物的负载及释药性能均可调控。总而言之,SF在抗癌药物递送方面具有显著优势:1) 具有优异的生物相容性、生物安全性,免疫原性低;2) 高度重复的疏水晶体与亲水非晶体交替排列,可形成纳米微纤网络,有利于小分子抗癌药物的高效负载并实现可控释放;3) 具有丰富的活性氨基酸,例如酪氨酸、赖氨酸、精氨酸等,可为抗癌药物的共价耦联或化学修饰提供足够的反应位点,有助于主动靶向递送;4) 可在全水相下自组装形成纳米颗粒,避免了有机溶剂添加对多肽、蛋白质等具有生物活性抗癌药物稳定性的影响[9],药物疗效和生物安全性得到保证;5) 明胶等高分子材料易在高温下发生变性交联反应和降解,而SF作为结构蛋白,可与多种灭菌方法兼容,作为抗癌活性药物制剂的稳定剂和保护剂;6) 可被细胞内溶酶体降解后补充天然组织的营养成分,能满足载体降解的关键要求。因此SF可成为理想的抗癌药物递送载体材料。
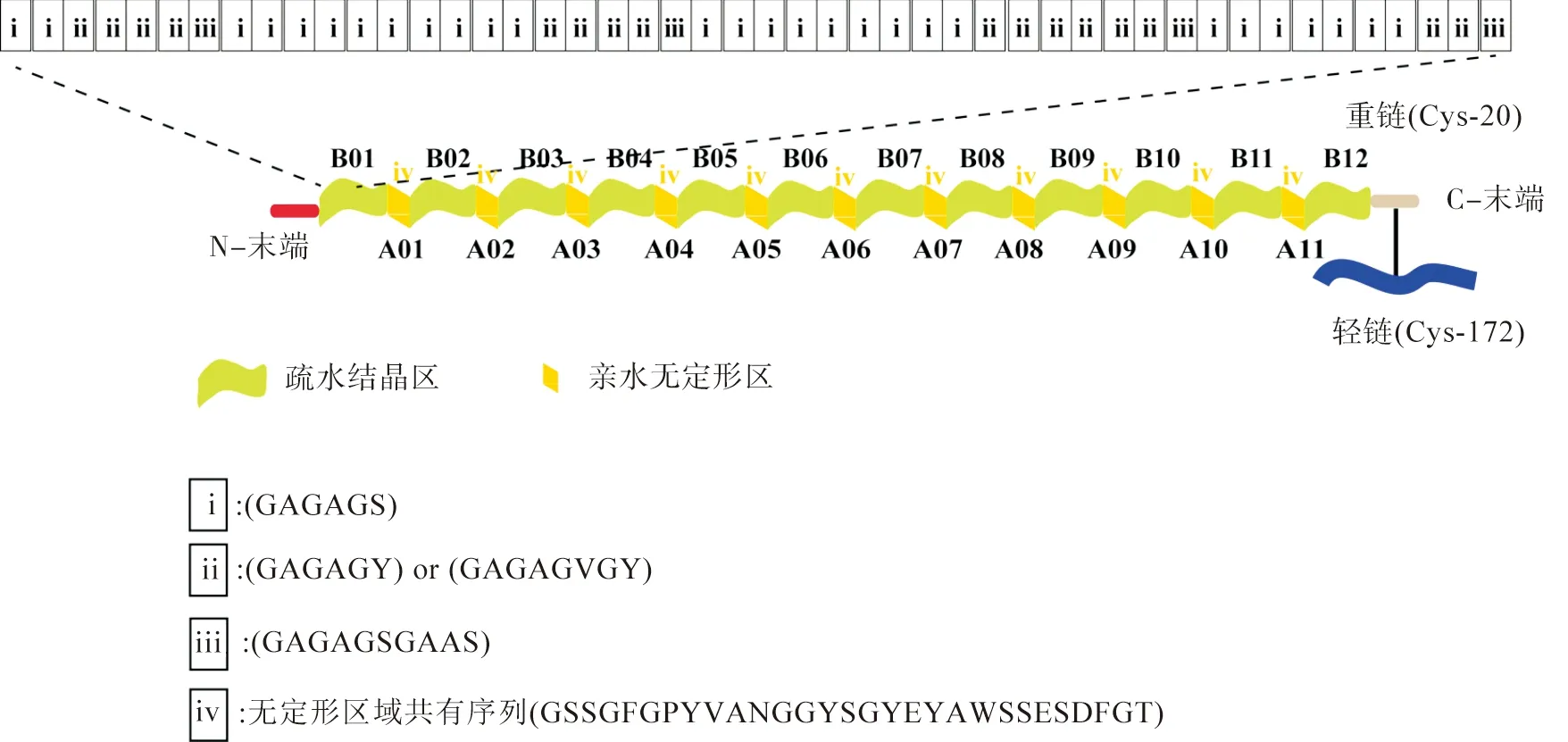
图3 蚕丝蛋白一级结构和二级结构之间关系的示意Fig.3 Schematic diagram of the relationship between primary and secondary structure of silk fibroin

图4 桑蚕丝蛋白的二级结构Fig.4 Secondary structure of mulberry silk protein
2 SF纳微米颗粒的形成原理及制备方法的优缺点
SF由亲水氨基酸(如谷氨酸)和疏水氨基酸(甘氨酸、丙氨酸)组成,其分子间的亲/疏性链段排列交替且规整,SF在选择性溶剂中能发生自组装而形成胶束[32]、聚集体[33]等不同结构的稳定形态,也可通过油相[34],电压[35],超临界CO2[36]、直接喷雾[37]等不同途径先获得SF液滴,再在外界刺激下(温度[38]、湿度[39]、离子强度[40]、变性剂[41])诱导SF的构象发生改变(从无规卷曲转变到β-折叠),进而形成稳定的水不溶的SF纳微米颗粒。根据SF的双亲性和自组装特性,可将SF纳微米颗粒的形成原理分为“从小到大”和“从大到小”两种。
2.1 “从小到大”
SF纳微米颗粒“从小到大”的形成原理是SF先由分子自组装形成纳米晶核,紧接着形成多晶核的聚集体颗粒。具体过程是全水相的SF溶液在变性剂[41]、pH值[42]、低温[32]等条件下先诱导SF形成纳米晶核,再在氢键、离子键、疏水作用力等作用下进一步自组装形成稳定的纳米颗粒,其中SF的二级结构会从不稳定的无规卷曲向稳定的β-折叠转变,该原理涉及的制备方法主要包括盐析法、反溶剂法等(图5)[21]。
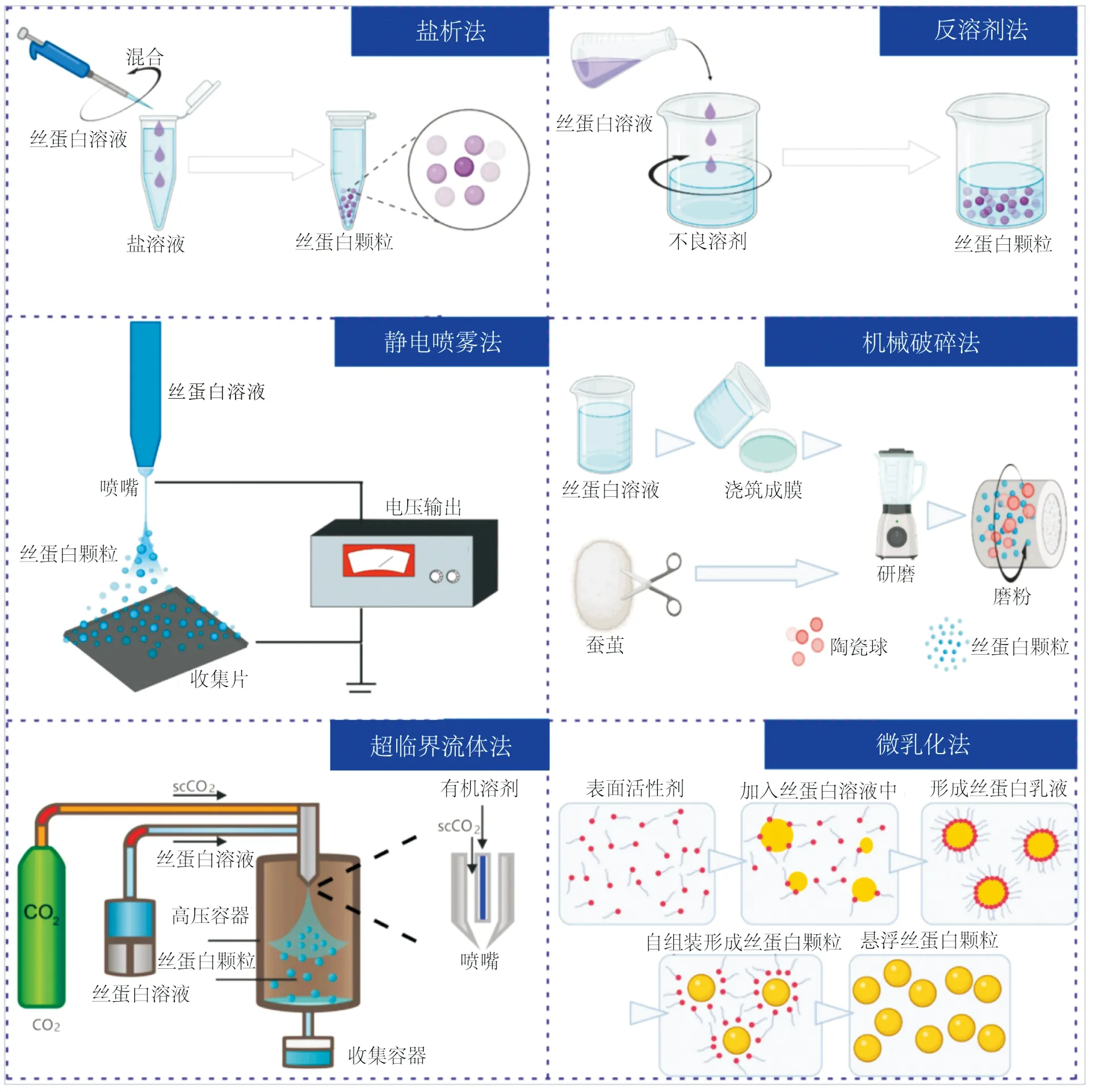
图5 制备丝蛋白纳米颗粒方法的示意Fig.5 Schematic summary of techniques for the preparation of silk nanoparticles
2.2 “从大到小”
“从大到小”的形成原理又细分为两种,一种是从SF溶液出发,SF溶液先均匀分散成纳微米小液滴,再去水固化。干燥过程包括瞬间高温固化[37]、60 ℃烘箱缓慢干燥[43]及在常温液中干燥等[41],此时二级结构以α-螺旋为主,需再经甲醇[41]、水蒸气[39]等后处理才能形成稳定的SF纳微米球(高β-折叠含量),也可通过添加化学交联剂(京尼平[44]、戊二醛[45])使液滴固化成球,制备方法主要包括静电喷雾干燥法、超临界流体法、微乳化法(图5)[21]。另外一种是从蚕丝纤维出发,将蚕丝纤维直接通过“搅拌球磨”[46]或“气流粉碎碾磨”[47]等方式获得粒径较大、β-折叠含量较高(>60%)的SF微米颗粒,但形貌规整性差,颗粒之间黏连严重,粒径分布范围较广。除了机械粉碎法外,“从小到大”和“从大到小”的形成原理有关键共同点,先选择合适的分散剂促使SF分子形成纳米晶核或者液滴,再通过外界刺激诱导SF分子构象进一步发生转变,形成水不溶的β-折叠,进而赋予SF纳微米球良好的稳定性和分散性。
2.3 制备方法优缺点比较
在SF纳微米球形成原理分类的基础上,详细比较了用于抗癌药物递送SF NPs的制备方法及各自的优缺点,如表1所示。静电喷雾干燥、机械破碎及微乳法得到的是较大粒径的SF微米颗粒(>1 μm),易被肺、肝脏、肾脏等器官代谢。而“从小到大”的盐析法、反溶剂法,在制备方法、工艺参数及SF NPs的理化性能,对疏水性抗癌药物的装载及释放等方面更具有优势,因此在抗癌药物装载和递送应用中研究较多[9,21]。
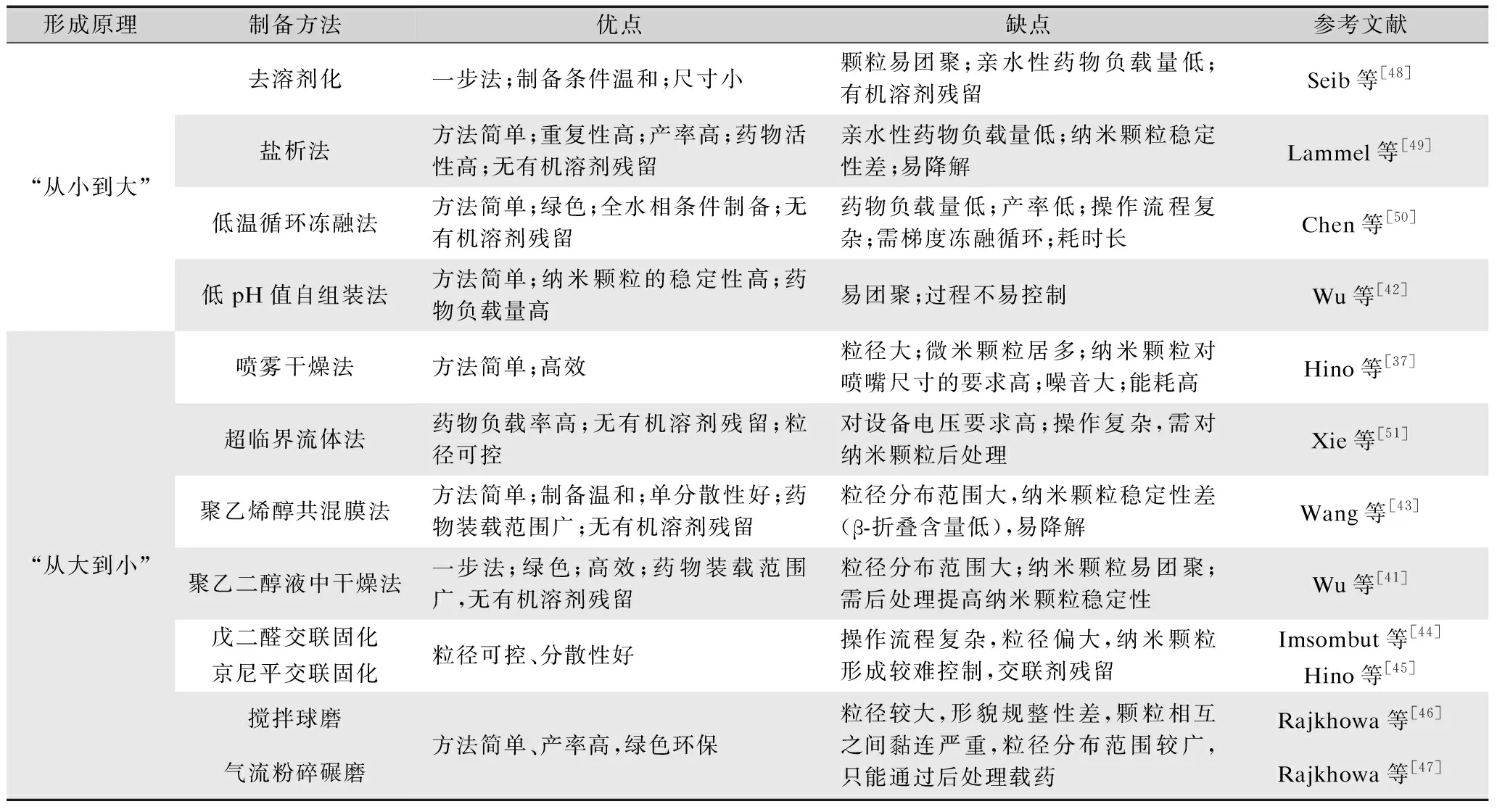
表1 不同方法制备丝蛋白纳米颗粒的原理分类及优缺点Tab.1 Mechanism classification and merits and demerits of silk nanoparticles prepared by different methods
3 SF NPs理化性能对抗癌药物疗效的影响
SF NPs的尺寸、电荷分布、β-折叠含量、分散性、稳定性及化学可修饰性等性能,对抗癌药物的选择、装载、释放及疗效均有至关重要的影响。
3.1 尺寸与电荷分布
在靶向纳米颗粒的药物递送体系中,肿瘤组织中纳米颗粒的含量及抗癌药物对癌细胞的疗效需重点考虑,而纳米颗粒的尺寸是靶向体系中的关键控制因素。另外,纳米颗粒的表面电荷对于细胞内化和抗癌药物的递送也具有重要作用。相比于带正电荷的纳米颗粒(非特异性吸附强,肾脏过滤快),带负电荷和中性电荷的纳米颗粒对延长血液循环耐受性及提升肿瘤吞噬和穿透能力更具有优势[52]。Seib等[48]利用去溶剂法制备了粒径为98 nm、电位为(-33.6±5.8) mV的SF NPs(PdI为0.109)。在此基础上,通过静电吸附将正电荷的阿霉素(Doxorubicin,Dox)装载到负电荷的SF NPs中(Silk fibroin-doxorubicin nanoparticles,SF-Dox NPs,装载量为40 ng/μg),装载效率超过95%,且可通过pH值调控Dox的体外释放速率(pH 4.5>6.0>7.4)。另外对MCF-7(人乳腺癌细胞)的体外研究表明,SF-Dox NPs相比于Dox的抗癌疗效更显著。Chen等[50]利用乙醇冻融法制备了粒径分布为270~520 nm、电位为-17.0~-26.8 mV的丝蛋白-紫杉醇纳米颗粒(Silk fibroin-paclitaxel nanoparticles,SF-Ptx NPs)。紫杉醇(Paclitaxel,Ptx)的包埋率和载药率最高分别达到100%和6.9%,封装率、载药率、体外释放速率受丝蛋白浓度、SF NPs的粒径、丝蛋白β-折叠含量及Ptx的含量影响。在此研究基础上,Wu等[53]制备了粒径更小的SF-Ptx NPs(约130 nm),通过细胞毒性研究发现,相比于SF NPS,Ptx的加载增强了其对BGC-823、SGC-7901(胃癌细胞)的毒性。此外,SF-Ptx NPs在裸鼠体内抑制胃癌肿瘤生长和减少肿瘤质量的疗效均优于Ptx。因此其基本规律是:在保证相同载药量的前提下,SF NPs的粒径小于100 nm更具有优势。Wu等[54]进一步地联合疏水性的Ptx和亲水性的Dox两种药物,通过乙醇析出法制备了双载药SF NPs,通过改变再生丝蛋白溶液和乙醇的浓度进而调控载药纳米球的粒径(100~600 nm),随后将其通过静脉注射应用于淋巴化疗,研究发现双载药SF NPs中Ptx和Dox的药物释放可持续超过7 d。此外,双载药SF NPs可通过内吞作用表现出高细胞摄取。重要的是,相比于相同浓度的单一药物SF NPs或游离药物,双载药SF NPs在当Ptx/Dox比为1︰1时,表现出更高效的抑制HeLa(宫颈癌细胞)、HepG-2(肝癌细胞)生长。因此制备粒径可控的双载药SF NPs可能对联合化疗具有重要的临床意义。Rahmani等[55]利用丙酮析出法优化了制备负载5-氟尿嘧啶(5-Fu)的SF NPs的最佳配方(质量比为1︰1),粒径和电位分别为220 nm和-32 mV时,包埋率和装载率达到最高,分别为52.3%和34.3%,且体外释放速率与5-Fu在SF NPs中的分布形式及相互作用(氢键、范德华力)有关。与游离药物相比,SF-5-Fu NPs对MCF-7和HT-29(人结肠癌细胞)的毒性明显增强。总而言之,SF NPs的尺寸及电荷分布直接决定其能否通过主被动靶向方式顺利进入癌细胞内,是影响抗癌药物疗效发挥的核心指标。
3.2 β-折叠含量
通过改变pH值调控SF分子中的电荷分布,也能改变SF NPs中的β-折叠含量,进而调控抗癌药物的装载量和体内药代释放动力学[49]。SF中的疏水结晶区和亲水无定形区可高效装载亲疏水性抗癌药物,并提高疏水性抗癌药物的水溶性,且SF NPs中无定形、Silk Ⅰ、Silk Ⅱ三者之间的比例可决定抗癌药物的体内释放速率。Coburn等[56]将Dox包埋在丝素蛋白膜中,并系统深入研究了不同结晶度丝蛋白膜对Dox体外释放动力学的影响,研究结果证实了相比于结晶度低的丝蛋白膜,结晶度高的(高β-折叠含量)更能缓释Dox,β-折叠含量高的丝蛋白膜更致密且扩散更慢,这也为后期制备装载其他小分子抗癌药物的SF NPs提供了研究思路。在此基础上,Wu等[57]利用丝素蛋白的β-折叠结构与姜黄素的疏水性苯酚基团相互作用,制备了负载姜黄素的SF NPs,显著提高了姜黄素的水溶性,使其口服生物利用度提高了17倍。
3.3 分散性及稳定性
SF NPs的分散性及稳定性对癌细胞的摄取有影响,其分散性和稳定性分别受电荷分布和肽段间氢键维系的β-折叠片层结构和二硫键等化学键的影响。Xiao等[58]优化了蚕丝的溶解体系,通过改变溴化锂与甲酸的混合比例对脱胶丝进行溶解(维持丝蛋白分子间的弱氢键相互作用),经透析纯化直接得到粒径分布为100~200 nm、以无规卷曲为主要构象的丝蛋白纳米颗粒(SNPs-F),分散性和稳定性比有机溶剂析出法(SNPs-A)进一步提升。Dox的装载效率受两者(丝蛋白与Dox)之间的比例调控(10%~100%),装载量比前人进一步提高,达到100 ng/μg。另外,弱酸性条件(pH 4.5)可加快Dox的体外释放(8 d累计释放速率大于45%)。随后,通过细胞摄取和毒性实验研究发现,SNPs-F比SNPs-A更易被MCF-7细胞吞噬内化,且对癌细胞表现出更高的细胞毒性,这可能与纳米颗粒的粒径和稳定性(SNPs-F不易聚集)有关。Li等[59]利用去溶剂法制备平均粒径为217 nm的含5-Fu和Cur双药的SF NPs,且5-Fu和Cur的装载率分别为45%和15%。与游离5-Fu和Cur相比,装载在SF NPs中的双药的生物利用度明显提高。另外,当应用双重载药制剂时,可以增加活性氧水平,进而在体外诱导4T 1(乳腺癌细胞)凋亡。动物研究表明,注射该SF NPs制剂后,肿瘤可明显减少。
3.4 化学可修饰性
SF NPs表面可修饰性是提高其靶向性的关键,经改性后的SF NPs具有很多优势,包括提高SF NPs的稳定性,延长抗癌药物的半衰期,提高抗癌药物的生物利用度等。Wongpinyochit等[60]将PEG共价接枝到SF NPs表面上,提高SF NPs分散性和稳定性的同时,表现出高效的药物负载能力(心得安封装效率达到了93%)和持久的释放能力(长达14 d),且对MCF-7细胞的抑制效果显著(更有利于细胞摄取且积聚到溶酶体中)。进一步地,Hudită等[61]将5-Fu负载在PEG修饰的SF NPs中,经静脉注射研究发现,该递送载体在降低5-Fu对正常血红细胞毒性的同时可提高对HT-29肿瘤细胞的杀伤能力,能够有效抑制肿瘤细胞迁移和侵袭潜力的影响。Yang等[62]制备了粒径为140nm,且负载吲哚菁绿(Indocyanine green,ICG)和阿霉素的SF NPs,ICG是一种临床认可的光敏剂。它是热疗治疗中的一种光热辅助剂,可使体内癌细胞的荧光可视化。此外,颗粒表面被MnO2矿化(SF@MnO2/ICG/Dox)。在近红外(NIR)照射下,与未使用NIR的阿霉素释放相比,表现出强烈而可控的光热反应和快速药物释放。随后利用SF@MnO2/ICG/Dox对4T1乳腺肿瘤小鼠进行照射后,与未照射的SF@MnO2/ICG/Dox颗粒或激光治疗的游离Dox或ICG相比,小鼠肿瘤大小明显减小,且生存期提高,表现出良好的抗肿瘤疗效。
4 在抗癌药物递送中的研究进展
4.1 被动靶向递送
被动靶向是指纳米颗粒可根据实体瘤组织与正常组织的微血管结构不同(肿瘤组织主要表现为血管充血、血管结构异常、淋巴管引流不足),引起自发滞留,或作为异物被免疫系统中的巨噬细胞吞噬等途径进入肿瘤细胞中的一种不自主行为。受到该作用机制启发,充分利用肿瘤微环境促使SF NPs透过内皮富集作用,渗透至肿瘤组织内部,为抗癌药物长时间释放争取更多时间,提高抗癌疗效。Gupta等[63]通过毛细管微点法分别制备了粒径小于100 nm的负载姜黄素(Curcumin,Cur)的SF和SF壳聚糖共混物的纳米颗粒(SF-Cur NPs和SF/CS-Cur NPs)。相比于SF/CS-Cur NPs,SF-Cur NPs的装载效率(>90%)和释放量均最高(0.32~0.68 μg),且使MCF-7和MDA-MB-453的细胞活力明显降低。该研究结果表明,SF-Cur NPs对乳腺癌细胞显示出更高的疗效并可作为体内乳腺肿瘤长效治疗的递送载体。Montalbán等[64]采用物理吸附法和共沉淀法分别制备了平均粒径为166 nm和171 nm的SF-Cur NPs。对Hep3B(人肝癌细胞)和Kelly均具有细胞毒性,同时不会降低hBMSCs(人骨髓间充质干细胞)的活力。另外,SF-Cur NPs在对Kelly的细胞毒性方面表现出比Hep3B更高的疗效。Xie等[65]利用超临界CO2溶液增强分散(SEDS)制备了粒径可控的SF-Cur NPs(<100 nm)。与游离的5-Fu相比,质量浓度高于10 μg/mL的SF-Cur NPs对 HCT-116(结肠癌细胞)显示出更强的抗癌作用(>94%),抗癌机制可能与诱导凋亡细胞相关的G0/G1和G1/M期的细胞周期停滞有关。另外,在相同质量浓度下,与5-Fu相比,SF-Cur NPs对NCM-460(正常结肠细胞)的毒副作用降低。上述研究均证实了SF NPs在抗癌药物的递送过程中具有增强其被动靶向的能力。进一步地,为了延长SF NPs在血液中的循环时间,避免SF NPs与血浆蛋白发生非特异性吸附,Wongpinyochit等[60]通过丙酮析出法制备了SF NPs,并利用聚乙二醇(PEG)对其表面进行修饰,尽可能使更多纳米颗粒经被动靶向进入肿瘤组织。研究结果证实,相比于SF NPs,经PEG修饰的SF NPs的电位发生明显升高(从-56 mV增加到-47 mV),一方面提高了其在水中的分散性和稳定性(28 d),另外一方面在酸性条件下(pH 4.5),提高了Dox的释放量(14 d内提高2倍)。经PEG修饰的SF NPs能被MCF-7高效吞噬,表现出更强的抗癌活性。因此对纳米颗粒表面改性增强其被动靶向能力,延长其血液循环时间并持续发挥抗癌药物疗效是开发纳米药物载体的有效策略。另外,将对光、热、磁场、电场、超声波等具有刺激响应的物质装载在SF NPs中,提高其被动靶向的能力和含量,从而实现抗癌药物的精准递送和高效治疗,是目前纳米肿瘤新制剂的研究热点[66]。如将磁性的氧化铁或四氧化三铁和抗癌药物装载在SF NPs形成稳定的药物剂型,静脉注射后在外磁场的作用下使纳米颗粒顺利通过血液循环到达并富集在肿瘤组织部位,然后改变药物的释放外环境,包括调控酶的活性,改变pH、渗透压及温度等生理条件,使抗癌药物在肿瘤组织中缓慢释放[67]。Song等[68]利用盐析法制备了具有磁性的SF-Cur NPs,对MDA-MB-231进行研究发现,具有磁性的小粒径的SF-Cur NPs(90 nm)中Cur的细胞摄取明显高于大粒径的SF-Cur NPs(350 nm)和游离姜黄素(高达80%),且明显降低了MDA-MB-231的活性。因此,具有磁性的SF-Cur NPs提供了外部进行癌症靶向的可能性。
4.2 主动靶向递送
被动靶向递送最大的挑战是SF NPs无法实现在癌变组织中的高浓度富集,且无法到达组织深处,药物疗效难以充分发挥。近十年中的被动靶向递送研究数据表明,仅有0.7%的纳米抗癌药物制剂有效也充分佐证了这点[69]。将特异性配体或抗体通过化学修饰到SF NPs的表面使之对肿瘤组织具有更好的主动靶向性是SF纳米抗癌制剂当前研究的重点方向。目前在SF NPs中应用较多的靶向分子配体包括叶酸,RGD多肽,乳铁蛋白、透明质酸等。为了对癌细胞提供特异性识别,可提高SF NPs的主动靶向性。Subia等[70]通过丙酮析出法先制备了SF NPs,再将叶酸(Folic acid,FA)通过共价接枝到SF NPs表面,然后将Dox物理吸附得到粒径小于200 nm的FA-SF NPs-Dox,在酸性条件下持久释放长达21 d。与非功能化的SF NPs-Dox相比,经FA修饰的SF NPs-Dox的主动靶向能力增强,能被MDA-MB-231细胞高效内化吸收,且释放的Dox显著降低了癌细胞活力。考虑到Dox的药物剂量低,难以持续发挥抗癌疗效,进一步地,Sun等[71]首先通过盐析法制备了负载Dox的SF NPs(SF NPs-Dox),再将FA通过共价接枝到(FA-SF NPs-Dox)的表面,作为肿瘤细胞叶酸受体的靶标。此外,相比于FA-SF NPs-Dox((19.63±0.27) μg/mg),二次物理装载Dox的纳米颗粒(FA-SF NPs-Dox-Dox)的载药能力提升到(30.71±0.41) μg/mg,且依然具有球形多孔结构(粒径约为530 nm,孔径为17.84 nm)。体外释放结果表明,低pH值、高离子强度及高酶浓度均可加快Dox从FA-SF NPs-Dox-Dox中释放(30 h)。此外,与SF NPs-Dox-Dox相比,FA-SF NPs-Dox-Dox可加快被HeLa内化,且对HeLa具有更高的细胞毒性。iRGD是一种环状的肿瘤归巢肽,可增加肿瘤组织微环境中的血管和组织通透性。Bian等[72]通过反溶剂法诱导SF自组装制得负载Ptx的纳米颗粒(Ptx-SF-NPs),随后用碳二亚胺将纳米颗粒与抗表皮生长因子(Epidermal growth factor receptor,EGFR)-iRGD纳米体进行耦联结合(A-Ptx-SF-NPs)。经功能化的A-Ptx-SF-NPs平均尺寸约为186 nm。药物包封率和载药率分别为52%和10%。动物体内影像学结果表明,与非耦联的Ptx-SF-NPs相比,A-Ptx-SF-NPs能显著抑制HeLa癌细胞中EGFR的高表达。Roy等[73]通过斩切、碾磨和喷雾干燥等步骤制得载乳铁蛋白的SF NPs。与纯SF NPs相比,载乳铁蛋白的SF NPs在MDA-MB-231和MCF-7细胞内的内化率显著升高。Gou等[74]将具有线粒体靶向功能的IGC类似物(NIR770)和阿霉素通过盐析法装载在SF NPs中,并利用透明质酸(HA)对其表面进行功能化修饰。通过细胞吞噬实验发现,与表面未经HA修饰的SF NPs-Dox相比,肿瘤细胞对HA表面修饰Dox纳米颗粒(HDNPs)具有更高的吞噬效率。而当在培养基中加入游离HA分子后,细胞对HDNPs的吞噬效率显著下降。综合表明,SF NPs表面具有丰富的反应位点,可为靶向分子共价耦联或化学修饰创造有利条件,便于纳米抗癌制剂的主动靶向递送和高效治疗。
5 结 论
丝蛋白具有生物相容性优异、生物安全性高、免疫原性低、可塑性强等优势,是制备纳米药物递送载体的理想材料来源。肿瘤组织比较复杂,仅将SF NPs作为抗癌药物的被动靶向递送载体,疗效甚微。而SF NPs的制备方法简单,其尺寸、电荷、β-折叠含量、分散性、稳定性可控,尤其是其表面具有丰富的活性位点,可为特异性配体或抗体、抗癌药物等通过共价耦联或化学修饰创造有利条件,使之对肿瘤组织具有更好的主动靶向性和抗癌疗效。因此,经功能化修饰的SF NPs在延长血液循环耐受性、肿瘤细胞吞噬、向肿瘤组织深层次穿透及对抗癌药物的精准递送和提高疗效等方面,都展现出良好的应用前景。
尽管SF NPs具有诸多优势,但其在纳米抗癌药物递送体系的靶向治疗研究处于起步阶段,仍面临着制备方法受到外源因素制约,且100 nm以下尺寸较难控制,结构不够稳定,难以在靶向组织中富集,药物有效治疗浓度持续时间短,疗效差等问题。因此科研工作者需在开发功能化、智能化SF NPs的制备技术、提升其理化性能(粒径可控、稳定性优异、载药量高效、靶向性准确)及抗癌疗效(精准、长效、可控)等方面进行大量探索与研究。

《丝绸》官网下载

中国知网下载
