两性离子表面温敏膜的制备及在多糖分离中的应用
2023-02-21陈锋冯思敏邵平
陈锋,冯思敏,2*,邵平,2*
1(浙江工业大学 食品科学与工程学院,浙江 杭州,310000) 2(中国轻工业食品大分子资源加工技术研究重点实验室(浙江工业大学),浙江 杭州,310000)
黄精是一种药食两用的传统中药,多糖是其主要的活性成分之一,拥有多种生理功效,备受人们青睐[1]。传统的多糖提取方法包括酶解提取法、超高压提取法、亚临界流体提取法等,然而这些方法往往存在成本昂贵、耗能高、引入杂质等问题[2]。膜分离法是典型的非热分离技术,具有能耗低、操作简便、环境友好的独特优势,被广泛应用于食品加工、医疗保健、水净化和废水处理等领域[3]。聚合物基超滤膜具有机械强度高、稳定性好、渗透性和选择性优异,同时价格低廉等特点[4],近年来越来越多地被应用到多糖的分离纯化中。
然而聚合物基的分离膜具有固有的疏水性,污染物易于在膜表面及孔道内部形成结垢,导致通量下降,大大增加了能耗和运行成本[5]。目前,通过共混或接枝功能性聚合物以提高超滤膜的亲水性是增强抗污染性能的常用策略[6]。拥有亲水基团的聚合物能够在氢键作用下吸引水分子聚集,于膜表面构建水合层,进而阻碍污染物在膜表面聚集,降低膜结垢形成的可能,但亲水性高分子的直接引入容易造成膜基体溶胀度增大,结构稳定性降低[7]。因而寻找一种间接构建亲水孔道表面的方法为增强膜分离效率提供了思路。
近年来,刺激响应型聚合物逐渐被应用于膜的结构和性能的优化,响应膜的形态和特性能够根据外部环境的刺激实现响应性变化,由此形成的膜的可变表面结构有助于去除黏附在膜表面的污染物,实现膜的自清洁性能[8]。通过简单的物理共混及酸诱导表面偏析效应,将刺激响应性微凝胶自组装于膜的表面和孔道内,其能随环境条件变化而改变缩放状态,从而促使吸附的污染物松动甚至脱落,实现通量恢复[8]。然而,此类微凝胶普遍含有带正电荷的功能基团,微凝胶纳米粒子自身对污染物阻碍能力较弱[9]。因此,设计了一种兼具两性离子和温敏性的双重特性的纳米微凝胶,并将其用于新型超滤膜的制备中,以期减轻膜污染程度,提升多糖溶液的通量,获得更优秀的分离效率。
本研究以聚(N-异丙基丙烯酰胺)[poly(N-isopropyl acrylamide), PNIPAM]温敏微凝胶为主体核,通过自由基聚合在微凝胶球体表面生成聚(N,N-二甲基氨基-2-乙基甲基-丙烯酸酯)[poly(N,N-dimethylaminoethyl methacrylate), PDMAEMA]壳层,制得具有核壳结构的微凝胶。接着通过非溶剂诱导相分离法,在相转化过程中将微凝胶原位表面偏析,使其均匀地装饰在膜表面和孔道上。最后以1,3-丙烷磺酸内酯(1, 3-propane sulfonide,1,3-PS)作为季铵化试剂,将裸露在外的纳米凝胶外层转化为聚两性离子,用以提高其在黄精多糖中的分离效率。
1 材料与方法
1.1 材料
N-异丙基丙烯酰胺(N-isopropyl acrylamide, NIPAM)纯度98%,含稳定剂对羟基苯甲醚(hydroquinone monomethyl ether,MEHQ),N,N-亚甲基双丙烯酰胺(methylene-bis-acrylamide, MBA)[分子生物学级,≥99.0%(T)]、十二烷基磺酸钠(SDS,AR,98.0%)、过硫酸铵(ammonium persulfate, APS)(AR,≥98%)、甲基丙烯酸二甲氨乙酯 (99%,含1×10-3MEHQ稳定剂,DMAEMA)、1,3-丙磺酸内酯(99%)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF,分子生物学级,≥99.9%)以及牛血清白蛋白(bovine serum albumin,BSA,98%),aladdin化学试剂有限公司;聚乙二醇(polyethylene glycol,PEG,平均分子质量为2 000),Sinoharm化学试剂有限公司;聚醚砜(polyether sulfone,PES,PESU3000P,Solvay),硕丰工程塑料有限公司;黄精粉末,阿里健康大药房,黄精多糖通过水提醇沉法自行制备。其他化学药品均为分析纯试剂,所有溶液均使用超纯水制备。
1.2 仪器与设备
Nano nova 450扫描电子显微镜、Bechman Allegra高速冷冻台式离心机,日本Hitachi公司;Nicolet 6700傅里叶红外光谱分析仪,美国Thermo Nicolet公司;CMT6023电子拉伸试验机,深圳市世纪天源仪器有限公司;Millipore-8010微型膜片测试仪,浙江赛蓝膜科技研发有限公司;DK-S24型电热恒温水浴锅,上海森信实验仪器有限公司。
1.3 核/壳微凝胶颗粒的制备
PNIPAM核/PDMAEMA壳微凝胶是采用自由基乳液聚合工艺制备的[10]。在250 mL三颈烧瓶中,首先将0.106 9 g的MBA和0.040 0 g的SDS溶解在200 mL预脱氧的纯水中,在N2保护下加热至40 ℃,稳定后继续通N215 min后停止搅拌。从三颈烧瓶中吸取10 mL反应溶液与1.584 3 g的NIPAM混合后,再将其加入三颈烧瓶中,并加热至75 ℃。开启搅拌,在500 r/min的搅拌下加入0.114 1 g的APS。聚合4 h后得到的PNIPAM微凝胶以球状颗粒的形态分散在溶液中。缓慢加入含 DMAEMA、MBA和SDS的混合水溶液,控制加入时间10 min,然后再次加入APS,其比例如上一步操作,继续进行聚合反应3 h,此时PDMAEMA会优先在PNIPAM微凝胶颗粒表面生长,最终形成核壳结构的复合微凝胶。
将获得的溶液冷却至室温并用离心管分装,然后以10 800 r/min的速度离心30 min,去除上清液,并再次加入高纯水,通过3次离心/再分散循环纯化微凝胶。在-80 ℃下冷冻干燥48 h,便可获得PNIPAM核/PDMAEMA壳微凝胶。
1.4 超滤膜的制备
通过非溶剂诱导相分离(non-solvent induced phase separation, NIPS)的方法制备温敏性超滤膜。首先将0.6 g微凝胶分散在32.8 mL的DMF中,500 r/min搅拌30 min后,往溶液中加入6 g PES,转移至75 ℃油浴锅中搅拌4 h,然后拨高搅拌桨使其脱离液面,随后室温放置3 h以完全脱除铸膜液内的气泡。
用厚度为200 μm的钢刮刀将均匀的铸膜液流延到玻璃板上。平稳地将湿膜与玻璃板一起浸入纯水凝固浴中15 min,然后转移至新鲜的去离子水中以除去过量的溶剂,从而制得温敏膜(polyethersulfone-co-gel,PCG),用超纯水储存。
将PCG膜浸入30 mL含5 g 1,3-PS的乙醇溶液中,60 ℃的水浴中反应1 h,制得拥有两性离子表层的温敏膜(sulfonated polyethersulfone-co-gel,SPG)。然后通过用乙醇和去离子水反复充分漂洗除去膜上残留的物质,最后将所得膜干燥至恒重。
1.5 改性膜的物理结构表征
使用扫描电子显微镜在15.00 kV的加速电压下观察微凝胶的表面形貌和改性膜的表面形貌与截面形貌。使用傅里叶红外光谱分析仪对样品的官能团进行测量。在室温下,使用拉伸速率为10 mm/min的电子拉伸试验机。
1.6 改性膜的纯水通量、刺激响应性能与热稳定性
使用微型膜片测试仪,以错流过滤的方式测定膜的多糖溶液通量。分别选取PES膜,PCG膜,以及SPG膜各1组,每个膜在测试前于0.2 MPa下纯水预压约1 h,通量基本稳定后将进料液替换为质量分数5%黄精多糖溶液,继续测定通量,持续80 min。
测定不同温度下分离膜对多糖溶液的分离效率,配制5%黄精多糖溶液为进料液,测定方法同上。
2 结果和讨论
2.1 两性离子表层温敏膜的制备
为了制备双重抗污染超滤膜,设计了携带双性离子的核壳结构的温敏性微凝胶,并将其偏析在膜表面和孔道内部。先通过乳液聚合得到NIPAM微凝胶,再通过表面二次自由基聚合[11],再外层包覆聚(甲基丙烯酸二甲氨乙酯),形成核壳结构的微凝胶。随后,将制备的核壳结构微凝胶共混到铸膜液中,通过非溶剂诱导相分离法制备超滤膜[12]。
NIPAM是典型的温敏性微凝胶,呈现典型的稳定球状颗粒(图1-a),且较为均匀地分布在溶液中。它的特点是能在临界转变温度(lowe critical solution temperature,LCST)左右发生形态变化,当温度高于LCST时,聚甲基丙烯酰胺分子内氢键作用力较强,分子链呈现稳定的收缩状态,粒径较小;而温度低于LCST时,水分子与酰胺官能团之间的氢键作用力增强,聚合物链因为水分子的结合呈现扩展无规卷曲状态,粒径增大[13]。
经过二次自由基聚合反应,由于稳定的球形微凝胶颗粒地存在,聚(甲基丙烯酸二甲氨乙酯)自发地在核心球体表面生长,最终将其完全包被,形成核壳结构的复合微凝胶。PNIPAM核/PDMAEMA壳微凝胶具有较为规整的球形结构(图1-b),但粒径明显增大,核心球体表面有明显不同的粗糙外壳。

a-PNIPAM微凝胶;b-核壳结构微凝胶;c-纯PES膜截面;d-SPG膜截面图1 核心微凝胶、核壳结构微凝胶、PES膜截面、SPG膜截面的微观结构Fig.1 Microstructure of core microgel, core-shell microgel, PES film cross section and SPG film cross section
微凝胶具有亲水性嵌段,在非溶剂诱导的相分离过程中,微凝胶通过表面偏析会分布在膜表面和通道内表面上[14]。由于聚(甲基丙烯酸二甲氨乙酯)具有叔胺基团,能够与丙磺酸内酯进行开环季铵化反应,使得叔胺基团转化为带正电荷的季铵基团,同时又引入了带负电的磺酸基团,从而构建两性离子表层[15]。
2.2 膜的结构表征
为了探索微凝胶的加入对膜微观结构的影响,采用扫描电镜对其表面和断面进行了表征。图1-c、图1-d揭示了各种膜的横截面形态。原始膜的横截面显示出具有代表性的不对称结构,呈现典型的指状孔结构,孔道内壁光滑而平整。随着微凝胶纳米颗粒的加入,膜的横截面从指状孔结构转变为多孔隙的指状孔结构,可以明显地看到,膜孔道内部分布着大量的球形微凝胶颗粒。
两性离子改性的微凝胶的引入不仅会改变膜表面的微结构,也会对分离膜的机械性能造成影响,从表1可以看出,添加温敏性微凝胶后的改性膜所能承受的最大应力与原始膜较为接近,两者的断裂拉伸率亦在二者的误差范围内,可见在铸膜液中共混微凝胶没有对分离膜的机械性能造成明显影响,这是因为微凝胶在膜孔道表面制造空隙的同时,自身也镶嵌在膜内,使得分离膜的机械强度未能发生显著变化。

表1 改性膜的机械强度Table 1 Mechanical strength of modified membranes

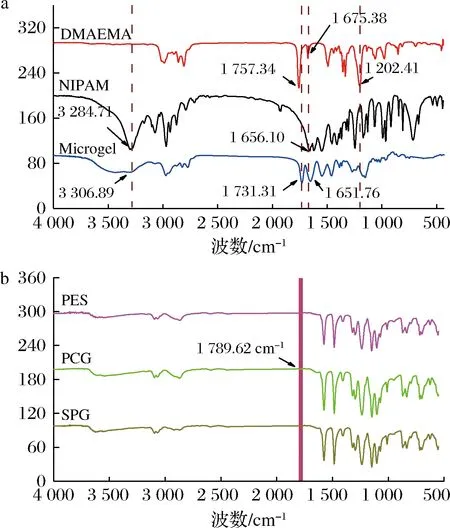
图2 NIPAM单体、DMEAMA单体、核壳结构微凝胶(a)、PES膜、PCG膜、SPG膜的红外图像(b)Fig.2 FTIR of NIPAM, DMAEMA, core-shell microgel (a) and PES, PCG, SPG (b)
2.3 改性膜的渗透性、刺激响应特性和稳定性
从图3-a中可以看出,添加了核壳结构微凝胶的PCG膜与拥有两性离子表层的SPG膜的纯水通量得到了有效改善。在30 ℃条件下,与纯PES膜相比,PCG的纯水通量从(156.49±13.06)L/(m2·h)增加到(179.08±5.34)L/(m2·h),由于季铵化后构建了两性离子,SPG膜的亲水性进一步增强,水通量增加到(228.44±5.22)L/(m2·h)。
核壳结构的微凝胶拥有裸露的酰胺基团,能够与水分子形成一定的氢键作用力,因而能够在纯水凝固浴的诱导下偏析到膜表面[16],进而在一定程度上提高了膜的亲水性,形成了通量增加的现象。而通过在1,3-丙磺酸内酯溶液中进行季铵化反应后,微凝胶表层裸露的叔胺基团转变为两性离子基团,起到吸引水分子形成水合层的效果,进一步提高了膜的亲水性[17]。
如图3-c与图3-d所示,在10~50 ℃,改性膜的纯水通量随着温度的上升而不断增大,表现出明显的梯度变化,PCG膜的纯水通量由(26.11±12.53)L/(m2·h)逐渐提升到(362.14±49.53)L/(m2·h);SPG膜的纯水通量由(141.08±35.46)L/(m2·h)增加到(450.48±31.24)L/(m2·h),与此同时,图3-b中纯PES膜在不同温度下的水通量较为接近,且在20 ℃及以下时表现出比改性膜更加优异的纯水通量。如之前所提到的,通过NIPS制备分离膜时,微凝胶随着热力学运动偏析到孔道表面,导致孔道内径变窄,通量有所降低[18]。
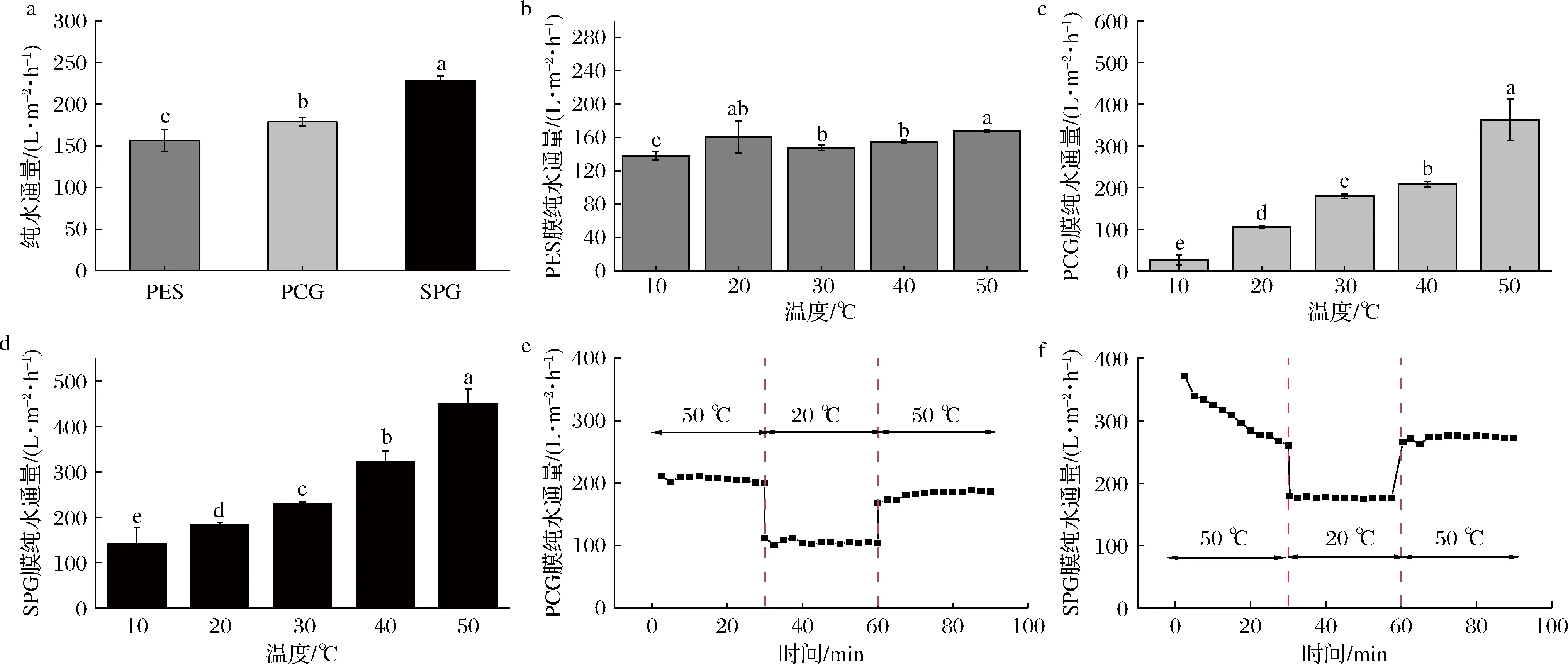
a-3种膜30 ℃下纯水通量;b-PES膜不同温度下纯水通量;c-PCG膜不同温度下纯水通量;d-SPG膜不同温度下纯水通量;e-PCG膜的热可逆测试;f-SPG膜的热可逆测试图3 PES、PCG、SPG膜渗透性、温敏性测试和PCG、SPG膜的热可逆性测试Fig.3 Permeability and temperature sensitivity test of PES, PCG, SPG membrane and the thermo reversible test of PCG, SPG注:图中不同小写字母代表差异显著(P<0.05)
镶嵌在孔道表面的温敏性微凝胶在超过临界转变温度时,酰胺基团与水分子之间的氢键作用力减弱,倾向于在分子内部形成氢键,使得分子链之间接触更紧密,微凝胶体积缩小,此时反而造成了膜孔道内径增大,水通量增大。相似的,当温度低于进阶温度时,膜孔道内径因为微凝胶体积增大而减小,水通量也随之降低[19]。同理,经过季铵化反应构建两性离子表层后的改性膜SPG也有相似的温敏特性,并且两性离子表层大大增强了膜的亲水性[20],使得其水通量较前两者更好。
根据图3-e与图3-f可以看出,当温度从50 ℃降低到20 ℃时,PCG的膜通量从(206.47±3.95)下降至(105.03±3.05)L/(m2·h),重新升温至50 ℃,水通量恢复到(183.17±5.11)L/(m2·h)。在一组温度循环内,微凝胶的体积随着温度下降而增大,孔道内径随之减小,纯水通量大幅下降;当温度回复到初始温度时,微凝胶的体积减小,释放出孔道的空间,通量得到恢复。与之相似,经过季铵化处理的温敏膜在一组温度循环内的膜通量也呈现出较好的可逆变化趋势,这说明温度的循环变化并没有使微凝胶出现大规模脱落。这是因为温度上升引起微凝胶收缩的同时,膜基质也因为吸收热能而膨胀,偏析在表面的微凝胶得以稳定地着床[12]。
2.4 PES改性膜分离多糖溶液的通量
如图4-a所示,在不同温度下,将纯PES膜用于多糖溶液分离,膜通量受到污染影响而不断下降,然而20、30、40、50 ℃条件下多糖溶液通量的误差始终低于5%,当分离时间90 min时,不同温度条件下的膜通量为(23.29±0.547 4)L/(m2·h)。相比之下,图4-b中添加了温敏性微凝胶的PCG膜表现出明显的温度响应活性,在30、40、50 ℃之间膜通量差值接近5 L/(m2·h),随着微凝胶形体对温度的响应,膜孔道内径发生对应的变化,提高了多糖溶液的通量,对比图4-a与图4-b,可以观察到50 ℃下温敏改性膜通量更优,多糖通量达到24.74 L/(m2·h),而其他温度下PCG膜通量反而稍差,这一定程度上也是由于微凝胶的添加使得孔道内径相对减小所致。与之相比,图4-c所示的是拥有两性离子表层的SPG膜不仅有着同样的温度响应能力,在40 ℃时拥有比PCG膜更高的多糖通量,这是由于两性离子表层的形成大大提高了膜孔道表面的亲水性[21],促进了水分子的流通,从而充分提高膜的通量,从而提高了分离效率。大多数多糖都具有难溶于冷水的特点,这是由于多糖分子长链上具有丰富的羟基基团,容易形成分子内氢键[22],在温度升高到50 ℃时,大分子多糖内部的氢键受到破坏使得羟基等亲水基团暴露出来,亲水性增强,溶解度提高,多糖更容易吸附到SPG膜孔道表面,导致膜通量出现明显下降。

a、b、c分别为PES膜、PCG膜、SPG膜在不同温度下多糖通量;d-PCG、SPG膜的变温过滤测试图4 不同温度下PES、PCG、SPG膜的多糖通量以及PCG、SPG膜的热可逆变化Fig.4 Polysaccharide flux of PES, PCG, SPG at different temperature and the thermoreversible change of polysaccharide solution with PCG and SPG
同时还测定了2种改性膜在处理多糖溶液时的热可逆稳定性,如图4-d所示,将多糖溶液温度从40 ℃降低到20 ℃ 30 min后,再恢复到40 ℃时,PCG膜与SPG膜的膜通量均出现明显的恢复,其中SPG膜的通量恢复更为明显,约为初始通量的106.38%。PCG膜与SPG膜中均引入了具有温度响应能力的复合微凝胶,通过非热诱导相分离法,复合微凝胶偏析到膜表面与孔道表面,在温度变化时,温敏性微凝胶的粒径先增大后减小,在这一过程中引起了孔道表面形态的剧烈变化[12],原本附着的污染物脱落,通量得到明显恢复,SPG膜拥有两性离子表层,相较PCG膜拥有更高的膜通量,受到温敏过程影响的污染物更易随着冲刷而脱落,相对PCG膜通量恢复率更高。
2.5 PES改性膜的抗污染性能
为评估改性PES膜经过1次水洗后的防污性能,进行纯水和多糖溶液的变温循环过滤测试。如图5所示,纯PES膜的初始多糖溶液通量远低于共混核壳结构微凝胶的改性膜,如前文所述核壳结构的微凝胶表面拥有部分酰胺基团等亲水性官能团,较纯PES膜的表面亲水性更强[23]。经过60 min水洗后再次测定多糖通量,纯PES膜的多糖通量几乎没有得到恢复,而引入微凝胶的改性膜经过水洗后通量恢复到初始通量的85.73%,这是因为原始膜具有固有疏水性,吸附在膜表面及孔道表面的疏水性污染物难以随着水洗脱落[24],通量恢复不明显;相比之下,改性两性离子膜的亲水性提升,在引起一部分亲水性物质吸附的同时,水洗过程中这些污染物更容易随着水流分离,使得通量得到明显恢复,而之后的多糖通量测试也表现出与前90 min较为接近的下降趋势。
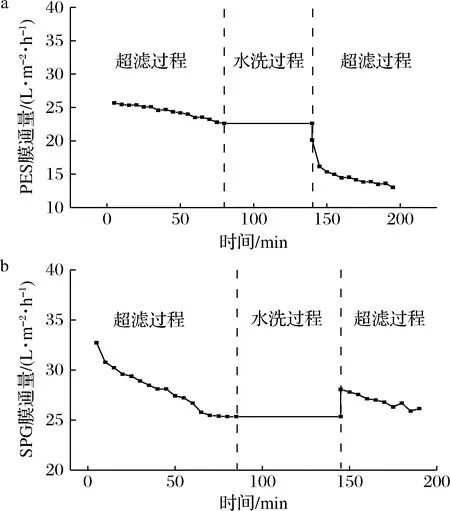
a-PES膜;b-SPG膜图5 PES膜与SPG膜过滤-水洗-过滤循环通量测试Fig.5 Filtration-washing-filtration cycle test of PES and SPG membrane
3 结论
该研究提出了一种制备兼具提高亲水性与温度响应性的超滤膜,与原始膜相比,30 ℃下纯水通量提高了45.98%,多糖溶液通量提升10.80%。特别是改性膜SPG拥有温度响应能力,溶液温度从20 ℃提升至40 ℃时,多糖通量逐渐增大。两性离子表层不仅能提高聚合膜的亲水性,还能吸引水分子形成水合层以阻挡污染物吸附,在水洗环节后,带有两性离子表层的SPG改性膜通量恢复到初始通量的85.73%,有效提高了黄精多糖的分离效率,对多糖的膜分离提供了理论基础,该膜分离技术在其他多糖分离中的应用有待进一步研究。
