稀硝酸中低含量亚硝酸的测定方法探讨
2023-02-21杜爱平
杜爱平
(天脊煤化工集团股份有限公司,山西 长治 047500)
引言
硝酸是一种重要的化工原料,主要用于化肥、染料、炸药、医药等工业,天脊集团年产108 万t 硝酸采用双加压法生产,主要用于制造硝酸铵、硝酸铵钙、硝酸磷肥、氮磷钾复合肥、苯胺,产品硝酸中亚硝酸含量设计值为100 mg/kg,日常对亚硝酸的检测可以反映出硝酸的漂白效果和氮氧化物的利用率,为工艺过程二次空气的调节提供参考依据。
本文通过3 种方法的操作性、安全性和准确性等的比较和探讨,对不同方法的适用性和注意事项进行了总结。
1 试剂与材料
硫酸溶液,1+8;硫酸亚铁铵溶液,40 g/L;高锰酸钾标准滴定溶液,c(1/5KMnO4)≈0.1 mol/L;高锰酸钾标准滴定溶液,c(1/5KMnO4)≈0.01 mol/L;对氨基苯磺酸溶液,4 g/L;盐酸萘乙二胺盐溶液,2 g/L;亚硝酸根标准溶液,1 000 μg/mL,坛墨质检;亚硝酸根标准使用液,10 μg/mL,临用前由1.7 配制而成;盐酸溶液,1+9。所用试剂未注明均为分析纯,实验用水均为去离子水。
2 实验方法
2.1 高锰酸钾滴定法
2.1.1 原理
在强酸性条件下,用高锰酸钾标准滴定溶液氧化样品中的亚硝酸化合物,再加入过量的硫酸亚铁铵溶液还原高锰酸钾,然后用高锰酸钾标准滴定溶液滴定过量的硫酸亚铁铵溶液。
2.1.2 分析步骤
于500 mL 锥形瓶中,加人100 mL 低于25 ℃的水,20 mL 低于25 ℃的硫酸溶液,再用滴定管加入一定体积(V0)的高锰酸钾标准滴定溶液,该体积(V0)比测定试样消耗高锰酸钾标准滴定溶液的体积过量10 mL。
移取约5 mL~10 mL 试样,迅速加入碘量瓶,立即塞紧瓶塞,摇动至酸雾完全消失为止(约5 min),用水冷却至室温,用移液管加入20 mL 硫酸亚铁铵溶液,以高锰酸钾标准滴定溶液滴定,直至呈现粉红色于30 s 内不消失为止,记录滴定的高锰酸钾标准滴定溶液的体积(V1)。
为了确定在测定条件下,两种溶液的相当值,用移液管加入20 mL 硫酸亚铁铵溶液,以高锰酸钾标准滴定溶液滴定,直至溶液呈现粉红色于30 s 内不消失为止,记录滴定的高锰酸钾标准滴定溶液的体积(V2)。
2.1.3 结果计算
亚硝酸的质量分数按式(1)计算:

式中:c 为高锰酸钾标准滴定溶液的浓度,mol/L;V0为开始加入高锰酸钾标准滴定溶液的体积,mL;V1为第一次滴定消耗高锰酸钾标准滴定溶液的体积,mL;V2为第二次滴定消耗高锰酸钾标准滴定溶液的体积,mL;V 为移取试料的体积,mL;ρ 为试料的密度,g/mL;23.5 为亚硝酸的摩尔质量,g/mol。
取平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于0.01%。
2.2 滴定高锰酸钾法
2.2.1 原理
在强酸性条件下,用硝酸试样滴定高锰酸钾标准滴定溶液,硝酸样试中的亚硝酸化合物还原高锰酸钾,使高锰酸钾溶液褪色,通过消耗硝酸试样的体积计算其中的亚硝酸含量。
2.2.2 分析步骤
于200 mL 烧杯中加入50 mL 水,8 mL 硫酸,加热至50 ℃左右,准确加入一定量的高锰酸钾标准滴定溶液,用硝酸试样滴定高锰酸钾溶液至粉红色消失,记录消耗硝酸样品的体积。
2.2.3 结果计算[见式(2)]
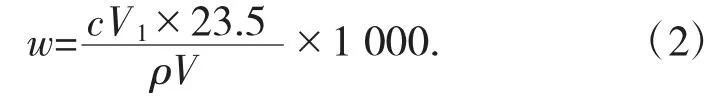
式中:w 为亚硝酸的质量分数,%;V1为入高锰酸钾标准滴定溶液的实际体积,mL;V 为滴定中消耗试样硝酸的体积,mL;c 为高锰酸钾标准滴定溶液的浓度,mol/L;ρ 为硝酸试样的密度,g/mL;23.5 为亚硝酸的摩尔质量,g/mol。
2.3 分光光度法
2.3.1 原理
在酸性溶液中,亚硝酸根与对氨基苯磺酸起重氮化反应,再与盐酸萘乙二胺偶合生成玫红色偶氮化合物,根据吸光值进行比色分析。
2.3.2 分析步骤
2.3.2.1 标准曲线制作
分别移取10 μg/mL 亚硝酸根标准使用液0.00、0.10、0.20、0.40、0.60、0.80、1.60、2.00 mL,置于50 mL带塞比色管中,各加入2 mL 对氨基苯磺酸溶液,混匀,放置5 min,加入1 mL 盐酸萘乙二胺溶液,加水至刻度,混匀,静置15 min,用2 cm 比色皿,以试剂空白调节零点,于波长540 nm 处测吸光度,以浓度为横坐标,吸光度为纵坐标,绘制亚硝酸根的标准曲线,计算曲线系数K(曲线中需代入亚硝酸和硝酸根的换算系数)。
2.3.2.2 样品分析
用取5 mL~10 mL 硝酸试样于200 mL 容量瓶中,加入2 滴酚酞指示剂,用200 g/L 的氢氧化钠调节pH 至溶液显微红色,滴加盐酸溶液(1+9)至无色,摇匀后定容至200 mL。
从处理后的容量瓶中移取适当体积的样液于50 mL 比色管中,加入2 mL 对氨基苯磺酸溶液,混匀,放置5 min,加入1 mL 盐酸萘乙二胺溶液,加水至刻度,混匀,静置15 min,用2 cm 比色皿,以试剂空白调节零点,于波长540 nm 处测吸光度。
2.3.3 结果计算
根据标准曲线,采用式(3)计算亚硝酸含量:
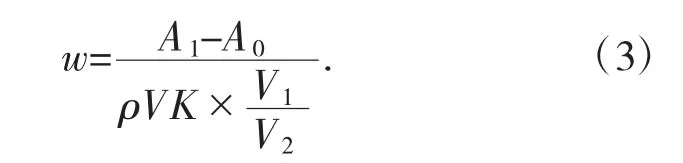
式中:W 为样品中亚硝酸盐的含量,mg/kg;ρ 为硝酸试样的密度,g/mL;A1为样液吸光值;A0为空白吸光值;K 为曲线系数;V 为硝酸试样的体积,mL;V1为硝酸试样处理后液体总体积,mL;V2为比色时移取样液体积,mL。
3 比较和讨论
3.1 高锰酸钾滴定法
高锰酸钾滴定法作为标准中推荐的方法,反应终点由无色变为浅粉色,终点颜色变化明显,易于观察,实验过程中加入还原剂硫酸亚铁,终点时消耗高锰酸钾的量包括两部分,即硫酸亚铁铵和亚硝酸,使得滴定消耗的体积增加,减少了滴定管体积带来的误差。
此操作在亚硝酸质量分数较高的情况(大于0.01%)时效果显著,但亚硝酸质量分数低于0.01%时,样品中亚硝酸含量过低造成体积差太小(小于0.1 mL),滴定速度的影响和读数的影响均可能导致结果差别较大,甚至结果一正一负,从标准要求来看,结果符合平行测定结果的绝对差值不大于0.01%,而此时报出结果只能为小于0.01%,因此会导致数据不能反映样品的真实情况。
为了提高分析的准确度,可以通过降低高锰酸钾和硫酸亚铁铵的浓度而使体积差变大,这样可以消除一部分滴定速度和读数带来的分析误差。
3.2 滴定高锰酸钾法
滴定高锰酸钾法采用亚硝酸滴定高锰酸钾溶液,操作相对简单,不同亚硝酸含量的试样可以通过调节高锰酸钾溶液的浓度和体积达到测定目的。
从准确度方面来看,在一定量高锰酸钾存在条件下,试样中亚硝酸含量越高,消耗硝酸试样的体积越小,但如果试样中的亚硝酸质量分数低于0.1%,由于反应终点由粉色变为无色,粉色的消褪会受到视觉的影响,终点判断因人而异,体现在消耗体积上就会有较大的差别,带来较大的分析误差。
从操作角度来看,操作时需要将硝酸试样直接注入滴定管,操作时具有一定的危险性;操作过程要求在烧杯中进行、反应温度为50 ℃左右、滴定管尖端恰好接触液面,这些操作均需具有一定经验的分析工谨慎操作,一旦失误极易造成化学灼伤。
3.3 分光光度法
盐酸萘乙二胺分光光度法是一种经典的测定亚硝酸离子的分析方法,经常用于水质和食品中亚硝酸盐的测定,该方法适合测定低含量的亚硝酸盐,反应在弱酸性条件下进行,显色反应明显,适合水样中亚硝酸含量为0.01 mg/L~0.4 mg/L。
在硝酸中亚硝酸含量的测定中,由于样品干扰较少,因此只需要调节酸度范围合适即可,调节酸度后的溶液定容至一定体积,按照水质分析中亚硝酸盐的分析方法移取一定体积测定即可,无需加入其他抗干扰的试剂。此法通过移取试样溶液的差别,使得低含量亚硝酸的测定变得简单易行,准确度更高。
4 结语
综合以上比较,三种方法各有优缺点,从安全的角度和准确度的角度,日常分析采用盐酸萘乙二胺分光光度法具有一定优势,同时分光光度法可以利用测定硝酸含量后的溶液,减少易制毒品高锰酸钾的用量,值得推广应用。
