氮化硼晶体作为丙烷氧化脱氢的无金属催化剂研究
2023-02-21周春艳
周春艳
(河北金厂峪矿业有限责任公司,河北 唐山 064300)
引言
催化剂的表面状态是多相催化中非常关注的问题,对提高催化活性和反应选择性起着关键作用。目前,引入氧空位是最流行的改变表面状态的策略之一。氧空位是一种具有不饱和配位的阴离子缺陷,往往会产生局部电子,可以在反应中提供部分能量[1-3]。在过去的几十年中,许多报道表明氧空位可以调节催化剂的配位、电子态、电导率、表面结构和酸碱性质。在氧空位存在的情况下,吸附反应物分子的优化和进一步活化有助于提高催化性能。例如,氧空位是促进脂肪酸在可还原氧化物如TiO2、ZrO2、Fe2O3和CeO2上吸附形成醛的重要位点。氧空位促进了TiOx 的导电性并提供了强大的金属-载体相互作用,以使金属颗粒尺寸更小,实现更高的催化活性和负载金属纳米颗粒的更高稳定性。氧空位和表面晶格羟基构成受挫的路易斯对,可以加速羟基氧化物上的CO2光催化还原[4]。迄今为止,相当多的研究集中在氧空位在金属氧化物上的催化作用。然而,由于非金属氧化物的还原困难和非金属氧化物种类的限制,对非金属氧化物中氧空位的研究仍然很少。因此,氧空位如何影响非金属氧化物上的催化反应值得研究者继续关注。
一些过渡金属(例如,Bi、Mo)也被用作添加剂,以改变氧化钒-氧化铝基催化剂的酸碱性质并提高ODHP 的活性[5]。然而,无论使用何种添加剂,都不能同时提高丙烯的选择性和丙烷的转化率,改善它们的关键在于丙烯的快速解吸和更高的丙烷吸附能力。考虑到氧空位在调节酸碱性质中的作用,期望一种合理的策略来构建具有氧空位的ODHP 活性催化剂[6]。本文通过高温还原方法在由具有三明治状结构的少层BN 覆盖的BPO4空心球表面产生氧空位。通过NH3-TPD 和BET 评估其密度。由于氧空位和BN 之间的协同作用,氮化硼晶体对丙烯的活性和选择性均有所提高。氧空位增加了丙烷的吸附量,密闭空间减弱了丙烯的吸附。此外,反应动力学模型在富含氧空位的受限空间中经历了从Eley-Rideal 机制到Langmuir-Hinshelwood 机制的转变。这项研究增强了对氧空位对非金属氧化物的作用的理解。
1 实验部分
1.1 样品制备
将氧化硼(B2O3)和磷酸氢二铵[(NH4)2HPO4]以摩尔比2∶1 混合,并在研钵中研磨。将混合物在环境大气压下于800 ℃加热2 h。冷却至室温后,用稀盐酸和超纯水研磨洗涤得到产物。将所获得的BPO4球放入管式炉中,并在NH3气氛下在900 ℃下退火0.5 h。通过延长退火时间来调整BN 质量含量制备了一系列BN/BPO4样品。退火前,系统用NH3吹扫2 h,以确保从炉中去除氧气。
1.2 程序升温脱附(TPD)测试
该测试在配备FID 的在线气相色谱仪(PannatekA90)上进行。测试前,粉末样品(20 mg)在U型石英管(内径4 mm,外径6 mm)中于300 ℃下在N2(20 mL/min)中预处理1 h。然后将预处理过的样品冷却至室温,并用丙烷或丙烯(10 mL/min)饱和30 min。随后,系统用N2(20 mL/min)冲洗1 h,以确保去除物理吸附的丙烷或丙烯。在从室温到800 ℃的温度范围内以10 ℃/min 的升温速率对探测气体进行解吸。样品的酸量在AutoChemII2920 仪器上通过NH3程序升温脱附质谱(NH3TPD-MS)进行。
2 结果与讨论
2.1 催化活性和动力学
各种样品用于催化丙烷选择性氧化为丙烯。BN/BPO4的丙烷转化率为13.6%,远高于BPO4球体(1.6%)和空白对照(0.9%)(表1)。而对于反应所用的BN/BPO4中含有相同BN 质量(2.75 mg)的商业BN,BN/BPO4比商业BN 具有更好的丙烷转化率,具有几乎相同的选择性。如表1 所示,BN 显然是ODHP 的催化活性来源。当增加商业BN 质量(5 mg)以获得与BN/BPO4相似的转化率时,丙烯选择性从75.3%下降到73.0%。总体而言,相同BN 含量的BN/BPO4优于商业BN,体现在相同丙烷转化率下丙烯选择性更高。为了更深入地了解BN 质量含量对催化活性的影响,通过改变退火时间制备了不同BN 质量含量(1、3、5 h)的BN/BPO4样品。结果表明,随着退火时间的增加,样品的微观形貌没有明显变化。BN 厚度的增加提高了BN/BPO4样品的BN 质量含量。此外,丙烷转化率随着BN 质量含量的增加迅速上升然后保持稳定甚至下降(图1-1)。转化率的增长可归因于BN 含量的增加,而生长受阻甚至下降趋势是由BPO4和BN 之间的界面面积减少引起的。相比之下,具有与BN/BPO4相似质量水平的商业BN 的活性随着BN 质量的增加而不断增长。此外,通过绘制丙烯选择性与丙烷转化率的关系(图1-2),BN/BPO4样品在与商业BN 相似的转化率水平下显示出更高的丙烯选择性。
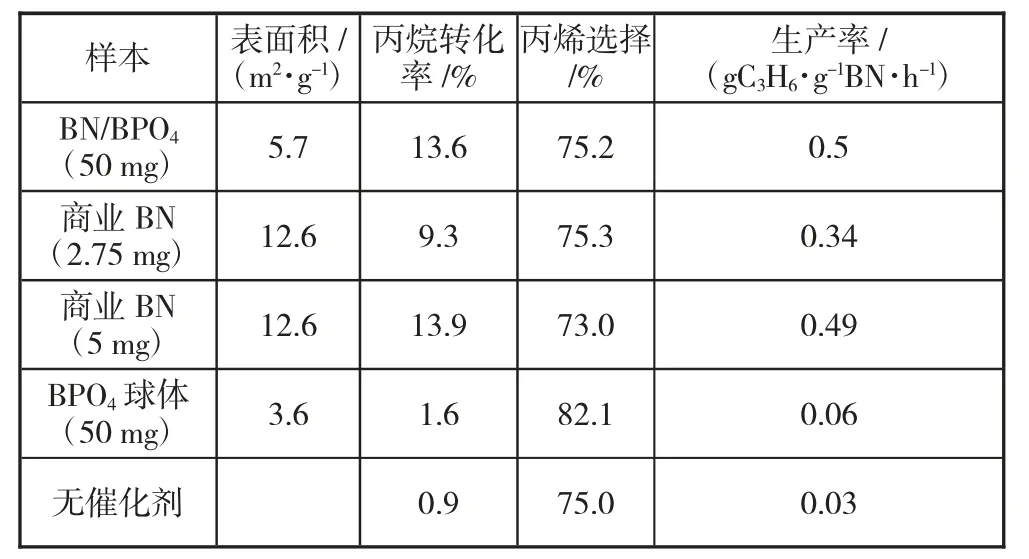
表1 各种催化剂对丙烷氧化脱氢制丙烯的催化性能

图1 反应动力学
BN/BPO4和商业BN 的表观活化能在低于10%的丙烷转化率下测量BN/BPO4的表观活化能(186 kJ/mol)低于商业BN(239 kJ/mol)(图1-3)。活化能的明显降低揭示了反应机理的变化和氧空位的关键作用。根据Hermans 的报告,Eley-R 理想机理适用于BN 催化剂的ODHP,并且随着O2分压的增加,有达到C3H8消耗速率极限的平稳趋势。然而,反应速率在这项工作中达到峰值然后下降(图1-4),这是Langmuir-Hinshelwood(LH)过程的典型特征。LH 模型的C3H8速率方程可描述为式(1):
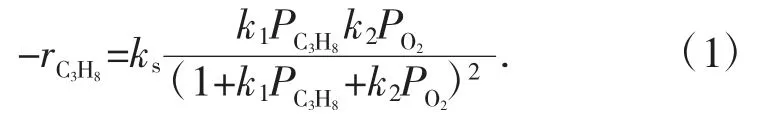
式中:rC3H8代表C3H8的消耗率;ks是速率常数;k1和k2分别是C3H8和O2的平衡吸附常数。考虑到常数(速率表达式可简化为:PC3H8=0.2 atm),速率表达式可简化为式(2):
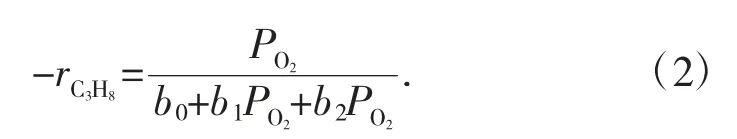
实验数据与式(2)很好地拟合,如图1-4 所示。因此,该反应遵循BN/BPO4催化剂上的Langmuir-Hinshelwood 机理。由于丙烷转化率最高,研究了BN/BPO4与质量分数8.5%BN 的长期稳定性。它在低O2浓度下表现出稳定的催化性能,揭示了在此条件下氧空位的相对稳定性。丙烯的选择性随着反应开始时氧气浓度的降低而下降,这是由于丙烷在催化剂表面的催化裂化引起的,进一步证实了Eley-Rideal 机理向Langmuir-Hinshelwood 的转变。
2.2 反应机理
基于上述结果和讨论,第23 页图2 给出了BN/BPO4上ODHP 制丙烯的示意图。丙烷分子通过孔隙进入密闭空间后与BPO4表面的氧空位结合,氧分子被吸附在BN 表面。由于BPO4和BN 表面的限制,分子氧和丙烷的反应可以看作是在同一个准平面上。然后,活性氧分子与吸附的丙烷分子而不是离解的丙烷反应,因此反应动力学模型经历了从纯BN 表面的Eley-Rideal 机制到BN/BPO4的Langmuir--Hinshelwood 机制的转变。由于受限空间效应导致吸附减弱,生成的丙烯分子迅速逸出。因此,在BN/BPO4上,ODHP 的氧空位和受限空间之间存在协同效应。
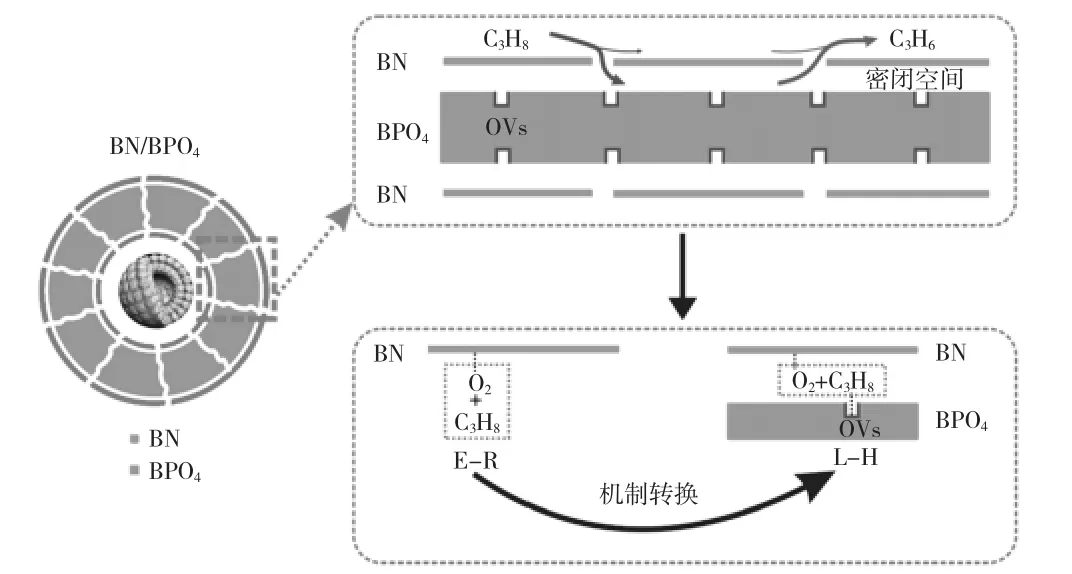
图2 反应机理示意图E-R:Eley-Rideal 机制,L-H:Langmuir--Hinshelwood 机制
3 结论
本文通过合理的催化剂设计对非金属氧化物中的氧空位进行了详细研究。在BN 覆盖下的BPO4表面上构建了氧空位,具有三明治状空心球结构。所获得的催化剂BN/BPO4在ODHP 中的活性和选择性优于商业BN 催化剂。氧空位和受限空间导致ODHP 的反应动力学模型从Eley-Rideal 机制(仅适用于BN)转变为Langmuir-Hinshelwood 机制。实验结果表明,富含氧空位的BPO4增加了丙烷的吸附量,密闭空间使丙烯更容易解吸,有利于活性位点的循环利用。因此,氧空位和密闭空间的协同作用提高了ODHP。该工作拓宽了具有氧空位的非金属氧化物在多相催化领域的应用。
