黄芪有效成分抗骨质疏松症作用机制的研究进展
2023-02-21李金益
刘 路,李 凯,胡 阳,李金益,宋 敏
黄芪有效成分抗骨质疏松症作用机制的研究进展
刘 路,李 凯,胡 阳,李金益,宋 敏*
甘肃中医药大学,甘肃 兰州 730030
骨质疏松症(osteopopsis,OP)作为一种全身性骨病,因其高发病率已严重威胁到中老年人的健康。黄芪作为补气中药经过多年的基础研究及临床应用已证实对OP的防治疗效显著。通过对黄芪及其有效成分防治OP的作用及机制等研究现状进行系统性总结,发现黄芪具有促进骨细胞的增殖分化、雌激素样作用、调节免疫功能、抗氧化应激等多种抗OP作用,能够增强骨密度,加速骨形成,减少骨破坏,维持骨稳态,同时还富含人体骨组织所需的大量微量元素,可以增加骨矿量,预防OP的发生。并分析了目前中药黄芪治疗OP研究过程中的不足之处,为OP的临床治疗提供参考和思路。
黄芪;骨质疏松症;黄芪多糖;异黄酮;黄芪甲苷;作用机制;促进骨细胞增殖;调节免疫功能;抗氧化应激
骨质疏松症(osteopopsis,OP)是一种以骨量低下、骨组织微结构损坏导致骨脆性增加,表现为单位体积骨量降低、矿盐和基质比例减少及骨的微观结构退化为特征易发生骨折的全身性骨病[1]。2018年中国疾病控制中心调查显示,我国50岁以上人群OP患病率为9.2%,而65岁以上人群OP患病率为32.0%,占比高达1/3[2],严重影响人们的生活质量。据联合国预测,到2050年,除非洲外,世界主要地区的60岁以上人口将占大约1/4,同2010年相比,亚洲OP患病人数将增长2~2.4倍[3],届时中国的OP患者累计人数将超过2亿。近年来随着中药的深入研究,中药在OP的防治方面疗效显著,同时具有不良反应小、多系统、多靶点调节作用等优势,其中黄芪作为补气中药经过多年的基础研究及临床应用已被证实对OP的防治卓有成效。本文旨在对黄芪及其有效成分防治OP的作用及机制等研究进展进行系统性总结,为OP的临床治疗提供参考和思路。
1 骨质疏松的中医学认识
OP属于中医学“骨极”“骨枯”“骨痿”等范畴。《素问·宣明五气篇》曰:“肾主骨。”肾为先天之本,主骨生髓,与骨的生长、发育、衰败密切相关。《诸病源候论·虚劳病诸候》提出:“骨极,令人酸削,齿苦痛,手足烦疼,不可以立,不欲行动”,《素问·痿论》也提出类似观点:“肾气热,则腰脊不举,骨枯而髓减,发为骨痿”。同时,脾为后天之本,在体合肉,正如《素问·五藏生成》记载:“脾主运化水谷之精,以生养肌肉,故主肉。”故全身肌肉都依赖于脾胃运化的水谷精微及津液的营养滋润。若先天后天皆有所亏损则必会发生“骨极”“骨枯”“骨痿”,因此中医学认为“脾肾亏虚”为骨质疏松的基本病因病机,所以临床上对于OP的中医药治疗多以补肾中药为主,再结合补气中药二者相辅相成。
2 黄芪治疗OP的主要机制
黄芪,药名始见于《神农本草经》,性味甘、微温,归肺经、脾经,主要功效为补气升阳、固表止汗等[4]。黄芪化学成分复杂,含有多糖类、黄酮类、皂苷类、氨基酸类、黄芪碱、微量元素等,其中多糖类、黄酮类和皂苷类化合物是黄芪的主要药效成分[5-6]。黄芪多糖为黄芪最主要的活性成分[7],黄酮类衍生物则是黄芪质量评价的重要指标[8]。黄芪作为“补气圣药”,性甘温、补纯阳,可补诸虚不足,因此在OP的临床治疗中可以做到温补脾气同时兼补肾阳虚,疗效显著[9]。
2.1 促进成骨细胞的增殖分化
成骨细胞是骨形成的关键细胞,对骨骼的生长与维持起至关重要的作用,通过促进成骨细胞的增殖分化增强骨形成是临床上治疗OP的常用方法[10]。胡俊等[11]认为黄芪多糖可以促进成骨细胞的增殖、分化,研究结果表明黄芪多糖可以上调早期成骨标志物碱性磷酸酶(alkaline phosphatase,ALP)、Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)以及钙沉积标志物I型胶原蛋白的表达,且呈剂量相关性。Wnt信号通路是决定间充质干细胞(mesenchymal stem cells,MSCs)向成骨细胞定向分化的关键通路,Jian等[12]发现黄芪异黄酮可以促进小鼠骨髓基质贴壁ST2细胞的增殖与分化,并显著增加β-连环蛋白(β-catenin)的蛋白表达,而Wnt/β-catenin信号通路的特异性抑制剂Dick-kopf相关蛋白1(Dick-kopf-related protein,DKK-1)则能够有效抑制ALP活性和β-catenin的蛋白表达,证明异黄酮可通过Wnt/β-catenin信号通路调节ST2细胞的增殖分化,进而刺激成骨细胞分化。翟鑫祥等[13]通过建立去卵巢大鼠模型,模拟绝经后骨质疏松大鼠,随后分离各组大鼠MSCs并在黄芪多糖的诱导下进行成骨分化,结果显示经过黄芪多糖干预后细胞中的骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)、骨保护素蛋白表达水平同时升高,明显促进了MSCs的成骨分化。Cai等[14]将1%、5%、10%、15%的黄芪甲苷通过转化生长因子-β(transforming growth factor-β,TGF-β)/Smad信号通路对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)进行干预,结果显示黄芪甲苷可促进BMSCs的增殖,尤其以1%、5%黄芪甲苷效果最为显著。王家伟等[15]则验证了黄芪甲苷能够通过TGF-β1/Smad2信号通路促进BMSCs的成骨分化。刘开心等[16]则基于UPLC-Q-TOF-MS技术以骨髓抑制SD大鼠为实验对象进行分析,发现毛蕊异黄酮以原型成分入血,而黄芪甲苷以代谢产物入血,二者配伍可以有效促进骨髓造血损伤修复,同时毛蕊异黄酮还能够促进大鼠BMSCs的增殖分化。骨钙素作为成骨细胞分化、成熟的标志,是骨形成的重要标志,李文等[17]通过细胞实验发现黄芪可以促进成骨分化细胞中骨钙素mRNA与蛋白的表达,并使钙结节形成数增加,加强成骨细胞的成骨能力。维生素D同样是一种重要的骨代谢调节激素,柴艺汇等[18]认为黄芪多糖通过上调成骨细胞维生素D受体mRNA及蛋白的表达进而增强成骨细胞活性是其治疗OP的重要机制。一项研究表明[19]黄芪甲苷可以促进成骨细胞的细胞活力、成骨分化和血管生成基因表达,刺激成骨和血管生成的耦合,加速骨再生。
黄芪促进成骨细胞增殖分化的作用机制见图1。
2.2 发挥雌激素样作用
雌激素缺乏会使破骨细胞的再吸收活性升高,却不会增加成骨细胞的活性,导致骨吸收增强,骨稳态被打破,因而绝经后女性更易患OP[20]。黄芪可发挥雌激素样作用主要体现在可改善生物的免疫功能而非改变性激素水平,Zheng等[21]研究证明黄芪可以发挥雌激素样作用显著改善去卵巢雌性大鼠血清中白细胞介素-2(interleukin-2,IL-2)和IL-8等炎性因子水平,而不改变血清中雌二醇、促卵泡激素、促黄体生成素等性激素类的水平。也有研究表明,黄芪能够显示出雌激素活性,防治因雌激素缺乏而产生的骨丢失,维持骨稳态[22]。Park等[23]基于此研究进行了临床试验,受试者服用黄芪提取物异黄酮所制成的片剂12周后,与对照组相比,其女性更年期综合征自我诊断评定表评分明显降低,同样证明了异黄酮可以发挥雌激素样作用。Li等[24]也发现异黄酮能够发挥雌激素样作用,对人脐静脉内皮细胞具有双向调节作用,低浓度促进内皮细胞增殖、高浓度则产生抑制作用。Essawy等[25]则发现黄芪甲苷可与雌激素受体相结合并调节相关基因表达以发挥雌激素样作用。王吉博等[26]将雌性大鼠去势后建立OP模型,分别ig黄芪水煎液与尼尔雌醇,同模型组比,结果显示黄芪组、雌激素组血清ALP、骨钙素水平降低,同时黄芪组骨钙、骨磷含量升高,而雌激素组仅骨磷含量升高,相较于雌激素,黄芪能够更好地增强骨密度。Hu[27]在去卵巢大鼠模型的动物实验中证明黄芪与雌激素补充剂戊酸雌二醇的疗效相似,且黄芪具有低不良反应,因此临床上可代替雌激素作为替代疗法进行使用。
黄芪发挥雌激素样作用机制见图2。

LRP-低密度脂蛋白受体相关蛋白
2.3 炎性调控作用
免疫系统通过细胞因子介导生理性骨转换,会依据机体环境变化调节骨吸收与骨形成,以保持骨量,但在免疫抑制状态下会导致病理性的骨破坏,使OP的发生率增加[28]。Shojaii等[29]研究发现黄酮类化合物与黄芪甲苷对注射福尔马林后诱发前爪水肿的大鼠有明显的抗炎与镇痛作用。邵帅等[30]则将巨噬细胞作为研究对象,用黄芪甲苷进行干预,结果显示巨噬细胞中的IL-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平显著降低,并下调核因子-κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)蛋白与mRNA的表达,上调骨保护素蛋白与mRNA的表达,表明黄芪甲苷可通过调节核因子-κB(nuclear factor-κB,NF-κB)通路抑制炎性因子产生,通过骨保护素/RANKL/RANK信号通路调节骨代谢。韩亚琨等[31]则通过建立右上磨牙牙周炎模型发现,与对照组相比,黄芪多糖可以升高血清中IL-1β、IL-6、TNF-α水平,同时随着黄芪多糖剂量增加血清中RANKL、骨保护素的水平呈下降趋势,表明黄芪多糖通过NF-κB通路与骨保护素/RANKL/RANK信号通路分别进行炎性调控与骨代谢。Nöst等[32]应用UPLC-Q-TOF-MS技术发现黄芪可抑制人组织细胞淋巴瘤细胞中促炎因子TNF-α和IL-1β的分泌。而Li等[33]运用UHPLC-Q-Exactive-MS技术检测黄芪多糖对免疫抑制小鼠血浆样本的影响,发现黄芪多糖通过苯丙氨酸、酪氨酸、色氨酸生物合成以及苯丙氨酸代谢途径对免疫功能产生影响,半胱氨酸和蛋氨酸代谢途径参与免疫调节,柠檬酸循环回调小鼠的免疫功能。
黄芪通过炎性调控改善骨代谢的作用机制见图3。
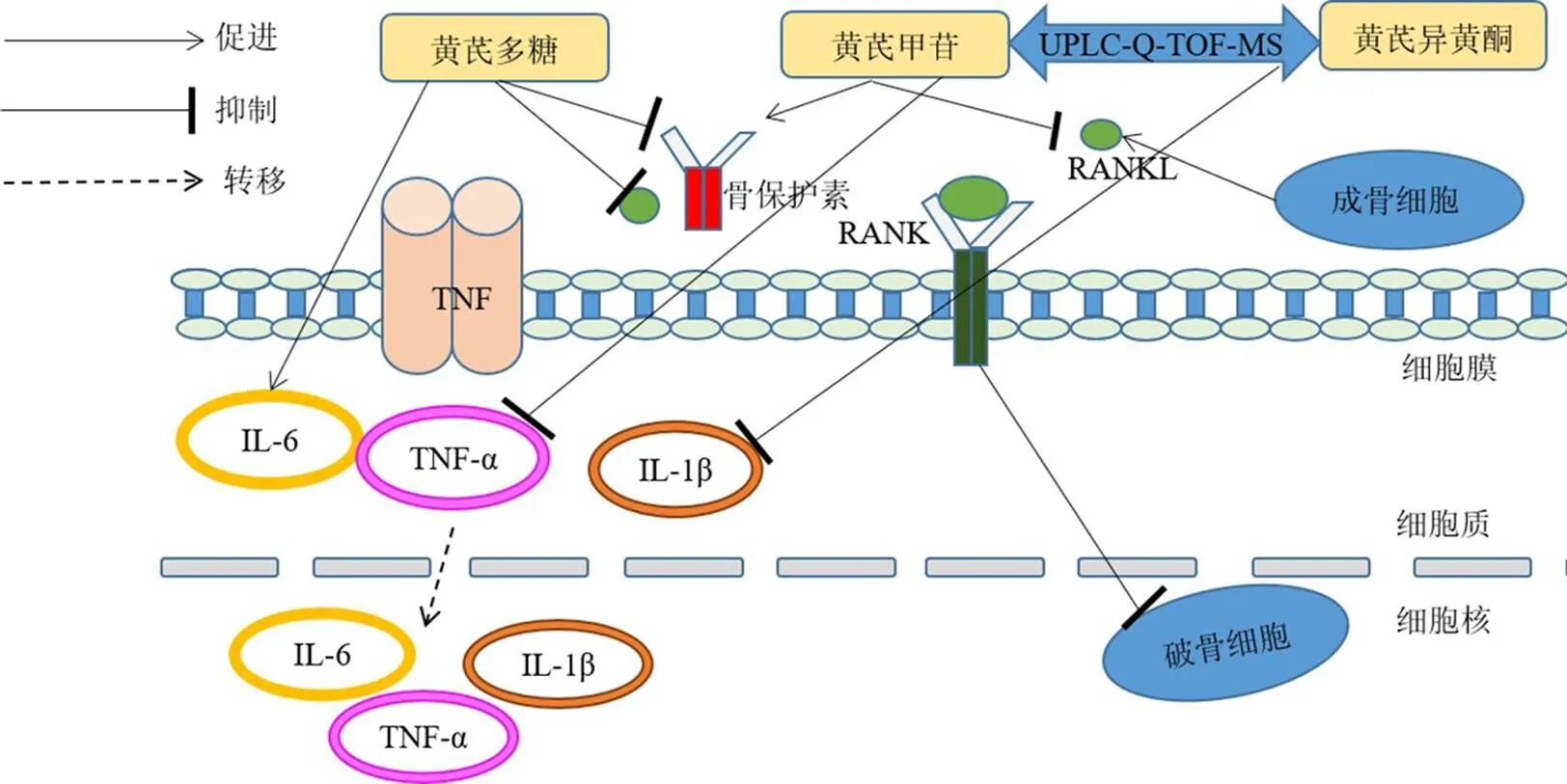
图3 黄芪通过炎性调控改善骨代谢的作用机制
2.4 抗氧化应激作用
氧化应激是影响骨重塑的重要因素,它会使细胞氧化还原平衡转向氧化失衡,从而加速功能和结构重塑,降低骨密度,增加发生OP的风险[34]。线粒体氧化与磷酸化是细胞中能量的主要来源,线粒体电子转移活动时会产生活性氧,而活性氧的增加会导致线粒体DNA发生突变并破坏线粒体成分,因此线粒体具有复杂的抗氧化防御系统,当生物系统中氧化剂和抗氧化能力之间的稳态平衡受到干扰时,就会发生氧化应激[35]。超氧阴离子是大多数活性氧的前体,是氧化链反应的主要介质,通过自发歧化或超氧化物歧化酶的催化反应产生过氧化氢(H2O2),使线粒体生物分子遭受氧化损伤。Li等[36]研究表明,黄芪多糖不仅可以预防线粒体中的脂质过氧化,还可以清除超氧阴离子与H2O2活性,并增强抗氧化酶的活性,能够有效降低活性氧并增强线粒体的功能。Wu等[37]发现黄芪甲苷通过激活核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)通路减少细胞内活性氧的产生,避免氧化损伤。叉头框蛋白O(forkhead box class O proteins,FoxOs)转录因子是影响成骨细胞氧化还原平衡和骨骼稳态的关键因素。成鹏等[38]通过动物实验发现黄芪甲苷能抑制去卵巢大鼠的FoxO3a蛋白表达水平,同时上调β-catenin和Wnt2蛋白表达,证明了黄芪甲苷通过激活FoxO3a/Wnt2/β-catenin信号通路有效抑制氧化应激诱导的OP。Ou等[39]实验结果表明黄芪多糖在抑制去卵巢大鼠mRNA表达的同时,上调、mRNA表达,验证了黄芪多糖调控氧化应激诱导的OP也是通过FoxO3a/Wnt2/β-catenin信号通路完成的。
黄芪抗氧化应激的作用机制见图4。
2.5 提高微量元素含量
人体中常见的微量元素,如锌、铜、镁、铁、锰、钙等可以增强骨密度[40],而OP患者骨组织中的微量元素含量明显低于正常人[41]。白雯静等[42]测定黄芪原药材及饮片中多种微量元素的含量,发现黄芪中含量最多的微量元素为钠、镁、铝、钾、钙、铁。Butkutė等[43]将黄芪细分为根、茎、叶,进一步验证黄芪中微量元素的含量,结果表明叶中的钙、镁、铁的含量高于根和茎,根中钾、磷、锌的含量高于叶和茎,而茎的微量元素含量是最低的,这为黄芪在临床诊疗中的取材与应用提供了思路。
黄芪所含可增强骨密度的微量元素见图5。
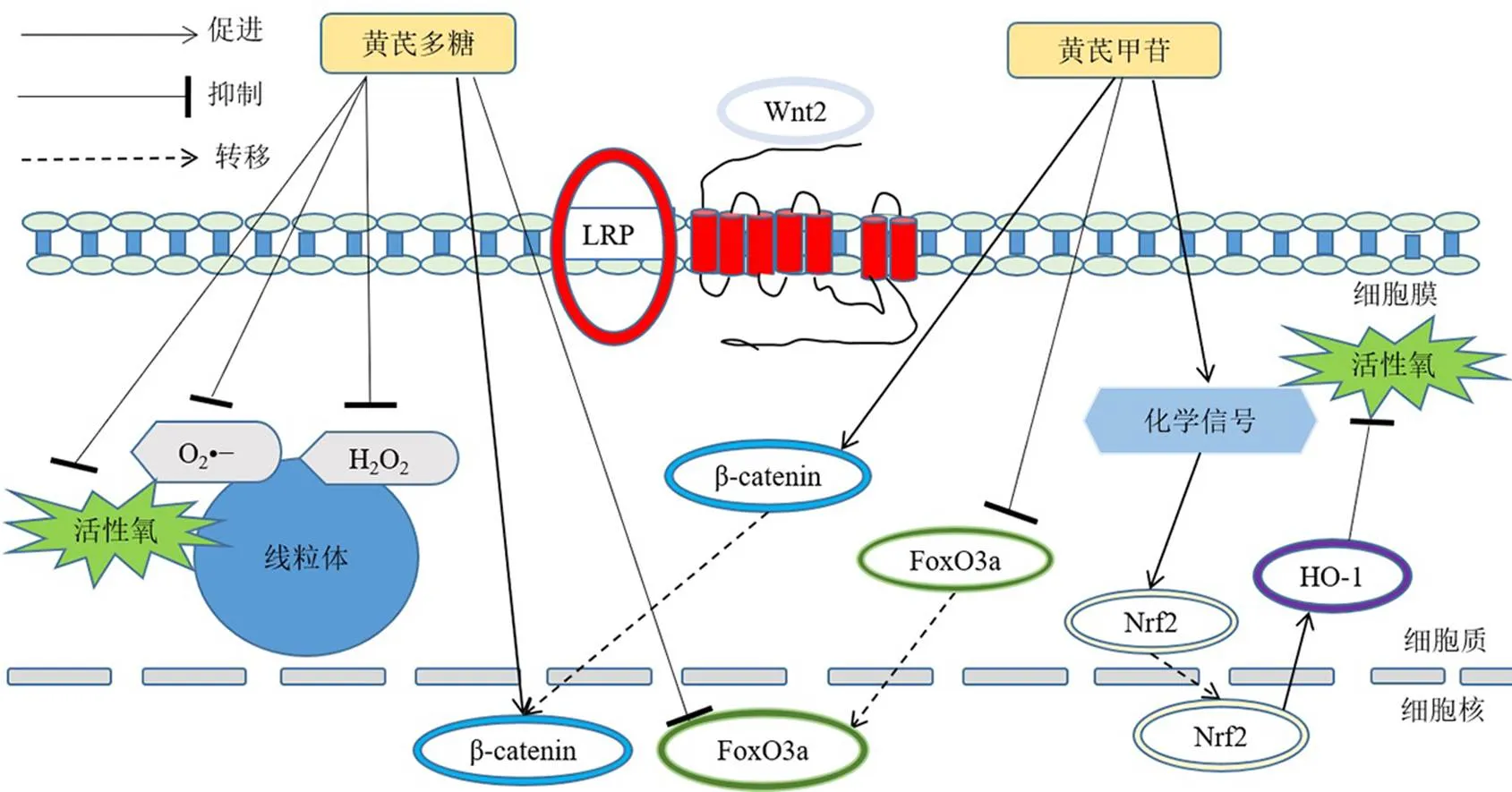
图4 黄芪抗氧化应激的作用机制
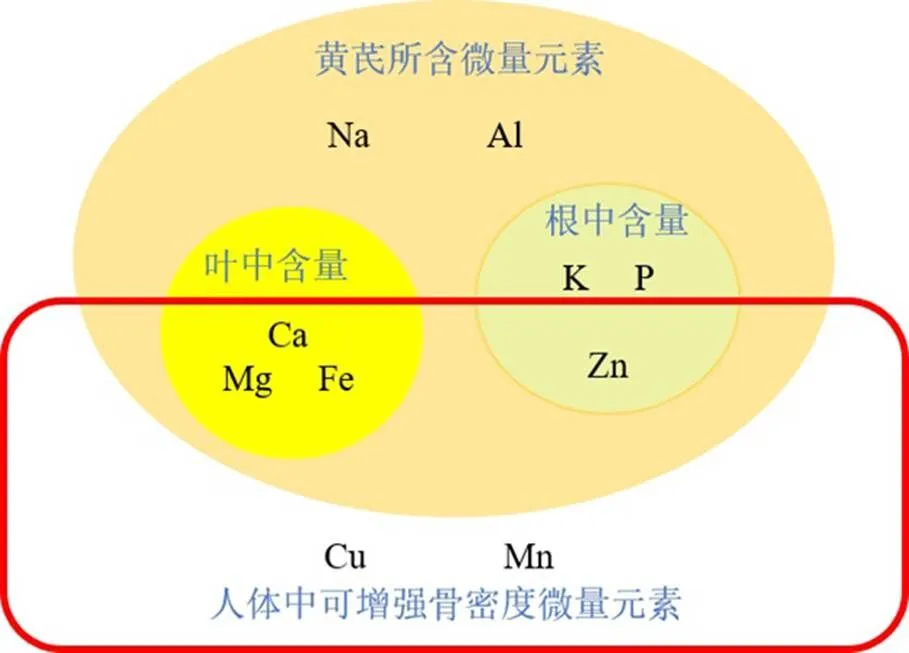
图5 黄芪所含可增强骨密度的微量元素
3 结语与展望
我国正在步入人口老龄化,OP引发的健康问题日益严峻,因此应用中药所具有的独特优势治疗OP势在必行[44-45]。大量研究表明黄芪具有促进骨细胞的增殖分化、代替雌激素表达、调节免疫功能、抗氧化应激等多种抗OP作用机制,能够增强骨密度,加速骨形成,减少骨破坏,维持骨稳态,同时还富含人体骨组织所需的大量微量元素,可以增加骨矿量,预防OP的发生[46]。黄芪抗OP的主要成分及作用机制见表1。
黄芪多糖(图6)是黄芪最主要的活性成分,不仅可以直接促进骨细胞的增殖分化,还能够上调维生素D的表达间接促进骨细胞的增殖分化,并且通过抑制炎性因子与氧化应激来降低OP的发生率。黄酮类衍生物作为黄芪质量评价指标,由于其种类繁多,因此多以其具有代表性的标志物异黄酮(图6)为研究对象,与之类似,皂苷化合物也多通过黄芪甲苷进行研究。异黄酮与黄芪甲苷均可促进骨细胞的增殖分化,并具有雌激素样作用、免疫调控作用,但后者所具有的抗氧化应激作用是前者尚未研究发现的。黄芪在治疗OP过程中起到重要的作用,临床疗效也深受广大专家及学者的认可,为解决当前的公共健康问题找到了一条有效途径。

表1 黄芪抗OP的主要成分及作用机制
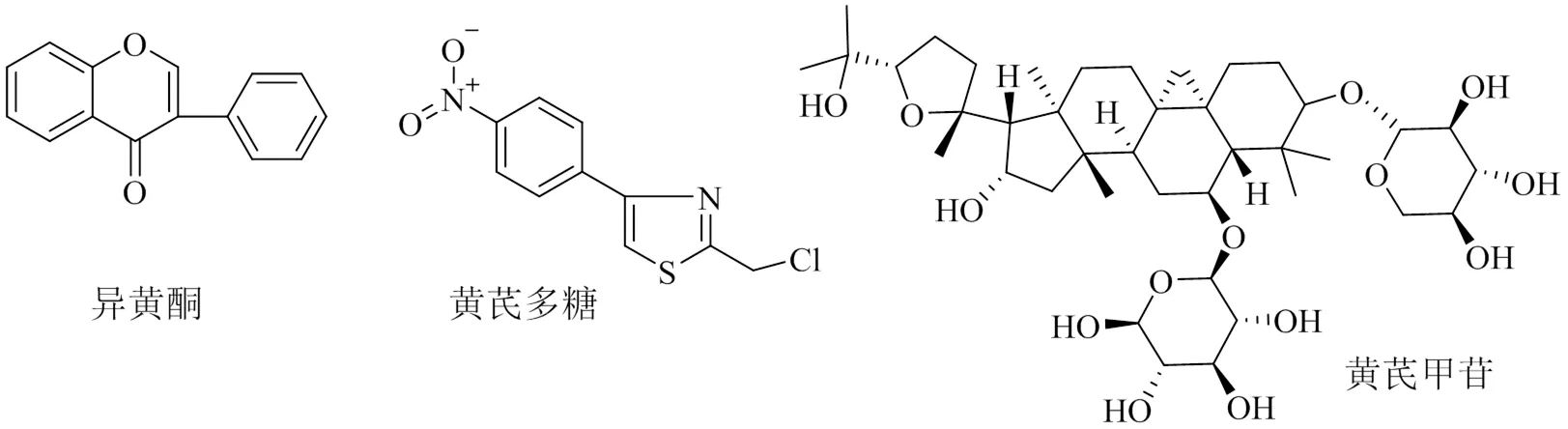
图6 黄芪多糖、异黄酮、黄芪甲苷化学结构
随着中医药现代化的进步与发展,黄芪治疗OP的研究也愈发深入,但在研究中仍存在一些问题:首先,黄芪治疗OP的研究以基础研究为主,临床研究相对缺乏,且多为含有黄芪的组方研究,不能全面、系统地阐明黄芪治疗OP的作用机制;其次,黄芪的质量难以评估及控制,药用价值无法被完整地了解与认知。而黄芪单味中药临床研究不足的重要原因,在于难以准确评估与控制的黄芪质量,因此在今后的研究中可以通过分子生物学、多组学研究、药动学等方法相辅相成,更好地解析黄芪的复杂成分与作用,从而为黄芪的临床研究提供更加准确的理论支持,能够更加精准地对黄芪的临床作用机制进行研究与探讨,实现全方位探索黄芪治疗OP的作用机制,提高OP的临床疗效。
利益冲突 所有作者均声明不存在利益冲突
[1] 夏维波, 章振林, 林华, 等. 原发性骨质疏松症诊疗指南 (2017) [J]. 中国骨质疏松杂志, 2019, 25(3): 281-309.
[2] 中华医学会骨质疏松和骨矿盐疾病分会. 中国骨质疏松症流行病学调查及“健康骨骼” 专项行动结果发布 [J]. 中华骨质疏松和骨矿盐疾病杂志, 2019, 12(4): 317-318.
[3] Clynes M A, Harvey N C, Curtis E M,. The epidemiology of osteoporosis [J]., 2020, 133(1): 105-117.
[4] 中国药典 [S]. 一部. 2020: 315.
[5] 朱莉萍. 黄芪的药理研究及进展 [J]. 内蒙古中医药, 2018, 37(3): 98-99.
[6] Li X X, Qu L, Dong Y Z,. A review of recent research progress on thegenus [J]., 2014, 19(11): 18850-18880.
[7] 刘颖, 张金莲, 邓亚羚, 等. 黄芪多糖提取、分离纯化及其药理作用研究进展 [J]. 中华中医药杂志, 2021, 36(10): 6035-6038.
[8] 张淑娟, 张育贵, 牛江涛, 等. 黄芪的研究进展及其质量标志物预测分析 [J]. 中华中医药学刊, 2022, 40(2): 151-155.
[9] 孙洁. 黄芪及其经方的临床应用研究进展 [J]. 中国医院药学杂志, 2019, 39(12): 1311-1314.
[10] Lee W C, Guntur A R, Long F X,. Energy metabolism of the osteoblast: Implications for osteoporosis [J]., 2017, 38(3): 255-266.
[11] 胡俊, 杨盼盼, 袁忠, 等. 黄芪多糖对MC3T3-E1细胞增殖及成骨分化的影响 [J]. 中国骨质疏松杂志, 2021, 27(12): 1788-1791.
[12] Jian J, Sun L J, Cheng X,. Calycosin-7--β--glucopyranoside stimulates osteoblast differentiation through regulating the BMP/Wnt signaling pathways [J]., 2015, 5(5): 454-460.
[13] 翟鑫祥, 董辉, 王晶, 等. 黄芪多糖保护去卵巢大鼠成骨细胞功能活性的机制研究 [J]. 天津医药, 2022, 50(3): 265-269.
[14] Cai B, Zhang A G, Zhang X,. Promoting effects on proliferation and chondrogenic differentiation of bone marrow-derived mesenchymal stem cells by four “kidney-tonifying” traditional Chinese herbs [J]., 2015, 2015: 792161.
[15] 王家伟, 孙廉旭, 张莎, 等. 黄芪甲苷激活TGF-β1/Smad2信号通路诱导骨髓间充质干细胞向周细胞分化的作用研究 [J]. 现代生物医学进展, 2018, 18(8): 1407-1413.
[16] 刘开心, 祁永华, 张喜武, 等. 基于UPLC-Q-TOF-MS技术的圣愈汤干预骨髓抑制大鼠的体内显效成分分析 [J]. 中药药理与临床, 2022, 38(2): 7-13.
[17] 李文, 顾春松, 管连城, 等. 黄芪对-半乳糖诱导骨髓间充质干细胞钙结节数、骨钙素mRNA及蛋白表达水平的影响 [J]. 时珍国医国药, 2020, 31(11): 2586-2590.
[18] 柴艺汇, 高洁, 陈云志, 等. 黄芪多糖对小鼠MC-3T3-E1成骨细胞维生素D受体mRNA及蛋白表达的影响 [J]. 时珍国医国药, 2018, 29(6): 1281-1283.
[19] Wang F, Qian H J, Kong L C,. Accelerated bone regeneration by astragaloside IV through stimulating the coupling of osteogenesis and angiogenesis [J]., 2021, 17(7): 1821-1836.
[20] Tella S H, Gallagher J C. Prevention and treatment of postmenopausal osteoporosis [J]., 2014, 142: 155-170.
[21] Zheng Y, Jin Y, Zhu H B,. Effects of a Chinese medicinal planton the ovariectomized female rats [J]., 2012, 10(1): 9-14.
[22] Koo H J, Sohn E H, Kang S C. The optimal combination of the mixture of unripeandin the activation and differentiation of osteoblastic cells [J]., 2013, 26(5): 658-662.
[23] Park J S, Sung H K, Kim S K,. Efficacy ofmiq. andbunge extract for postmenopausal syndrome: A randomised, double-blind, placebo comparative clinical trial [J]., 2022, 2022: 4066054.
[24] Li X, Huang C, Sui C L,. Formononetin, J1 and J2 have different effects on endothelial cells via EWSAT1-TRAF6and its downstream pathway [J]., 2020, 24(1): 875-885.
[25] Essawy A E, Abd Elkader H A E, Khamiss O A,. Therapeutic effects of astragaloside IV andagainst bisphenol A-induced neurotoxicity and DNA damage in rats [J]., 2021, 9: e11930.
[26] 王吉博, 王兆杰, 安荣泽, 等. 杜仲配伍黄芪对雌性大鼠去势后骨质疏松的影响 [J]. 山东医药, 2017, 57(48): 31-34.
[27] Hu X J. Protective capability of(Huangqi) on auditory function in a rat model of estrogen deficiency [J]., 2019, 132(1): 106-108.
[28] Weitzmann M N. Bone and the immune system [J]., 2017, 45(7): 911-924.
[29] Shojaii A, Motaghinejad M, Norouzi S,. Evaluation of anti-inflammatory and analgesic activity of the extract and fractions ofin animal models [J]., 2015, 14(1): 263-269.
[30] 邵帅, 鲁美丽, 高秀秋, 等. 黄芪甲苷对脂多糖诱导的巨噬细胞炎症反应及核因子κB受体活化因子配体/骨保护素系统表达的影响 [J]. 中国医科大学学报, 2022, 51(4): 294-300.
[31] 韩亚琨, 于程程. 黄芪多糖对实验性牙周炎骨吸收的影响 [J]. 中草药, 2019, 50(2): 423-427.
[32] Nöst X, Pferschy-Wenzig E M, Nikles S,. Identification of constituents affecting the secretion of pro-inflammatory cytokines in LPS-induced U937 cells by UHPLC-HRMS-based metabolic profiling of the traditional Chinese medicine formulation Huangqi Jianzhong Tang [J]., 2019, 24(17): 3116.
[33] Li K, Cui L J, Cao Y X,. UHPLC Q-exactive MS-based serum metabolomics to explore the effect mechanisms of immunological activity ofpolysaccharides with different molecular weights [J]., 2020, 11: 595692.
[34] Zhou Q Z, Zhu L, Zhang D F,. Oxidative stress-related biomarkers in postmenopausal osteoporosis: A systematic review and meta-analyses [J]., 2016, 2016: 7067984.
[35] Manczak M, Jung Y, Park B S,. Time-course of mitochondrial gene expressions in mice brains: Implications for mitochondrial dysfunction, oxidative damage, and cytochrome c in aging [J]., 2005, 92(3): 494-504.
[36] Li X T, Zhang Y K, Kuang H X,. Mitochondrial protection and anti-aging activity ofpolysaccharides and their potential mechanism [J]., 2012, 13(2): 1747-1761.
[37] Wu X H, Xu J, Cai Y S,. Cytoprotection against oxidative stress by methylnissolin-3--β-d-glucopyranoside frommainly via the activation of the Nrf2/HO-1 pathway [J]., 2021, 26(13): 3852.
[38] 成鹏, 白银亮, 胡彩莉, 等. 黄芪甲苷通过调控FoxO3a/Wnt2/β-catenin通路抑制去卵巢大鼠骨质疏松的作用 [J]. 中国实验方剂学杂志, 2018, 24(15): 161-166.
[39] Ou L, Wei P F, Li M,. Inhibitory effect ofpolysaccharide on osteoporosis in ovariectomized rats by regulating FoxO3a/Wnt signaling pathway [J]., 2019, 34(5): e201900502.
[40] Zofkova I, Davis M, Blahos J. Trace elements have beneficial, as well as detrimental effects on bone homeostasis [J]., 2017, 66(3): 391-402.
[41] Okyay E, Ertugrul C, Acar B,. Comparative evaluation of serum levels of main minerals and postmenopausal osteoporosis [J]., 2013, 76(4): 320-325.
[42] 白雯静, 姬良亮, 王月玲. 甘草、黄芪、党参中27种重金属及微量元素含量变化的研究 [J]. 食品安全质量检测学报, 2021, 12(4): 1448-1455.
[43] Butkutė B, Dagilytė A, Benetis R,. Mineral and phytochemical profiles and antioxidant activity of herbal material from two temperatespecies [J]., 2018, 2018: 6318630.
[44] 卜寒梅, 王世坤, 李远栋, 等. 补肾中药基于OPG/ RANKL/RANK信号通路对原发性骨质疏松症作用机制的研究进展 [J]. 中草药, 2022, 53(10): 3209-3217.
[45] 刘广臣, 张红梅, 杨帆, 等. 中药多糖防治骨质疏松症作用及机制的研究进展 [J]. 中草药, 2022, 53(12): 3831-3841.
[46] 康艳萍. 黄芪、山药、黄精、银杏叶、五味子中微量元素测定研究 [J]. 广州化工, 2020, 48(15): 127-128.
Research progress on anti-osteoporosis mechanism of active components in
LIU Lu, LI Kai, HU Yang, LI Jin-yi, SONG Min
Gansu University of Chinese Medicine, Lanzhou 730030, China
As a systemic bone disease, osteoporosis (OP) has become a serious threat to the health of middle-aged and elderly people due to its high incidence. Huangqi () as a traditional Chinese medicine for replenishing qi, has been proven to be effective in the prevention and treatment of OP after years of basic research and clinical application. In this paper, we systematically summarized research status ofand its effective components in the prevention and treatment of OP, and find thathas various anti-OP mechanisms of action such as promoting the proliferation and differentiation of bone cells, estrogen expression, regulating immune function, anti-oxidative stress, etc. It can enhance bone density, accelerate bone formation, reduce bone destruction, maintain bone homeostasis, and is also rich in a large number of trace elements required by human bone tissue, which can increase bone mineral quantity and prevent the occurrence of OP. We also analyzed the shortcomings in the current research of Chinese herbal medicinein treatment of OP, aiming to provide reference and ideas for the clinical treatment of OP.
; osteoporosis; astragalus polysaccharide; isoflavone; astragaloside; promote bone cell proliferation; regulating immune function; anti-oxidative stress
R282.710.5
A
0253 - 2670(2023)04 - 1321 - 08
10.7501/j.issn.0253-2670.2023.04.033
2022-08-04
国家自然科学基金资助项目(81960877);国家自然科学基金资助项目(81960878);甘肃省高等学校产业支撑计划(2022CYZC-52)
刘 路,硕士研究生,研究方向为中医药防治骨伤科慢性疾病。E-mail: 467751104@qq.com
宋 敏,教授,主任医师,博士生导师,从事中医药防治骨伤科疾病研究。E-mail: sm@gszyy.edu.cn
[责任编辑 赵慧亮]
