补肺活血胶囊大鼠体内代谢产物鉴定及代谢途径分析
2023-02-21张祎盈王恒斌耿婉丽钱大玮段金廒
任 慧,郭 盛*,张祎盈,李 全,王恒斌,耿婉丽,钱大玮,段金廒
补肺活血胶囊大鼠体内代谢产物鉴定及代谢途径分析
任 慧1,郭 盛1*,张祎盈1,李 全2,王恒斌2,耿婉丽3,钱大玮1,段金廒1
1. 南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心/江苏省方剂高技术研究重点实验室,江苏 南京 210023 2. 雷允上药业集团有限公司,江苏 苏州 215003 3. 广东雷允上药业有限公司,广东 云浮 527300
研究补肺活血胶囊(Bufei Huoxue Capsules,BHC)在大鼠血浆、胆汁、尿液、粪便中的原型成分及其代谢产物,归纳总结不同类型化合物的体内代谢规律。大鼠ig BHC后,收集血浆、胆汁、尿液和粪便样品并进行预处理,采用超高效液相色谱-飞行时间质谱(ultra-high performance liquid chromatography-time-of-flight mass spectrometry,UPLC-Q-TOF-MS)及质量亏损过滤技术,分别在正、负离子模式下对原型成分及代谢产物进行分析鉴定。共检测到没食子酸、芍药苷、毛蕊异黄酮、新补骨脂异黄酮、()-异补骨脂二氢黄酮、补骨脂苷等原型成分及代谢产物67个,其中酚酸类成分10个、单萜类成分7个、黄酮类成分35个、香豆素类成分12个、皂苷类成分3个,主要代谢途径包括氧化、还原、甲基化、葡糖醛酸结合、硫酸结合等。初步阐明了BHC大鼠体内的代谢产物及其代谢转化特征,为基于体内过程揭示其药效物质基础奠定了基础,为其临床安全用药提供了科学依据。
补肺活血胶囊;代谢产物鉴定;代谢途径分析;UPLC-Q-TOF-MS;没食子酸;芍药苷;毛蕊异黄酮;新补骨脂异黄酮;()-异补骨脂二氢黄酮;补骨脂苷;黄芪甲苷
补肺活血胶囊(Bufei Huoxue Capsules,BHC)收载于《中国药典》2020年版,由黄芪、赤芍、补骨脂3味中药组成,具有益气活血、补肺固肾等功效,是治疗肺心病(缓解期)属气虚血瘀证的有效复方[1]。大量研究表明,BHC被广泛应用于尘肺病[2]、肺纤维化[3]、慢性阻塞性肺疾病[4]、新型冠状病毒肺炎[5-7]等多种呼吸道疾病的治疗。现代研究显示,BHC含有酚酸类、单萜类、黄酮类、香豆素类、皂苷类等化学成分[8],在质量控制[9-10]、药理作用[11]、临床应用[3-4]等多个领域已开展了系列研究,然而关于其活性组分体内代谢过程研究报道较少。课题组前期对BHC吸收入血的原型成分进行“药-时”曲线绘制及药动学参数计算,阐明其体内吸收规律[12],但其体内代谢途径及代谢产物尚未见报道。
药物体内代谢产物研究可明确活性组分在体内的生物转化规律,为其药效物质基础的阐明提供参考。中药复方具有成分组成复杂、化学结构及代谢途径多样、内源性成分干扰因素多、生物样本中目标组分浓度低等特点,增加了其代谢产物鉴定的难度[13]。唐清等[8]采用UFLC-Triple TOF MS/MS技术对BHC中体外化学物质进行了定性分析,共确证和指认了42个化合物。本实验在此基础上采用超高效液相色谱-飞行时间质谱仪(ultra-high performance liquid chromatography-time-of-flight mass spectrometry,UPLC-Q-TOF-MS),运用碰撞能量梯度(MSE)及质量亏损过滤技术,快速分析鉴定BHC在大鼠血浆、胆汁、尿液、粪便中的代谢产物,并对黄芪中的毛蕊异黄酮等黄酮类及黄芪甲苷等皂苷类成分、赤芍中的没食子酸等酚酸类及芍药苷等单萜类成分、补骨脂中的新补骨脂异黄酮等黄酮类及补骨脂苷等香豆素类成分的代谢规律进行阐释,以期阐明BHC在生物体内的代谢规律,为临床安全用药提供科学依据。
1 材料
1.1 仪器
AcquityTMUPLC系统、SynaptTMQ-TOF质谱仪(配有Lock-spray接口,电喷雾离子源ESI)、MassLynx 4.2质谱工作站软件、MetaboLynx XS分析软件(美国Waters公司);KQ-250E型超声波清洗器(频率40 kHz,功率250 W,昆山禾创超声仪器有限公司);MS105型万分之一、ML204型十万分之一电子分析天平(瑞士梅特勒托利多公司);Anke GL-16G Ⅱ型离心机(上海安亭科学仪器厂);Millipore-Q纯水系统(美国Millipore公司)。
1.2 试药
对照品没食子酸(批号Y19M8C36143)、芍药苷(批号X12A8C33672)、氧化芍药苷(批号Z14J9S63652)、没食子酰芍药苷(批号P08A10S85131)、芍药内酯苷(批号Y15D8H50784)、毛蕊异黄酮(批号Y24N9Y75652)、芒柄花素(批号F27J7S18516)、新补骨脂异黄酮(批号ZN1112BD13)、补骨脂宁(批号ZN1112BA13)、3-羟基-9,10-二甲氧基紫檀烷(批号Y28M10H84302)、()-异补骨脂二氢黄酮(批号YM0509HA1)、补骨脂甲素(批号C19J8G28797)、补骨脂苷(批号Y07A7S12664)、补骨脂素(批号C22A9Q68562)、异补骨脂苷(批号Y27A9S60238)、异补骨脂素(批号C05M10Q82078)、黄芪甲苷(批号J04M8T30363),以上对照品质量分数均≥98%,购自上海源叶生物科技有限公司;BHC(批号022004)由广州雷允上药业有限公司提供。甲醇、乙醇为色谱纯(德国Merck公司);甲酸为色谱纯(美国ACS公司);超纯水为Milli-Q纯水机制备。
1.3 实验动物
SPF级雄性SD大鼠,体质量200~220 g,购自浙江维通利华实验动物技术有限公司,合格证号SCXK(浙)2019-0001,并经南京中医药大学动物中心伦理委员会批准(伦理审批号202010A027),饲养于南京中医药大学动物中心屏障系统内,温度(20±2)℃,湿度(60±5)%,12 h光照和黑暗循环,自由进食及进水。
2 方法
2.1 BHC给药溶液及对照品溶液的制备
精密称取BHC粉末适量,以0.5%的羧甲基纤维素钠溶液混悬制成质量浓度为0.378 g/mL的混悬液。分别精密称取各对照品适量,甲醇溶解并定容,分别制成没食子酸、芍药苷、氧化芍药苷、没食子酰芍药苷、芍药内酯苷、毛蕊异黄酮、芒柄花素、新补骨脂异黄酮、补骨脂宁、3-羟基-9,10-二甲氧基紫檀烷、()-异补骨脂二氢黄酮、补骨脂甲素、补骨脂苷、补骨脂素、异补骨脂苷、异补骨脂素、黄芪甲苷为2.143、1.452、1.562、1.937、1.748、1.194、1.375、1.465、1.356、1.160、2.047、1.503、1.382、2.405、2.156、2.366、1.794mg/mL的对照品溶液。
2.2 动物分组及给药
雄性SD大鼠18只,随机分为空白组、血浆组、胆汁组、尿液/粪便组;空白组分为血浆空白组、胆汁空白组、尿液/粪便空白组,每组3只,共9只。其余各组均为给药组,每组3只。空白组给予等体积0.5%的羧甲基纤维素钠溶液,其余各组ig BHC 3.78 g/kg,连续给药3 d。
2.3 生物样品的采集
大鼠末次给药前禁食12 h,自由饮水。血浆组大鼠,于给药后0.5、1、2、4、6、8、10 h经眼眶静脉丛分别取血300 μL,分别置于预先涂有1%肝素钠的EP管中,4000 r/min离心10 min,取上清,即得各时间点血浆样品;胆汁组大鼠麻醉后,做胆管插管手术,收集10 h内胆汁。尿液/粪便组大鼠置于代谢笼中,分别收集36 h内尿液、粪便样品,每6 小时收集1次。3个空白组大鼠,分别同法收集血浆样品、胆汁样品、尿液及粪便样品。于−80 ℃冰箱保存备用。
2.4 生物样品预处理
参考文献中生物样品的处理方式进行样品预处理[14-15]。取血浆组3只大鼠各时间点血浆样品各50 μL,等量混合(共21个样品),涡旋30 s,取混匀后的血浆样品500 μL,加入3倍体积的乙腈,涡旋30 s,离心(13 000 r/min、10 min、4 ℃),取上清,37 ℃离心浓缩至干,以100 μL 50%甲醇复溶,离心(13 000 r/min、10 min、4 ℃)取上清,即得含药血浆样品溶液;空白血浆样品溶液处理方法同含药血浆样品溶液;取胆汁组3只大鼠胆汁样品300 μL,等量混合,涡旋30 s,取混匀后的胆汁样品500 μL,加入500 μL乙腈沉淀蛋白,其余操作同血浆样品,即得含药胆汁样品溶液;空白胆汁样品溶液处理方法同含药胆汁样品溶液;取尿液组3只大鼠各时间点尿液样品50 μL,等量混合(共18个样品),涡旋30 s,取混匀后的尿液样品500 μL,加入500 μL乙腈沉淀蛋白,其余操作同血浆样品,即得含药尿液样品溶液;空白尿液样品溶液处理方法同含药尿液样品溶液;取粪便组3只大鼠各时间点粪便样品适量,等量混合(共18个样品),取混匀后的粪便样品1.0 g,加入50%甲醇300 μL,超声30 min,离心(13 000 r/min、10 min、4 ℃),取上清液200 μL,加入200 μL甲醇,涡旋混匀,再次离心(13 000 r/min、10 min、4 ℃),取上清即得含药粪便样品溶液;空白粪便样品溶液处理方法同含药粪便样品溶液。
2.5 色谱和质谱条件
2.5.1 色谱条件 采用ACQUITYTMUPLC BEH T3色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱:0~5 min,0~12% A;5~7 min,12% A;7~12 min,12%~30% A;12~15 min,30%~45% A;15~18 min,45%~85% A;18~20 min,85%~0 A,柱温35 ℃;体积流量0.4 mL/min,进样量4 μL。
2.5.2 质谱条件 采用电喷雾离子源(ESI),正、负离子模式分别扫描;锥孔电压40 V;毛细管电压4 kV;脱溶剂气温度400 ℃;离子源温度150 ℃;脱溶剂气体积流量500 L/h;锥孔气体积流量50 L/h;MS、MS/MS碰撞能量10~40 eV;质量扫描范围/100~1000;以亮氨酸-脑啡肽进行精准质量实时校正,锁校质荷比分别为556.277 1(ESI+)和554.261 5(ESI−)。
2.6 数据处理
采用MassLynx 4.2质谱控制平台,在MSE模式下采集分析样本总离子流图,分析各色谱峰的质谱数据,目标物筛选采用MetaboLynx XS数据处理软件及质量亏损过滤技术,扣除空白生物样品后,通过对比各成分对照品的保留时间及一级、二级特征离子碎片,参考相关文献中特征离子碎片信息,推测各成分代谢产物结构及分子式。基本参数设置为分析时间1~20 min,质量亏损过滤范围±5×104。
3 结果
3.1 大鼠血浆、胆汁、尿液、粪便UPLC-Q-TOF-MS分析
通过参考文献中BHC提取液原型成分的质谱信息[8],比较给药后大鼠血浆、胆汁、尿液、粪便样品和空白样品的色谱图,扣除生物样品中的内源性成分,分析发现样品中含有原型成分及代谢产物67个,包括10个酚酸类、7个单萜苷类、35个黄酮类、12个香豆素类、3个皂苷类成分。各含药样品正、负离子模式下总提取离子流图见图1。
3.2 酚酸类成分代谢产物鉴定及代谢途径分析
结果显示,给药大鼠体内共检测到酚酸类原型成分及代谢产物10个,见表1,具体代谢途径见图2。没食子酸为赤芍中含有的酚酸类成分,本实验以没食子酸为例阐述该类成分的代谢规律[16]。A0为ESI−模式下得到/169的离子峰(R=3.2 min),文献报道赤芍中的没食子酸相对分子质量为170[17],推测169.014 3为其加氢准分子离子峰,脱去羧基产生质谱碎片/125.023 8 [M-H-COO]−,其保留时间及质谱与没食子酸对照品相一致,确定该化合物为没食子酸。A1(R=4.6 min)与没食子酸相差14(CH2),存在与没食子酸相同的碎片/125,并脱去1个氧产生/167.033 4的碎片,推测为甲基化的没食子酸。A1、A2均为没食子酸甲基化的产物,但没食子酸有3个酚羟基,无法确定甲基结合的具体位置。A5(R=8.8 min)比没食子酸小48(3O),分子式为C7H6O2,质谱碎片/119.045 3 [M-H-2H]−,推测为没食子酸脱去3个O、A4脱去1个O生成的苯甲酸。A7准分子离子峰/373.074 7 [M-H]−,脱去甲基产生质谱碎片/359.060 2 [M-H-CH2]−,产生与A2相同的碎片/197.044 6 [M-H-C6H8O6]−,比没食子酸大204(C6H8O6+2CH2)、比A2大176(C6H8O6),根据元素组成分析,该化合物分子式为C15H18O11,准分子离子峰理论值为373.076 2,实测值为373.074 7,据此推测A7为没食子酸2次甲基化后葡萄糖醛酸结合的产物。上述实验结果显示,没食子酸主要发生甲基化、脱氧、脱羧基、葡糖醛酸结合、硫酸结合等反应,原型及代谢产物在尿液中均可检测到,胆汁中以没食子酸甲基化和没食子酸硫酸结合产物为主,血浆及粪便样品中检测到的代谢产物种类较少。

图1 大鼠空白及含药血浆、胆汁、尿液、粪便样品原型化合物及其代谢产物总提取离子流图

表1 大鼠 igBHC后血浆、胆汁、尿液、粪便中原型成分及代谢产物
续表1
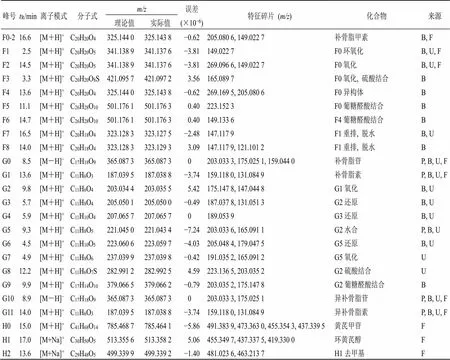
峰号tR/min离子模式分子式m/z误差(×10−6)特征碎片(m/z)化合物来源 理论值实际值 F0-216.6[M+H]+C20H20O4325.144 0325.143 8−0.62205.080 6, 149.022 7补骨脂甲素B, F F12.5[M+H]+C20H20O5341.138 9341.137 6−3.81149.022 7F0环氧化B, U, F F214.5[M+H]+C20H20O5341.138 9341.137 6−3.81269.096 6, 149.022 7F0氧化B, U, F F33.3[M+H]+C20H20O8S421.095 7421.097 23.56165.089 7F0氧化, 硫酸结合B F413.6[M+H]+C20H20O4325.144 0325.143 8−0.62269.169 5, 205.080 6 F0异构体B F511.1[M+H]+C26H28O10501.176 1501.176 30.40223.152 3F0葡糖醛酸结合B F614.7[M+H]+C26H28O10501.176 1501.176 30.40149.133 6F4葡糖醛酸结合B F716.5[M+H]+C20H18O4323.128 3323.127 5−2.48147.117 9F1重排, 脱水B, U F814.0[M+H]+C20H18O4323.128 3323.129 33.09147.117 9, 121.101 2F1重排, 脱水B G08.5[M-H]−C17H18O9365.087 3365.087 30.00203.033 3, 175.025 1, 159.044 0补骨脂苷P, B, U, F G113.6[M+H]+C11H6O3187.039 5187.038 8−3.74159.118 0, 131.084 9补骨脂素P, B, U, F G29.8[M+H]+C11H6O4203.034 4203.035 55.42175.147 8, 147.044 8G1氧化B, U G35.7[M+H]+C11H8O4205.050 1205.050 0−0.49187.037 8, 131.051 3G2还原B, U G45.9[M+H]+C11H10O4207.065 7207.065 70.00189.053 9G3还原B, U G59.3[M+H]+C11H8O5221.045 0221.043 4−7.24203.033 6, 165.091 1G2水合P, B, U G64.5[M+H]+C11H10O5223.060 6223.059 7−4.03205.048 4, 179.047 5G5还原B, U G74.9[M+H]+C11H8O6237.039 9237.039 8−0.42191.035 2, 165.091 2G5氧化U G812.2[M+H]+C11H6O7S282.991 2282.992 54.59223.136 5, 203.035 2G2硫酸结合U G99.9[M+H]+C17H14O10379.066 5379.066 2−0.79203.035 2, 175.147 8G2葡糖醛酸结合B G108.9[M-H]−C17H18O9365.087 3365.087 30.00203.033 3, 175.025 1异补骨脂苷P, B, U, F G1114.0[M+H]+C11H6O3187.039 5187.038 8−3.74159.118 0, 131.084 9异补骨脂素P, B, U, F H015.0[M+H]+C41H68O14785.468 7785.464 1−5.86491.383 9, 473.363 0, 455.354 3, 437.339 5黄芪甲苷F H117.0[M+Na]+C30H50O5513.355 6513.358 25.06455.349 7, 437.337 5, 419.330 0环黄芪醇F H213.6[M+Na]+C29H48O5499.339 9499.339 2−1.40481.023 6, 463.213 7H1去甲基F
P-血浆 B-胆汁 U-尿液 F-粪便
P-plasma B-bile U-urine F-feces
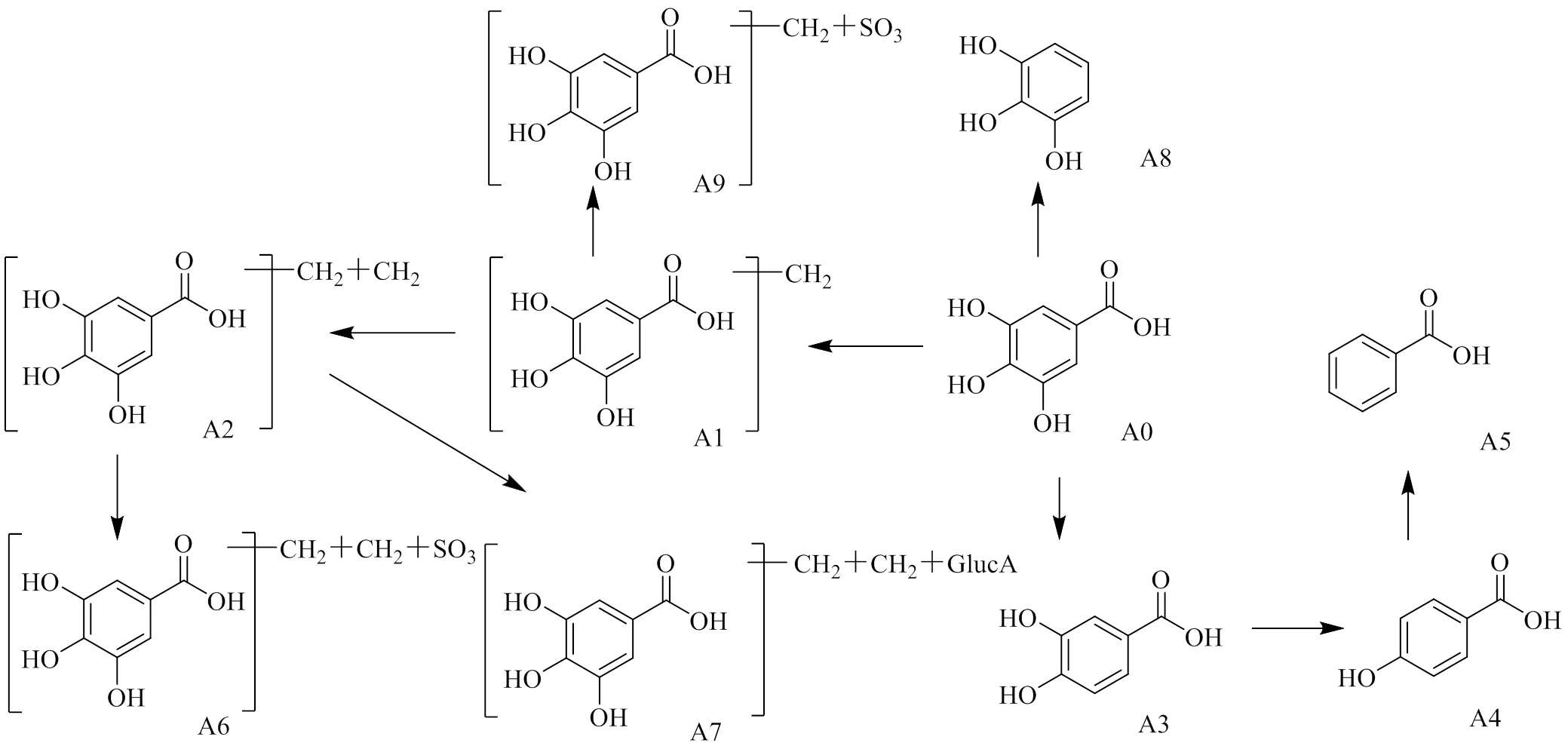
图2 酚酸类成分体内代谢途径
3.3 单萜类成分代谢产物鉴定及代谢途径分析
BHC中单萜类成分主要包括芍药苷和芍药内酯苷等,本实验共检测到单萜类原型成分及代谢产物7个,见表1,具体代谢途径见图3。B0为ESI−模式下得到/479.155 9的离子峰(R=8.8 min,文献报道赤芍中的芍药苷相对分子质量为480[17],推测/479.155 9为该化合物准分子离子峰,C-O键断裂产生碎片/357.117 6 [M-H-C7H6O2]−及121.029 2 [C7H5O2]−,其保留时间和质谱行为与芍药苷对照品相一致,确定该化合物为芍药苷。B1为ESI−模式下得到/495.150 2的离子峰(R=6.1 min),B1较芍药苷多16,文献报道[17]赤芍中存在的氧化芍药苷相对分子质量为496,推测/495.150 2为氧化芍药苷的准分子离子峰,存在质谱碎片/333.090 3 [M-H-C6H10O5]−,其保留时间和质谱与芍药苷对照品一致,确定该化合物为氧化芍药苷。B2为ESI−模式下检测到/631.164 9的离子峰(R=10.4 min),文献报道[17]赤芍中存在的没食子酰芍药苷相对分子质量为632,比芍药苷多152(C7H4O4),推测/631.164 9为没食子酰芍药苷的准分子离子峰,存在脱水产生的碎片/613.158 8 [M-H-H2O]−,并且存在与芍药苷准分子离子峰相同的碎片/479,其保留时间和质谱与没食子酰芍药苷对照品相一致,确定该化合物为没食子酰芍药苷。B6为ESI−模式下得到/479.155 9的离子峰(R=8.1 min),与芍药苷保留时间相近,质谱碎片/357.117 6 [M-H-C7H6O2]−和121.028 5 [C7H5O2]−与芍药苷相同,保留时间和质谱与芍药内酯苷对照品相一致,据此确定该化合物为芍药苷的同分异构体芍药内酯苷。芍药苷在大鼠体内代谢产物较少,主要发生氧化、甲基结合反应,且大多经粪便代谢,推测与其生物利用度较低有关。
3.4 黄酮类成分代谢产物鉴定及代谢途径分析
黄芪和补骨脂中含有多种黄酮类成分,如毛蕊异黄酮、芒柄花素、新补骨脂异黄酮、补骨脂甲素等。黄酮类成分极性普遍较小,因此在生物体内多以硫酸、葡糖醛酸等结合产物的形式存在,增大极性以利于排出体外[18]。黄酮类成分易发生逆狄尔斯-阿德尔(retro diels-alder reaction,RDA)裂解。本实验检测到毛蕊异黄酮、()-异补骨脂二氢黄酮、补骨脂甲素、新补骨脂异黄酮等成分,发生氧化、还原、脱羟基、脱水、环氧化、葡糖醛酸结合、硫酸结合反应。各样品中代谢产物不同,原型成分及代谢产物共检测到35个,见表1,具体代谢途径见图4~6。
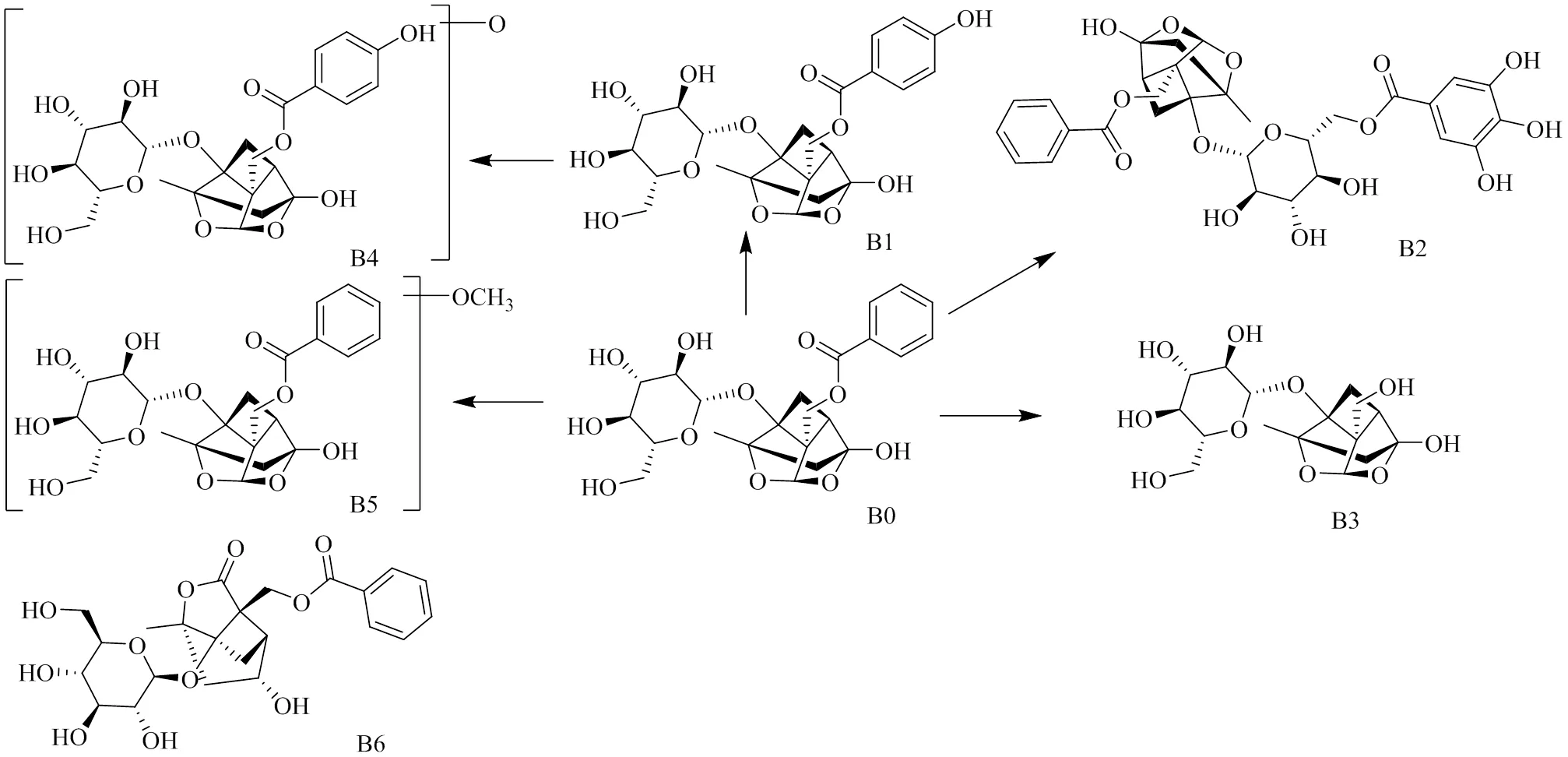
图3 芍药苷体内代谢途径

图4 毛蕊异黄酮体内代谢途径

图5 新补骨脂异黄酮和3-羟基-9,10-二甲氧基紫檀烷体内代谢途径
本实验以毛蕊异黄酮和()-异补骨脂二氢黄酮为例,分别阐释异黄酮类与二氢黄酮类成分的代谢规律。C0为ESI+模式下得到/285的离子峰(R=13.1 min),文献报道黄芪中的毛蕊异黄酮相对分子质量为284,推测/285.074 3为毛蕊异黄酮的准分子离子峰,存在质谱碎片/270.051 6 [M+H-CH3]+、253.052 0 [M+H-CH3OH]+、225.050 6 [M+H-CH3OH-OH]+、149.060 9 [M+H-C7H4O3]+、137.024 2 [M+H-C9H8O2]+,保留时间和质谱与毛蕊异黄酮对照品信息相一致,确定该化合物为毛蕊异黄酮。C1为ESI+模式下得到/269的离子峰(R=15.3 min),文献报道[18]黄芪中的芒柄花素相对分子质量为268,推测/269.082 6为芒柄花素的准分子离子峰,C1比毛蕊异黄酮小16,表明C1可能为毛蕊异黄酮脱氧的代谢产物,存在质谱碎片251.169 8 [M+H-H2O]+、225.112 6 [M+H-CH4-CO]+、133.102 4 [M+H-C7H4O3]+,保留时间和质谱行为与芒柄花素对照品信息相一致,确定该化合物为毛蕊异黄酮脱氧生成的芒柄花素。C2为ESI+模式下得到/255的离子峰(R=12.6 min),文献报道[18]黄芪中的大豆苷元相对分子质量为254,推测/255.067 7为其准分子离子峰,C2比毛蕊异黄酮少30(OCH2),存在237.170 1 [M+H-H2O]+、209.138 3 [M+H-H2O-CO]+等质谱碎片,根据元素组成分析,该化合物分子式为C15H10O4,准分子离子峰理论值为255.065 7,实测值为255.067 7,据此推测C2为毛蕊异黄酮脱去甲氧基生成的大豆苷元。D0为ESI+模式下得到/321的离子峰(R=16.4 min),文献报道补骨脂中的新补骨脂异黄酮相对分子质量为322,推测/321.112 9为新补骨脂异黄酮的准分子离子峰,存在质谱碎片/279.230 2 [M-H-C3H6]−、265.146 6 [M-H-C4H8]−,保留时间和质谱与新补骨脂异黄酮对照品信息相一致,确定D0为新补骨脂异黄酮。
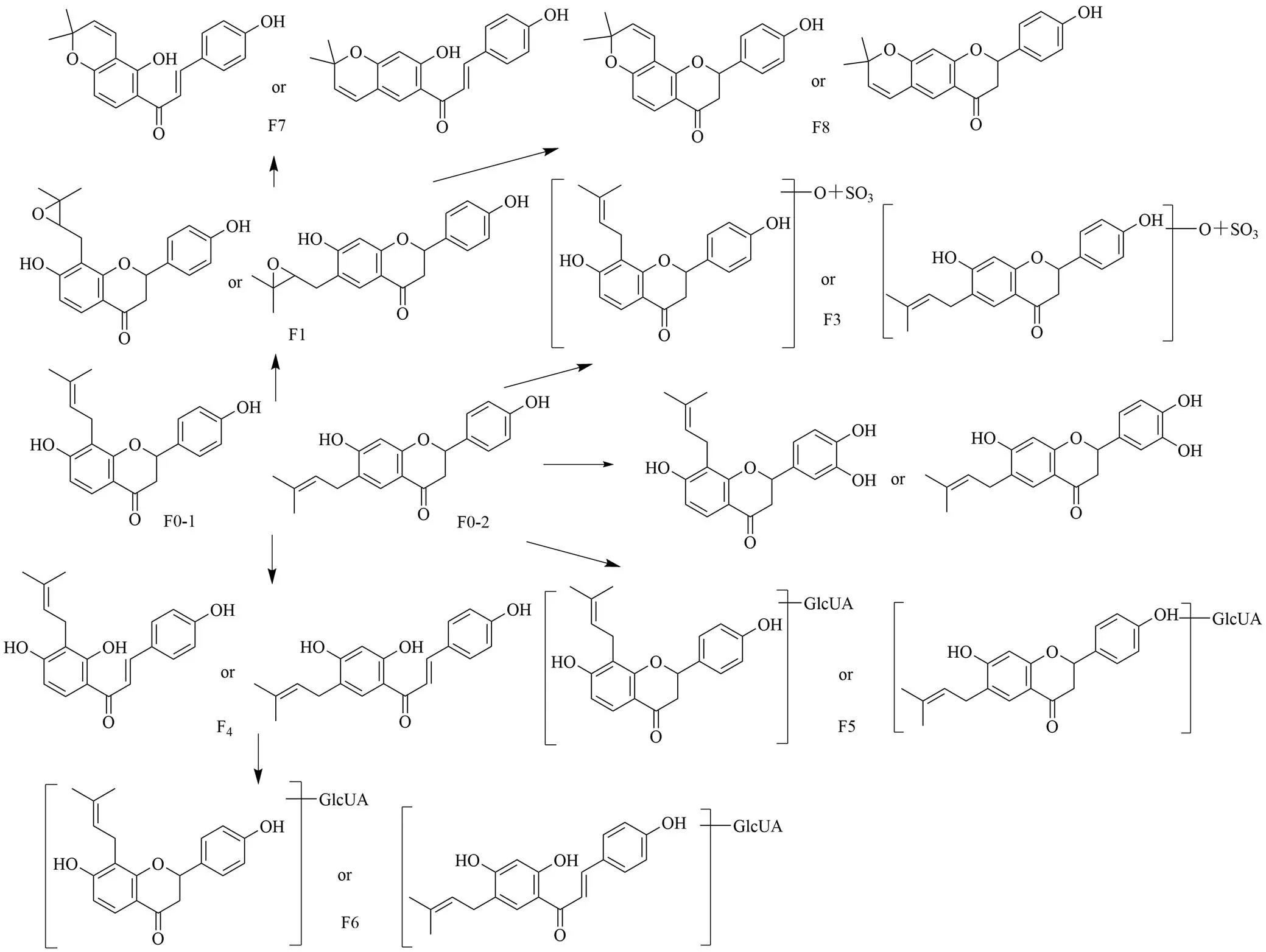
图6 (S)-异补骨脂二氢黄酮和补骨脂甲素体内代谢途径
F0-1(R=16.1 min)和F0-2(R=16.6 min)均存在325、205的离子峰,文献报道补骨脂中的()-异补骨脂二氢黄酮和补骨脂甲素相对分子质量均为324,推测/325.143 8 [M+H]+为其准分子离子峰,存在经RDA裂解产生的碎片/205 [M+ H-C8H8O]+,其保留时间及质谱与()-异补骨脂二氢黄酮和补骨脂甲素对照品相一致,确定F0-1和F0-2分别为()-异补骨脂二氢黄酮和补骨脂甲素,前者取代基在C-8位,后者取代基在C-6位,二者仅取代基位置不同,因此在体内的代谢途径较为相似,均可发生氧化、环氧化、硫酸结合等反应。
3.5 香豆素类成分代谢产物鉴定及代谢途径分析
补骨脂中含有的香豆素类成分补骨脂素及异补骨脂素是补骨脂药材的质量控制成分[1]。该类原型成分及代谢产物共在大鼠体内检测到12个,见表1,具体代谢途径见图7。其中,G0为ESI−模式下得到/365的离子峰(R=8.5 min),文献报道[19]补骨脂中补骨脂苷的相对分子质量为366,推测/365.087 3为其准分子离子峰,存在碎片/203.033 3 [M-H-C6H10O5]−、175.025 1 [M-H-C6H10O5-CO]−、159.044 0 [M-H-C6H10O5-CO2]−,根据元素组成分析,该化合物分子式为C17H18O9,准分子离子峰理论值为365.087 3,实测值也为365.087 3,且保留时间和质谱与补骨脂苷对照品一致,确定该化合物为补骨脂苷。苷类成分在体内酶的作用下会脱去糖苷转化为苷元。G1为ESI+模式下得到/187的离子峰(R=13.6 min),文献报道补骨脂中补骨脂素的相对分子质量为186,推测/187.038 8为其准分子离子峰,G1比补骨脂苷少180(C6H12O6),同样存在/159的质谱碎片,推测G1为补骨脂苷脱糖基后的苷元,其保留时间和质谱与补骨脂素对照品一致,确定该化合物为补骨脂素。补骨脂中香豆素类成分补骨脂苷、异补骨脂苷在体内存在转化现象[20-21],但由于其含量较高,补骨脂苷、异补骨脂苷及其苷元原型在血浆、胆汁、尿液及粪便样品中均可检测到。补骨脂苷在体内主要发生脱糖反应,其苷元补骨脂素可发生氧化、还原、硫酸结合、葡糖醛酸结合等反应。
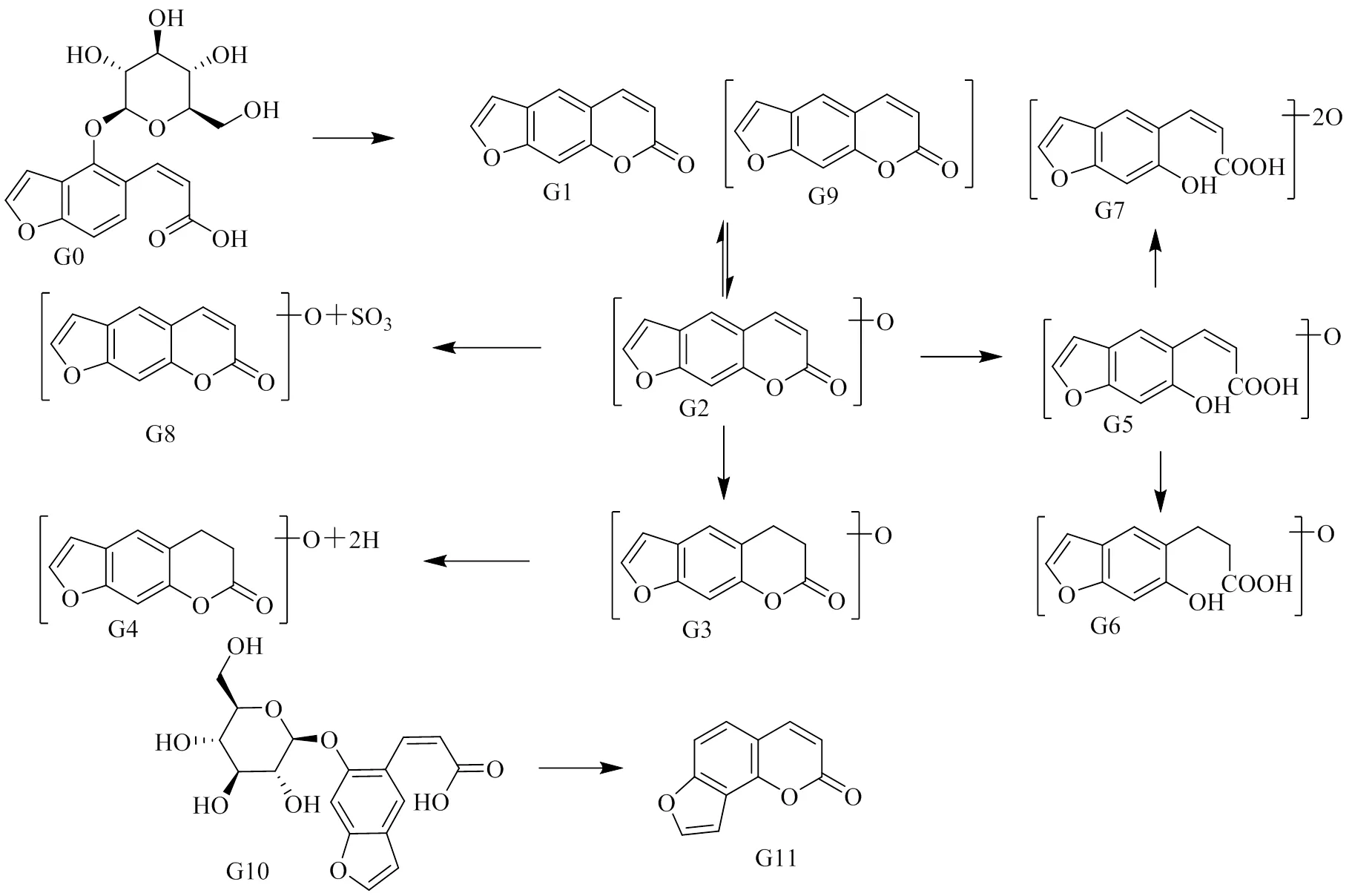
图7 香豆素类成分体内代谢途径
3.6 皂苷类成分代谢产物鉴定及代谢途径分析
黄芪皂苷类成分是黄芪药材及饮片的质量控制成分。本实验中H0为ESI+模式下得到/785的离子峰(R=15.0 min),文献报道黄芪中黄芪甲苷的相对分子质量为784[22],推测/785.464 1为其准分子离子峰,存在碎片491.383 9 [M+H-C6H10O5-C5H8O4]+、473.363 0 [M+H-C6H10O5-C5H8O4-H2O]+、455.354 3 [M+H-C6H10O5-C5H8O4-2H2O]+、437.339 5 [M+H-C6H10O5-C5H8O4-3H2O]+、419.331 8 [M+H-C6H10O5-C5H8O4-4H2O]+,其保留时间及质谱与黄芪甲苷对照品一致,据此确定H0为黄芪甲苷。H1为ESI+模式下得到/513的离子峰(R=17.0 min),文献报道黄芪中环黄芪醇相对分子质量为490,推测/513.358 2为其加钠准分子离子峰,存在碎片455.349 7 [M+H-H2O]+、437.337 5 [M+H-2H2O]+、419.330 0 [M+H-3H2O]+,根据元素组成分析,该化合物分子式为C30H50O5,准分子离子峰理论值为513.355 6,实测值为513.358 2,据此推测该化合物为环黄芪醇,见表1,代谢途径见图8。
4 讨论
BHC体外化学物质分析结果显示,其主要含有黄酮类、单萜类、酚酸类、香豆素类、皂苷类等成分[8]。本实验采用UPLC-Q-TOF-MS技术,在正、负离子模式下,分别检测连续3 d ig BHC后大鼠血浆、胆汁、尿液、粪便样品中原型成分及其代谢产物。结果显示,BHC含有的上述5种类型成分在大鼠体内多可检测到其原型或代谢产物,如黄芪中的黄酮类及皂苷类成分、赤芍中的酚酸类及单萜类成分、补骨脂中的黄酮类及香豆素类成分。与体外物质相比,体内原型成分数量相对较少,但代谢产物及途径丰富。共鉴定原型成分及其代谢产物67个,其中来源于黄芪18个、赤芍17个、补骨脂32个,其代谢途径包括氧化、还原、甲基化、葡糖醛酸结合、硫酸结合等I相及II相代谢反应。

图8 黄芪甲苷体内代谢途径
已有研究表明,酚酸类成分在机体内主要以II相结合形式被代谢,亦有部分首先发生I相代谢,在I相转化的基础上进一步进行II相结合反应[23]。有研究显示ig没食子酸后,没食子酸代谢物3--甲基没食子酸和4--甲基没食子酸为血中主要成分,且原型和代谢物主要经尿液和粪便排泄[24]。本实验中没食子酸主要代谢途径为甲基化、硫酸结合等II相反应,与文献报道一致。
芍药苷等单萜类成分是赤芍药材中的主要活性成分,具有良好的抗炎、免疫调节、抗抑郁、抑制肺纤维化作用[25-28]。研究表明,芍药苷和芍药内酯苷在大鼠血浆和人血浆中蛋白结合率较高,提示血浆中游离药物浓度较低[29],且在体内主要以I相代谢为主,生成单氧化、双氧化、甲基化、去苯甲酰基的代谢产物,该报道与本实验结果一致。
毛蕊异黄酮苷在黄芪药材中含量较高[30],前期药动学实验结果显示其吸收入血的浓度较低,消除速率较快[12]。也有文献报道,黄芪药材中毛蕊异黄酮苷和毛蕊异黄酮口服生物利用度均较低[31],推测毛蕊异黄酮苷主要以其代谢产物形式在体内发挥药效。本实验各生物样品中均未检测到毛蕊异黄酮苷原型成分,但其代谢产物种类丰富,在尿液和粪便中检测到其脱糖基化产物毛蕊异黄酮,进而生成脱氧、去甲基化、葡糖醛酸结合、硫酸结合等代谢物,为该推论提供佐证。此外,各生物样品中也未检测到芒柄花苷,但其代谢产物芒柄花素广泛存在于胆汁、尿液和粪便中,推测芒柄花苷消除速率较快,导致其主要以代谢产物形式存在于体内。补骨脂药材中黄酮类成分种类较多,本实验中其葡糖醛酸结合产物大多经胆汁排泄,推测代谢产物含量较高时可能会引起肠-肝循环,延长原型化合物在体内的循环时间,进而提高其生物利用度。
补骨脂中香豆素类原型成分补骨脂苷、补骨脂素、异补骨脂苷、异补骨脂素在大鼠血浆、胆汁、尿液及粪便样品中均可检测到。前期药动学研究[12]显示补骨脂苷、异补骨脂苷等成分在体内半衰期较长,因此本实验设计连续ig 3 d,检测样品中代谢产物生成情况,可有效避免因半衰期较长导致代谢不充分的情况。有文献报道香豆素类成分的代谢主要在肝脏内进行,发生氧化、脱氢、脱甲基、内酯环开环等I相代谢反应,随后进行II相代谢生成硫酸结合、葡糖醛酸结合等产物,代谢物大多经胆汁及尿液排出[32],与本实验结果一致。
黄芪皂苷类成分是黄芪药材多种药理活性的物质基础[33-35],但其生物利用度低的问题一直广受关注。前期对BHC入血成分的药动学研究中未检测到黄芪皂苷类成分。本实验中仅检测到黄芪甲苷、环黄芪醇及去甲基产物,且仅存在于粪便样品中,表明皂苷类成分吸收入血情况较差,大多经粪便排出体外,推测黄芪中皂苷类成分可能参与了机体肠道菌群的结构调节,也可能在肠道菌群的作用下发生生物转化反应。
目前对于BHC药动学研究主要聚集于其原型成分[12,36-37],这也是多数中药成分体内代谢研究的共性问题。原型成分因溶解度低、首过效应、酶降解或肠腔降解等因素代谢为其他成分,导致原型成分生物利用度低,多数以代谢物的形式在体内发挥药效。因此,只研究原型成分在体内的代谢规律较为片面,应加强对中药成分中代谢产物的鉴定分析,并进一步针对代谢产物进行药动学研究,以实现全面评价各成分在体内的代谢规律,为阐明中药功效物质基础提供支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 1072.
[2] 侯双双, 孙世超, 林大伟. 补肺活血胶囊联合西药常规治疗职业性尘肺病的临床疗效观察 [J]. 中国临床医生杂志, 2020, 48(9): 1117-1119.
[3] 孟泳, 贺启萌, 任璐瑶. 补肺活血胶囊治疗特发性肺纤维化的临床研究 [J]. 中国临床医生杂志, 2020, 48(8): 995-997.
[4] 陈秋伶, 吴明亚, 邹文萍, 等. 补肺活血胶囊联合孟鲁司特钠治疗慢性阻塞性肺疾病稳定期的临床研究[J]. 现代药物与临床, 2019, 34(7): 2054-2057.
[5] 郭盛, 武文星, 谢红, 等. 基于网络药理学与分子对接技术的补肺活血胶囊用于新型冠状病毒肺炎(COVID-19) 恢复期治疗的分子机制研究 [J]. 中草药, 2020, 51(9): 2307-2316.
[6] Chen Y Q, He W J, Lu W J,. Bufei Huoxue Capsules in the management of convalescent COVID-19 infection: Study protocol for a multicenter, double-blind, and randomized controlled trial [J]., 2021, 11(3): 20458940211032125.
[7] Chen Y Q, Liu C L, Wang T P,. Efficacy and safety of Bufei Huoxue Capsules in the management of convalescent patients with COVID-19 infection: A multicentre, double-blind, and randomised controlled trial [J]., 2022, 284: 114830.
[8] 唐清, 郑玉莹, 关敏怡, 等. 基于UFLC-Triple TOF MS/MS技术的补肺活血胶囊化学物质基础研究 [J]. 中南药学, 2018, 16(12): 1677-1683.
[9] 唐清, 朱晓枭, 郑玉莹, 等. 补肺活血胶囊高效液相色谱指纹图谱研究 [J]. 中南药学, 2018, 16(9): 1200-1204.
[10] 舒婷, 黄湘杰. 补肺活血胶囊高效液相色谱特征指纹图谱研究及多成分含量测定 [J]. 中国药业, 2019, 28(23): 19-23.
[11] 史良恬, 晏军, 孟玉凤, 等. 补肺活血胶囊对慢性阻塞性肺疾病模型大鼠气道重塑的干预作用及机制研究 [J]. 安徽中医药大学学报, 2022, 41(1): 59-65.
[12] 任慧, 郭盛, 张祎盈, 等. UHPLC-MS/MS测定补肺活血胶囊中8种有效成分在大鼠体内血药浓度及药代动力学研究 [J]. 中国中药杂志, 2022, 47(1): 215-223.
[13] 钟大放. 药物代谢与药物动力学基础研究展望 [J]. 辽宁药物与临床, 2000, 3(4): 145-148.
[14] 戴国梁, 居文政, 谈恒山. 生物样品前处理研究进展 [J]. 中国医院药学杂志, 2013, 33(6): 484-487.
[15] 黄楷迪, 朱西杰, 牛阳, 等. 复方蜥蜴散大鼠血浆、尿液、胆汁、粪便中代谢产物的鉴定 [J]. 中草药, 2022, 53(3): 678-686.
[16] 丁雯, 钱大玮, 段金廒, 等. 当归赤芍药对中阿魏酸和没食子酸在大鼠血浆和尿液中的代谢物研究 [J]. 中国中药杂志, 2012, 37(3): 366-372.
[17] 刘杰, 陈琳, 范彩荣, 等. 基于HPLC-DAD-Q-TOF- MS/MS的白芍和赤芍主要成分定性定量研究 [J]. 中国中药杂志, 2015, 40(9): 1762-1770.
[18] Huang J, Chen H Y, Li C Y,. Screening and identification of the metabolites of water extracts of raw and honey-processedin rat urine based on UHPLC/ESI-Q-TOF-MS and multivariate statistical analysis [J]., 2018, 29(9): 1919-1935.
[19] Wang P L, Yao Z H, Zhang F X,. Identification of metabolites ofin rats by ultra performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry analysis [J]., 2015, 112: 23-35.
[20] Wang Y F, Liu Y N, Xiong W,. A UPLC-MS/MS method forandpharmacokinetic studies of psoralenoside, isopsoralenoside, psoralen and isopsoralen fromextract [J]., 2014, 151(1): 609-617.
[21] 武文星, 郭盛, 尚尔鑫, 等. 基于数据挖掘的补骨脂药用源流及其配伍用药特点分析[J]. 世界中医药, 2022, 17(10): 1405-1414.
[22] 许如玲, 范君婷, 董惠敏, 等. 经典名方黄芪桂枝五物汤标准煎液化学成分的UPLC-Q-TOF-MS分析 [J]. 中国中药杂志, 2020, 45(23): 5614-5630.
[23] 孙慧园, 覃小丽, 梅朝叶, 等. 头花蓼有效组分中没食子酸、原儿茶酸在模式生物斑马鱼中的代谢研究 [J]. 中国药理学通报, 2017, 33(3): 388-393.
[24] 鲁郡兰. 连花清瘟胶囊中大黄成分的药代动力学研究 [D]. 天津: 天津中医药大学, 2021.
[25] Zhang L L, Wei W. Anti-inflammatory and immunoregulatoryeffects of paeoniflorin and total glucosides of paeony [J]., 2020, 207: 107452.
[26] Zhou Y X, Gong X H, Zhang H,. A review on the pharmacokinetics of paeoniflorin and its anti- inflammatory and immunomodulatory effects [J]., 2020, 130: 110505.
[27] Cheng J, Chen M, Wan H Q,. Paeoniflorin exerts antidepressant-like effects through enhancing neuronal FGF-2 by microglial inactivation [J]., 2021, 274: 114046.
[28] Wang X L, Feng S T, Wang Y T,. Paeoniflorin: A neuroprotective monoterpenoid glycoside with promising anti-depressive properties [J]., 2021, 90: 153669.
[29] 谢敏, 刘敏彦, 王玉峰, 等. 白芍总苷在CCl4肝损伤大鼠和正常大鼠血浆中蛋白结合率的比较 [J]. 中药药理与临床, 2011, 27(5): 59-62.
[30] Liu Y, Liu J, Wang Y,. Simultaneous determination of six active metabolites in(Fisch.) Bge. under salt stress by ultra-pressure liquid chromatography with tandem mass spectrometry [J]., 2016, 5(1): 927.
[31] Tian X T, Chen S J, Zhang Y Y,. Absorption, liver first-pass effect, pharmacokinetics and tissue distribution of calycosin-7--β--glucopyranoside (C7G) and its major active metabolite, calycosin, following oral administration of C7G in rats by LC-MS/MS [J]., 2018, 148: 350-354.
[32] 雷震, 马卫东, 於凯芹, 等. 香豆素类化合物的体内代谢研究进展 [J]. 中国药业, 2016, 25(23): 5-8.
[33] Xia M L, Xie X H, Ding J H,. Astragaloside IV inhibits astrocyte senescence: Implication in Parkinson’s disease [J]., 2020, 17(1): 105.
[34] Zang Y B, Wan J J, Zhang Z,. An updated role of astragaloside IV in heart failure [J]., 2020, 126: 110012.
[35] 陈品良, 陈汉裕, 陈梓欣, 等. 基于网络药理学探讨黄芪治疗病毒性心肌炎的作用机制[J]. 世界中医药, 2021, 16(23): 3491-3495.
[36] Men W J, Cheng L Y, Chen M Y,. Study on pharmacokinetics of eight active compounds from Bufei-Huoxue Capsule based on UHPLC-MS/MS [J]., 2021, 1184: 122974.
[37] 李全, 任慧, 郭盛, 等. UHPLC法分析补肺活血胶囊中12种指标成分[J]. 中草药, 2022, 53(13): 3991-3996.
Metabolite identification and metabolic pathway analysis of Bufei Huoxue Capsules in rats
REN Hui1, GUO Sheng1, ZHANG Yi-ying1, LI Quan2, WANG Heng-bin2, GENG Wan-li3,QIAN Da-wei1, DUAN Jin-ao1
1. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, and Jiangsu Key Laboratory for High Technology Research of Traditional Chinese Medicine Formulae, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Leiyunshang Pharmaceutical Co., Ltd., Suzhou 215003, China 3. Guangdong Leiyunshang Pharmaceutical Co., Ltd., Yunfu 527300, China
To study the prototype components and metabolites of Bufei Huoxue Capsules (补肺活血胶囊, BHC) in plasma, bile, urine and feces of rats, and summarize the metabolic rules of different types of compounds.After ig BHC, the plasma, bile, urine and feces samples of rats were collected and pretreated. The prototype components and metabolites were analyzed and identified in positive and negative ion modes by ultra-high performance liquid chromatography-time-of-flight mass spectrometry (UPLC-Q-TOF-MS) with mass loss filtration techniques.A total of 67 prototypes and metabolites were detected, such as gallic acid, paeoniflorin, calycosin, neobavaisoflavone, isobavachin and psoralenoside, etc. Among them, there were 10 phenolic acids, seven monoterpenes, 35 flavonoids, 12 coumarins and three saponins. The main metabolic pathways included oxidation, reduction, methylation, glucuronic acid binding, sulfuric acid binding and so on.This study preliminarily clarified the metabolites and transformation characteristics of BHC in rats, which laid a foundation for revealing its pharmacodynamic substance basis based onprocess, and provided a scientific basis for its safe clinical use.
Bufei Huoxue Capsules; metabolite identification; metabolic pathway analysis; UPLC-Q-TOF-MS; gallic acid; paeoniflorin; calycosin; neobavaisoflavone; isobavachin; psoralenoside; astragaloside IV
R284.1
A
0253 - 2670(2023)04 - 1051 - 13
10.7501/j.issn.0253-2670.2023.04.005
2022-06-20
国家自然科学基金项目(81873189);江苏省高校自然科学研究重大项目(18KJA360006);江苏省“六大人才”高峰项目(YY-026);江苏省研究生科研与实践创新计划项目(KYCX21_1728)
任 慧,硕士研究生,研究方向为中药分析与生物药剂学。E-mail: rh_whale@163.com
郭 盛,副研究员,从事中药资源化学与功效物质基础研究。E-mail: guosheng@njucm.edu.cn
[责任编辑 王文倩]
