二咖啡酰奎宁酸类天然产物植物来源、药动学及生物活性的研究进展
2023-02-21韩亚如马国力韩亚龙高嘉敏折占飞冯玉宝
韩亚如,马国力,韩亚龙,高嘉敏,折占飞,冯玉宝*,肖 斌*
二咖啡酰奎宁酸类天然产物植物来源、药动学及生物活性的研究进展
韩亚如1,马国力1,韩亚龙2,高嘉敏1,折占飞1,冯玉宝1*,肖 斌1*
1. 内蒙古医科大学,鄂尔多斯临床医学院,临床药学实验室,内蒙古 鄂尔多斯 017000 2. 哈尔滨医科大学 附属肿瘤医院,黑龙江 哈尔滨 150040
随着生活水平的不断提高,高脂、高蛋白饮食导致癌症、心脑血管疾病、过敏性疾病已成为威胁人类健康的主要病因,其中抗氧化、清除自由基是重要的预防和治疗方式之一。二咖啡酰奎宁酸类化合物在自然界分布广泛,具有多酚羟基结构,生理活性多样,包括抗氧化、抗炎、降血糖、调血脂、抑制血小板、抗微生物、抗肿瘤等,引起国内外众多学者的广泛关注。由于理化性质及药动学影响,其药物开发并不完善。通过对二咖啡酰奎宁酸类化合物的植物来源、药动学以及生物活性研究进展进行综述,以期为其开发利用提供依据。
二咖啡酰奎宁酸;心脑血管疾病;植物来源;药动学;抗氧化;开发利用
近年来,随着人们生活水平的不断提高,高血压、高血糖、高血脂等逐步成为威胁人类健康的主要病因,其所导致的慢性病如心脑血管疾病发病率逐年升高。目前我国死亡率排名第1的疾病是心脑血管疾病,且呈现出低龄化趋势[1]。氧化应激与动脉粥样硬化、心肌缺血、原发性高血压等心脑血管疾病密切相关,对于氧化应激的控制主要依靠抗氧化剂,这也是今后临床工作的重点之一。虽然现阶段抗氧化剂正被广泛使用,但治疗效果并不突出,仍需在该领域加强研究。
植物多酚是一类广泛存在于植物体内含有多个酚羟基的次生代谢产物,日益受到关注。其中咖啡酰奎宁酸类化合物存在于金银花、忍冬、旋覆花、菊花等植物中,具有抗氧化、清除自由基、抗病毒等广泛的生物学活性,成为药物研发中的热点。
二咖啡酰奎宁酸(dicaffeoylquinic acids,DCQAs)是一类由奎宁酸与数目不等的咖啡酸通过酯化反应缩合而成的酚酸类天然成分。植物中常见的DCQAs有6种,为奎宁酸母核上羟基二取代的同分异构体,如图1所示,主要包括1,3-DCQA(洋蓟素)、1,4-DCQA、1,5-DCQA、3,4-DCQA(异绿原酸B)、3,5-DCQA(异绿原酸A)、4,5-DCQA(异绿原酸C)[2]。DCQAs在中药系统药理数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)中收录的靶点仅有凝血因子Ⅹa以及非受体型蛋白酪氨酸磷酸酶1,Swiss Target Prediction同源预测提示,蛋白激酶C(protein kinase C,PKC)α/δ为DCQAs潜在作用靶点,见表1。
1 DCQAs植物来源
DCQAs在金银花、杜仲、旋覆花、苍耳、白花刺参、茶叶、山楂、樱桃、苹果等植物中广泛存在,也是其临床应用的主要药效成分。本文通过“咖啡酰奎宁酸”“中药”“植物”3个检索词,以1995—2022年为检索年限,对中国知网、万方医学、维普数据库进行检索,共筛选得到相关文献2432篇,对其中的非药用植物相关文献以及重复文献进行剔除,最终筛选得到DCQAs相关药学文献124篇,对富含DCQAs的药用植物进行总结,见表2,其中含有异绿原酸(3,4-DCQA、3,5-DCQA、4,5-DCQA)的植物来源相对更加广泛。

图1 天然二咖啡酰奎宁酸化学结构式

表1 天然二咖啡酰奎宁酸理化性质
已知靶点检索自TCMSP数据库,同源预测靶点由Swiss Target Prediction预测,clogP、logS、pa从ChemDraw Professional软件预测
Known targets are retrieved from the TCMSP database, homology potential targets were predicted by Swiss Target Prediction, and the clogP, logS, and paare predicted from the ChemDraw Professional software
2 DCQAs药动学特征
药物代谢影响着药物的疗效和毒性,药动学定量描述药物进入机体内的动态变化规律,对于指导新药开发及临床用药具有重要意义。约35%的先导化合物因体内药动学特征不适宜人体而止步于临床前研究,约40%的侯选药物因药动学参数不佳而在临床研究中淘汰[3]。

表2 天然二咖啡酰奎宁酸植物来源
2.1 DCQAs在动物体内的药动学特征
1,5-DCQA是DCQAs中药动学特征研究最早且最为成熟的。杨波[4]研究发现,1,5-DCQA在犬和大鼠体内分别呈非线性和线性药动学特征。犬和大鼠在ig 1,5-DCQA时,由于存在胃肠双吸收位点,药-时曲线均有双峰现象。1,5-DCQA进入大鼠体内后,主要分布于肝、肾和膀胱,其中肝脏和小肠是其主要代谢部位,代谢方式主要包括甲基化、葡萄糖醛酸化、分子内酯键转移。参与其甲基化和葡萄糖醛酸化反应的酶主要为儿茶酚--甲基转移酶和尿苷二磷酸葡萄糖醛酸转移酶,肝脏因表达更多儿茶酚--甲基转移酶而比小肠黏膜更易催化1,5-DCQA甲基化。肝脏和小肠转化低浓度的1,5-DCQA生成葡萄糖醛酸化产物的能力相差不大,但小肠转化高浓度的1,5-DCQA的能力比肝脏更强。葡萄糖醛酸化代谢物在肝中可被β-葡萄糖苷酸酶水解,继而发挥药效。1,5-DCQA可被大鼠肠道菌群催化生成水解、还原和异构化产物。由于强烈的代谢、胆汁排泄及快速尿排泄,犬、大鼠iv或ig 1,5-DCQA后在体内迅速排出,其中10%~20%经肾排泄,70%随粪便排出[5-6]。1,5-DCQA在犬和大鼠体内的生物利用度分别为3.50%、0.52%,犬体内不易蓄积,对代谢酶无诱导作用。胆汁排泄的葡萄糖醛酸化代谢物具有更高水溶性,可被肠道β-葡萄糖醛酸酶水解并重吸收进入肠-肝循环,甲基化代谢物也可直接吸收进入肠-肝循环。1,5-DCQA主要与人血白蛋白结合,可与I和II型结合位点发生作用,这2类位点结合药物(华法林、安定等)都与1,5-DCQA存在潜在的药物相互作用。大鼠ig 1,5-DCQA后不会对肝微粒体酶产生诱导或抑制作用[7]。
此外,Takenaka等[8]发现3,5-DCQA在人工消化液中稳定,大鼠ig给药后血浆中无原型成分检出,而iv给药后有90%的原型成分在30 min内从血浆中消失。何双凤等[9]采用外翻肠囊模型,以3,5-DCQA为指标考察了杏香兔耳风提取物中总酚酸在不同肠段(空肠、回肠)中的膜通透性,发现3,5-DCQA的小肠渗透率低于绿原酸。3种抑制剂(阿魏酸、苯甲酸、布洛芬)可降低3,5-DCQA在回肠的渗透率,而对其空肠渗透率影响较小。3,5-DCQA的小肠吸收属于一级动力学过程,吸收机制为被动扩散,同时还存在一元羧酸转运蛋白介导的主动转运。王璨等[10]采用高效液相色谱-质谱联用仪(liquid chromatography-mass spectrometer,LC-MS)同时定量大鼠血浆中热毒宁注射液13个潜在质量标志物(包括3,5-DCQA、4,5-DCQA、3,4-DCQA等),各化合物在体内半衰期较短,消除速率快,所有化合物呈多个组织分布,具有血浆-组织/靶器官传递性,可作为热毒宁注射液安全性和有效性评价的潜在质量标志物。詹美榕等[11]应用LC-MS/MS技术测定大鼠ig 4,5-DCQA后血浆和尿液中的代谢物变化,分别检测到15、16种代谢产物,涉及甲基化、水合、还原、葡萄糖醛酸化、硫酸酯化等反应。吴婷等[12]测定大鼠iv脉络宁注射液4 mL/kg后血浆中3,4-DCQA的浓度,结果表明3,4-DCQA大鼠体内药物半衰期为(50.08±13.78)min,药时曲线下面积为(278.34±31.82)mg/(min·mL),清除率为(0.001 6±0.000 2)L/min。
2.2 DCQAs在人体内的药动学特征
刘江林等[13-14]通过对1,5-DCQA进行人体内的药动学研究。I期临床药动学研究中,健康受试者单次1,5-DCQA(200、400和800 mg/人)后,1,5-DCQA和1,5-二阿魏酰奎宁酸(diferuoylquinic acid,DFQA)的max相似,呈剂量相关性。连续口服给药后,1,5-DCQA在人体内不存在时间相关性的蓄积以及诱导加速或抑制的代谢现象。而双甲基代谢产物1,5-DFQA连续给药后存在时间相关性的蓄积。II期临床药动学研究中,受试者每天2次连续14 d(200、300 mg/次)口服1,5-DCQA后,不存在时间相关性的蓄积以及诱导加速或抑制的代谢现象。但其双甲基代谢产物1,5-DFQA存在时间相关性的蓄积。口服1,5-DCQA后,甲基化、葡萄糖醛酸化及甲基-葡萄糖醛酸化是其人体内的主要代谢途径。
随着DCQAs生物活性的不断揭示,今后有必要对具有显著生物活性的不同结构的DCQAs进行药动学拓展研究。
3 DCQAs生物活性
咖啡酰奎宁酸类天然产物在金银花、杜仲、旋覆花、苍耳、白花刺参等植物中广泛存在,也是其临床应用的主要药效成分。近年来国内外研究发现咖啡酰奎宁酸类天然产物(包括DCQAs)具有抗氧化、抗炎、降血糖、调血脂、抑制血小板、抗微生物、抗肿瘤等广泛的生物活性[15]。
3.1 抗氧化
人体过量的活性氧会破坏DNA、蛋白质等细胞成分,引发脂质氧化和其他细胞毒性效应,最终导致心血管疾病、衰老、癌症、神经退行性疾病等[15]。心脑缺血再灌注损伤在心脑血管疾病的发生发展中起主要作用。DCQAs主要的生物活性就是抗氧化,表现为清除氧自由基和抑制产生自由基的相关蛋白。
El-Askary等[16]通过体外酶抑制试验,发现3,5-DCQA、4,5-DCQA和3,4-DCQA体外自由基清除能力均优于抗坏血酸,其中以3,4-DCQA活性最高,这与其结构中儿茶酚基和3个不饱和酯基有关。谷胱甘肽是细胞抗氧化的重要成分,DCQAs可提高谷胱甘肽合成改善氧化应激损伤[17]。Kamarauskaite等[15]通过总抗氧化能力检测试剂盒和测量细胞色素C吸光度谱,发现艾草中3,5-DCQA具有自由基清除、铁离子还原、调节线粒体功能、抗氧化和细胞色素C还原活性。Hyun等[18]通过紫外线B和可吸入颗粒诱导人永生化角质形成HaCaT细胞氧化应激损伤模型,发现3,4-DCQA可减轻这种氧化应激损伤,这与含半胱氨酸天冬氨酸蛋白酶(cysteine aspartate-specific protease,Caspase)和丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPKs)等促凋亡因子的抑制以及活性氧清除相关。曹旭等[19]发现1,5-DCQA可剂量相关性地减轻1-甲基-4-苯基吡啶离子(1-methyl-4-phenyl-pyridiniuiodide,MPP+)导致的大鼠肾上腺嗜铬细胞瘤PC12细胞的氧化应激损伤,减少活性氧的产生和减少谷胱甘肽的耗竭,1,5-DCQA 50 μmol/L可显著抑制MPP+诱导的细胞突触核蛋白的转录和翻译,发挥细胞保护作用。吴吉等[20]采用紫外法测定体外清除1,1-二苯基-2-三硝基苯肼自由基活性,发现3,5-DCQA抗氧化活性与维生素C相当。
Liu等[21]通过建立大鼠局灶性脑缺血-再灌注损伤模型,发现3,5-DCQA能够降低诱导型一氧化氮合酶(inductible nitric oxide synthase,iNOS)表达水平,抑制活性氧或活性氮物种的产生和基质金属蛋白酶-9(martrix metalloproteinase-9,MMP-9)转录,降低MMP-9对与血脑屏障紧密连接蛋白-5(claudin-5)、闭合蛋白(occludin)和紧密黏连蛋白-1(zonulae occluden-1,ZO-1)的降解,保护缺血所引起的血脑屏障损伤。黄嘌呤氧化酶(xanthine oxidase,XOD)在有氧存在时,能催化黄嘌呤进行氧化反应生成尿酸和活性氧,Wan等[22]通过体外抑制XOD活性实验,发现DCQAs对XOD的抑制活性高于单咖啡酰奎宁酸,DCQAs通过疏水作用和氢键作用与XOD产生较强的亲和力,既减少尿酸的产生,也减弱了氧化应激,对高尿酸血症患者具有潜在预防作用。曹伟伟等[23]通过体外抑制XOD和抑制尿酸钠诱导的白细胞介素-1β(interleukin-1β,IL-1β)的构效关系研究,发现藜蒿叶中1,4-DCQA、1,5-DCQA、3,4-DCQA、3,5-DCQA和4,5-DCQA抑制XOD活性与抑制尿酸钠诱导的IL-1β活性呈正相关,揭示了DCQAs预防高尿酸血症和痛风的结构特征。
Lim等[24]通过皮质酮诱导的小鼠抑郁模型发现3,4-DCQA和3,5-DCQA可显著抑制神经元和星形胶质细胞中单胺氧化酶的活性,从而降低活性氧,减轻小鼠的记忆丧失等抑郁症状。田星[25]通过过氧化氢诱导的人神经母细胞瘤SH-SY5Y细胞氧化应激损伤模型,发现DCQAs通过细胞外调节激酶(extracellular regulated protein kinase,ERK)、蛋白激酶B(protein kinase B,Akt)/糖原合成酶激酶(glycogen synthase kinase,GSK)-3β信号通路以及抑制线粒体凋亡相关蛋白表达发挥抗过氧化氢诱导的氧化应激。Könczöl等[26]研究发现细裂叶莲蒿中3,5-DCQA及其乙酯化产物抗氧化活性均优于绿原酸等单咖啡酰奎宁酸类化合物。Xu等[27]通过清除自由基活性实验,发现DCQAs异构体之间的差异,3,5-DCQA和3,4-DCQA表现出相同的抗氧化活性,而4,5-DCQA在某些测定中具有比3,5-DCQA和3,4-DCQA更高的抗氧化活性。Marksa等[28]研究发现3,4-DCQA和3,5-DCQA的抗氧化活性在相同条件下比单咖啡酰奎宁酸的活性强。Bi等[29]采用叔丁基过氧化氢诱导大鼠心肌H9C2细胞凋亡模型研究发现3,5-DCQA可通过激活磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase,PI3K)/Akt信号通路来抑制心肌细胞凋亡。
3.2 抗炎
脂多糖诱导的小鼠单核巨噬RAW264.7细胞是常用的炎症研究细胞模型。Hong等[30]通过该模型发现,3,5-DCQA通过抑制、环氧合酶-2(cyclooxygenase-2,)和肿瘤坏死因子-α(tumor necrosis factor-α,)基因的表达,有效抑制一氧化氮的产生从而发挥抗炎作用。李玉凤等[31]研究发现玉叶金花中绿原酸、3,4-DCQA、3,5-DCQA、4,5-DCQA 20~100 μmol/L对细胞无毒性,且均有抗炎活性,其中3,4-DCQA可显著抑制一氧化氮的释放。李碧晟等[32]发现栀子中4,5-DCQA对RAW264.7细胞中前列腺素E2分泌有良好的抑制作用。
Wang等[33]发现苍耳子中4,5-DCQA可显著抑制脂多糖诱导的RAW264.7细胞中、和mRNA表达,显著提高盲肠结扎/穿刺引起的小鼠败血症小鼠的存活率。万鹏等[34]发现DCQAs长期干预能够显著降低正常饮食小鼠结肠组织中炎症因子、、、γ干扰素、和的基因表达,降低小鼠的体内炎症水平。唐思琪等[35]采用Griess法检测脂多糖刺激RAW264.7细胞分泌一氧化氮水平,发现糙叶五加果中1,5-DCQA具有一定的一氧化氮抑制活性。Roh等[36]发现薰衣草叶中3,5-DCQA和4,5-DCQA能够通过抑制激肽释放酶5的活性,调控抗菌肽LL-37的激活,抑制促炎因子的生成。de Campos Facchin等[37]发现裙带菜提取物及分离物对小鼠肺炎模型具有显著抗炎作用,能抑制激活的白细胞和渗出液中的蛋白浓度,降低腺苷脱氨酶和髓过氧化物酶的活性及一氧化氮、TNF-α、IL-1β和IL-17A等促炎因子的水平,这些效应可能与其成分3,5-DCQA和4,5-DCQA作用于核因子-κB(nuclear factor-κB,NF-κB)p65和p38 MAPK信号通路有关。刘杨等[38]发现3,5-DCQA可抑制胶原诱导关节炎大鼠关节滑膜内的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、Caspase-1、NF-κB p65、NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)的过表达,降低NF-κB抑制蛋白(inhibitor of NF-κB,IκB)-α和NF-κB p65蛋白磷酸化,抑制血浆IL-1β、IL-6、TNF-α、C-反应蛋白、γ干扰素、IL-18水平,进而减轻大鼠炎症反应。
人中性粒细胞弹性酶在急性肺损伤(acute lung injury,ALI)特有的炎症反应中发挥关键作用,Chen等[39]发现3,5-DCQA在体内外对中性粒细胞弹性酶具有很强的选择性抑制作用,可降低脂多糖诱导的ALI模型支气管肺泡灌洗液炎症细胞因子水平,通过抑制类固醇受体共激活子家族激酶/鸟嘌呤核苷酸交换因子Vav信号通路调节中性粒细胞功能产生ALI保护作用。Wang等[40]发现3,5-DCQA可通过抑制NF-κB/NLRP3信号通路的蛋白表达逆转脂多糖诱导的ALI。
邓颖颖等[41]发现sc 1,3-DCQA的家兔血清中免疫球蛋白E抗体水平可升高2倍以上,说明1,3-DCQA具有潜在致敏性。牛艺璇等[42]发现黑沙蒿中4,5-DCQA和3,5-DCQA可显著抑制C48/80诱导的小鼠肥大细胞瘤P815细胞脱颗粒,具有潜在的抗过敏活性。
3.3 降血糖
糖尿病是一组以高血糖为特征的代谢性疾病,临床降糖药物包括磺脲类、双胍类、α-葡萄糖苷酶抑制剂、二肽基肽酶(dipeptidyl peptidase,DPP)-Ⅳ抑制剂等。El-Askary等[16]发现3,4-DCQA、3,5-DCQA对DPP-Ⅳ和α-葡萄糖苷酶具有较强的体外抑制活性,3,4-DCQA还对α-淀粉酶有明显抑制作用。颜欢等[43]通过α-葡萄糖苷酶体外抑制实验,发现金银花花蕾中3,5-DCQA对除蔗糖酶及嗜热脂肪芽孢杆菌α-葡萄糖苷酶之外的α-葡萄糖苷酶均具有抑制作用,对大鼠小肠II型α-葡萄糖苷酶抑制效果最强。Tong等[44]发现菊苣种子主要成分3,5-DCQA能够缓解链脲佐菌素(streptozotocin,STZ)诱导的小鼠I型糖尿病的高血糖症状和部分损害,显著改善糖耐量和体质量减轻,这与循环胰岛素水平升高、胰岛体积保留、游离脂肪酸利用率提高和α-葡萄糖苷酶抑制有关。Etemadi-Tajbakhsh等[45]发现D. Don中1,5-DCQA具有明显的α-葡萄糖苷酶抑制活性。张华婷等[46]发现3-咖啡酰奎宁酸、3,4-DCQA、5-咖啡酰奎宁酸和牛蒡苷元能显著提高STZ诱导的糖尿病小鼠糖耐量(<0.05)。卢桃等[47]通过建立微量α-淀粉酶抑制剂体外活性检测模型,发现甜叶菊毛状根中3,5-DCQA、4,5-DCQA、绿原酸对α-淀粉酶有很好的体外抑制作用。朱晓琳等[48]通过建立牛血清白蛋白-甲基乙二醛和牛血清白蛋白-乙二醛2种蛋白质糖基化反应模型,发现马兰中3,4-DCQA具有很强的抑制牛血清白蛋白-甲基乙二醛和牛血清白蛋白-乙二醛诱导的蛋白质糖基化的活性。
3.4 调血脂
动脉粥样硬化是心脑血管疾病的病变基础,动脉粥样硬化的根本形成原因是高血脂,可导致冠心病、心肌梗死、脑血栓等。吴崇明等[49]通过建立油酸诱导的人肝癌HepG2细胞脂质积聚模型,发现露兜簕中3,5-DCQA可提高脂质氧化相关基因过氧化物酶体增殖物激活受体-α、肉毒碱棕榈酰基转移酶-1和酰基辅酶A氧化酶-1的表达,促进脂肪酸β氧化,显著抑制脂质合成相关基因固醇调节元件结合蛋白(sterol regulatory element binding protein,SREBP)-1c、SREBP-2、乙酰辅酶A羧化酶、3-羟基-3-甲基戊二酸单酰辅酶A还原酶和凋亡相关因子的表达,降低脂质积聚和细胞内总胆固醇和三酰甘油水平,且无显著细胞毒性。Raineri等[50]通过含激素脂肪配方诱导前脂肪3T3-L1细胞分化模型,发现经3,5-DCQA处理的细胞没有显示脂滴聚集,分化过程结束时无脂质沉积,保持了前脂肪细胞形态,同时使AMP依赖的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)活化,抑制脂肪酸合成代谢。
3.5 抑制血小板聚集
在动脉粥样硬化早期阶段,血小板聚集在受损的动脉内膜上,进一步通过细胞因子介导,逐渐形成血栓。研究表明DCQAs可抑制血小板聚集,灯盏细辛注射液(含DCQAs)常与阿司匹林联用治疗心脑血管疾病,且疗效显著[51]。Chang等[52]研究发现咖啡酸甲酯、3,4-DCQA和甲基-3,4-DCQA可强烈抑制具有收缩血管作用的血栓素A2的产生以及二磷酸腺苷诱导的血小板聚集,其中甲基-3,4-DCQA可直接抑制花生四烯酸下游成分引发的血栓。Satake等[53]研究发现积雪草中3,5-DCQA具有较强的抑制大鼠血小板活化和抗凝活性。
3.6 抗微生物
整合是人类免疫缺陷病毒(Human immunodeficiency virus,HIV)-1感染宿主细胞的必需过程,因此整合酶是艾滋病治疗的靶点。DQCAs是HIV-1整合酶抑制剂,可使整合酶中央区催化活性部位的氨基酸不可逆失活。King等[54]对DQCAs及其类似物抗HIV活性的构效关系研究发现,咖啡酸、奎宁酸和绿原酸均无抗HIV活性,2个儿茶酚结构同时存在是抗HIV所必需的,结构中的自由羧基也必不可少。Hu等[55]通过分子建模技术发现,3,4-DCQA可与HIV整合酶选择性结合,抑制其活性。虽然诸多整合酶抑制剂己见报道,但大多具有细胞毒性,而天然DCQAs具有毒性低等特点,有望成为新型抗HIV药物[2]。
绿原酸类物质可通过增强DNA自我保护来抑制乙型肝炎病毒(hepatitis B virus,HBV)病毒感染,对HBV的体内复制具有很好的阻碍作用。旋覆花中有效成分1,5-DCQA具有抗HBV作用[56]。杨岸奇等[57]研究表明,绿原酸类物质4,5-DCQA和3,5-DCQA具有抗HBV病毒的作用。Hao等[58]通过-氨基半乳糖诱导的人正常肝HL-7702细胞损伤模型和HBV转染的人肝癌HepG2.2.15细胞模型,发现3,5-DCQA可显著提高HL-7702细胞活力,对乙肝表面抗原和乙肝e抗原表达的抑制率分别为86.9%和72.9%。此外,3,5-DCQA可显著降低HBV共价闭合环状DNA的含量,并显著诱导HepG2.2.15细胞中血红素加氧酶-1的表达。Ma等[59]通过测量丙型肝炎病毒复制体系中的荧光素酶活性,发现绿原酸和3,5-DCQA具有较强的抗丙型肝炎病毒的活性,分别为61%和53%。
新型冠状病毒肺炎已成为严重威胁人类的呼吸系统疾病。Shah等[60]通过分子对接发现3,5-DCQA与新型冠状病毒3CL水解酶(main protease,Mpro)受体有较高亲和力,有望抑制Mpro蛋白切割mRNA及病毒组装等相关功能。Singh等[61]通过分子对接、分子动力学模拟和终态热力学等方法,研究发现DCQAs与刺突蛋白受体结合域的重要氨基酸残基赖氨酸Lys 417、谷氨酰胺Gln 493、酪氨酸Tyr 489、苯丙氨酸Phe 456、酪氨酸Tyr 473、谷氨酸Glu 484相互作用明显,抑制病毒进入宿主细胞。Bharadwaj等[62]通过分子动力学模拟发现1,3-DCQA与Mpro催化袋中的保守氨基酸残基形成强烈的分子间相互作用,具有潜在抗新型冠状病毒的活性。
陶鑫等[63]通过体外抑菌实验,发现苍耳草中1,3-DCQA和1,4-DCQA对金黄色葡萄球菌、大肠杆菌、绿脓杆菌和志贺氏痢疾杆菌均有一定的抑制作用。朱文卿等[64]采用网络药理学对咖啡酰奎宁酸类化合物抑菌的作用靶点、作用机制及相关通路进行探讨,结果表明咖啡酰奎宁酸类化合物抑菌作用靶点有75个,并通过分子对接进行验证,为后期的抗菌药物研究提供理论基础。霍锦双等[65]通过牛津杯法和最小抑菌浓度法对甘薯茎叶中9种多酚类成分(其中3,4-DCQA、3,5-DCQA、4,5-DCQA含量最高)的抑菌活性进行分析,发现各成分对革兰阳性菌抑制作用强于革兰阴性菌,对霉菌的抑制作用最弱。Han等[66]通过微观量热法比较研究忍冬花中3种DCQAs对志贺芽孢杆菌生长的抗菌活性,发现其抑菌活性序列为3,5-DCQA>4,5-DCQA>3,4-DCQA,其中C-5上的咖啡基酯基团可能是对细菌细胞亲和力较高的主基团。李更森等[67]通过早期24 h静止铜绿假单胞菌-烟曲霉混合生物被膜模型,发现3,5-DCQA(250 μg/mL)、3,4-DCQA(500 μg/mL)、4,5-DCQA(1000 μg/mL)与两性霉素-B、美罗培南联合应用显著提高混合生物膜内烟曲霉菌和铜绿假单胞菌的杀灭效果,二者对真菌及细菌的杀灭具有协同作用,且呈剂量相关性。
3.7 抗肿瘤
周煜航[68]发现1,3-DCQA可与14-3-3τ蛋白结合,下调乳腺癌细胞的两面神激酶(janus kinase,JAK)、Akt、原癌基因丝氨酸/苏氨酸-蛋白激酶Raf-1、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等蛋白表达,抑制乳腺癌细胞的蛋白合成和细胞增值,上调B淋巴细胞瘤(B-cell lymphoma,Bcl)-2基因相关启动子(Bcl-2 asociated death,Bad)诱导乳腺癌细胞基于Caspase途径的细胞凋亡。1,3-DCQA通过JAK/PI3K/Akt和Raf/ERK通路抑制乳腺癌增殖和转移,激活环磷腺苷效应元件结合蛋白(cyclic adenosine monophosphate-response element binding protein,CREB),从而上调IL-6和集落刺激因子表达,并通过Bad/Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)/Caspase-9信号通路诱导乳腺癌细胞凋亡[69]。王明彦[70]研究发现3,4-DCQA可以时间-剂量相关性地诱导人乳腺癌MCF-7细胞的凋亡,明显上调MCF-7细胞中基因,下调基因。Lodise等[71]发现4,5-DCQA通过将前列腺癌细胞复制周期阻滞在S期而非诱导细胞程序性死亡来发挥强大的体内抗前列腺癌作用。施琦渊等[72]发现奇蒿花中3,5-DCQA可抑制人宫颈癌HeLa细胞的体外增殖以及形态损伤,呈剂量相关性。王明彦[70]发现3,5-DCQA对人胃癌MGC-803细胞诱导凋亡作用呈时间-剂量相关性,3,5-DCQA(400 μg/mL)作用24 h对MGC-803细胞抑制率达到59.41%。此外,、细胞凋亡基因的相对表达与3,5-DCQA浓度呈正相关逐渐上升,而抑制凋亡蛋白Bcl-2的表达与之呈负相关。
3.8 保肝
孙燕荣等[73]发现1,5-DCQA(7.8~250 mg/L)对肝原代细胞无明显毒性,并能促进正常及四氯化碳损伤的肝细胞增殖,降低细胞上清丙氨酸氨基转移酶(glutamic pyruvic transaminase,ALT)水平,抑制四氯化碳引起的肝细胞凋亡,改变受损细胞周期。刘鑫等[74]发现3,4-DCQA对阿托伐他汀诱导肝损伤的小鼠均具有保护作用,表现为抑制血清谷氨酸氨基转移酶(glutamic oxalacetic transaminase,AST)、ALT升高,改善肝组织病理学损伤。韩盟帝[75]采用血清指纹图谱和灰色关联度法分析蓝盆花保肝活性的谱-效关系,在大鼠ig给药后,有效成分3,5-DCQA的关联度大于0.8,推测其具有较高保肝活性。肝成纤维细胞可合成胶原蛋白及其他细胞外间质,过度合成则会导致肝纤维化,而后者是肝硬化的必经阶段。孙燕荣等[76-77]采用体外培养小鼠胚胎成纤维NIH/3T3细胞作为成纤维细胞替代模型,发现1,5-DCQA可显著抑制NIH/3T3细胞增殖,且只对细胞内的胶原合成有影响,提示1,5-DCQA抑制细胞内胶原合成是抗肝纤维化的途径之一,此外,1,5-DCQA可显著降低血清AST、ALT水平及肝纤维化指标,提高蛋白合成率,降低血清层连蛋白、透明质酸、丙二醛、一氧化氮含量,明显改善病理损伤,降低组织纤维化,改善超微结构,其机制为促进肝原代细胞增殖,改变受损细胞的增殖周期,抑制肝细胞凋亡,显著抑制成纤维细胞增殖,降低成纤维细胞透明质酸水平,从而保护肝脏[78]。Liu等[79]通过蛋氨酸和胆碱缺乏饮食诱导小鼠非酒精性脂肪肝炎模型,证实兔耳草中3,4-DCQA通过调控转录因子核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)抑制氧化应激,通过微RNA-122/缺氧诱导因子-1α信号通路抑制多种促纤维化因子,对非酒精性脂肪性肝炎的纤维化有显著保护作用。
3.9 神经保护
-甲基--天冬氨酸(-methyl--aspartic acid,NMDA)受体过度激活会导致大量钙离子内流,从而触发下游凋亡通路,造成神经元损伤,在神经退行性疾病的发生发展中起着重要作用。田星等[25]通过NMDA诱导SH-SY5Y细胞兴奋性毒性损伤模型,发现DCQAs可通过拮抗NMDA受体亚单位,抑制NMDA受体过度激活介导的钙内流和线粒体凋亡途径相关蛋白表达,同时作用于MAPKs、Akt/GSK-3β和CREB信号通路发挥抗NMDA兴奋性毒性作用。褚晓凡等[80]通过研究DCQAs对大鼠脑缺血神经行为学和海马神经细胞凋亡的影响,发现DCQAs可通过抑制Caspase-3蛋白表达,减少神经细胞凋亡,发挥神经保护作用。Xiao等[81]通过淀粉样β1-42诱导的原代神经元细胞损伤模型,发现1,5-DCQA通过原肌球蛋白受体激酶A、PI3K/Akt、Bcl-2/Bax和GSK-3β信号通路在原代神经元免受β-淀粉样蛋白Aβ42损害方面具有保护作用。盛艳梅等[82]采用体外血脑屏障模型结合高效液相色谱技术发现3,5-DCQA能透过血脑屏障,降低大鼠脑梗死率,增加脑缺血再灌注损伤大鼠血清谷胱甘肽过氧化物酶、iNOS活性,降低血清中丙二醛含量,改善其神经行为学,发挥脑缺血保护作用。付学军等[17]发现DCQAs能降低大脑中动脉阻塞模型诱导脑缺血后的星形胶质细胞porimin指标的表达,发挥星形胶质细胞保护作用。张静等[83]发现1,5-DCQA和3,4-DCQA具有体外促进大鼠大脑皮层神经细胞存活的作用。
压力是导致抑郁症的一大危险因素,研究发现DCQAs对小鼠神经元萎缩具有保护作用,可减轻压力激素引起的抑郁行为。更年期是抑郁症的另一个危险因素,Lim等[84]利用雌激素缺乏致小鼠去卵巢(ovariectomized,OVX)抑郁模型,发现1,3-DCQA通过上调OVX小鼠海马神经元iNOS的表达来恢复雌激素缺乏所致的一氧化氮缺乏,从而预防雌激素缺乏诱导的抑郁样行为。1,3-DCQA通过直接调节神经元型一氧化氮合酶表达和ERK-环磷酸腺苷(cyclic adenosine monophosphate,cAMP)反应元件结合蛋白-脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号通路,增加海马一氧化氮的形成预防雌激素缺乏诱导的抑郁症样行为。
3.10 其他
El-Askary等[16]通过人皮肤成纤维HSF细胞体外划伤愈合模型发现10 µg/mL的4,5-DCQA和3,4-DCQA可促进创面愈合。4,5-DCQA处理24 h后细胞迁移率增强,划痕创面愈合,48 h后创面完全愈合,而3,4-DCQA仅在48 h细胞迁移增加,创面宽度从对照组的37%减少到23%。过量饮酒会使胃黏膜损伤,Carlotto等[85]通过乙醇诱导大鼠胃溃疡模型,发现0.057 mg/kg 1,3-DCQA可使75%的胃黏膜免于损伤(而阳性对照奥美拉唑为95%)。Wu等[86]通过氨水诱导的小鼠咳嗽模型,发现款冬花中绿原酸、3,4-DCQA、3,5-DCQA和4,5-DCQA能降低氨水诱发的小鼠咳嗽频率,使咳嗽潜伏期明显延长。其中3,5-DCQA祛痰效果最好,4,5-DCQA明显降低白细胞水平。dos Santos等[87]发现2.5 mg/kg 3,5-DCQA和4,5-DCQA在小鼠扭体实验中表现出显著的镇痛作用。
谢旻皓等[88]通过体外模拟人体肠道厌氧环境,对粪样中微生物群进行混合培养,使用荧光原位杂交对菌群结构进行研究,发现添加3,5-DCQA的培养基中,双歧杆菌等有益菌的数量在36 h内有一定程度的增长,溶组织梭状菌、普雷沃勒氏菌等的生长被抑制,表明3,5-DCQA对改善人体肠道微生态、调节肠道平衡具有一定的作用。
胰岛素样生长因子-1受体(insulin-like growth factor-1 receptor,IGFR)是重要的长寿靶蛋白。Li等[89]通过分子对接发现6种咖啡酰奎宁酸均能很好地嵌入IGFR活性口袋,其中3,5-DCQA与IGFR的亲和力最强。咖啡酰基奎宁酸均能显著延长野生型秀丽隐杆线虫的寿命,其中3,5-DCQA作用最强。3,5-DCQA通过增加机体弯曲和咽泵速度,降低肠道脂褐素水平,提高了健康寿命。进一步的研究表明,3,5-DCQA通过抑制IGFR的活性下调胰岛素/ IGFR信号通路,激活寿命调控转录因子DAF-16,从而诱导应激反应基因的表达发挥抗衰老作用。胶原酶主要由成纤维细胞合成分泌,可降解皮肤中的胶原蛋白和弹性蛋白,导致皮肤老化[90]。厚藤中3,4-DCQA、3,5-DCQA和4,5-DCQA具有显著的体外胶原酶抑制活性(半数抑制浓度为5.8~37.2 μg/mL),有望开发为衰老药物[91]。
4 结语与展望
DCQAs作为广泛存在的一类天然产物,表现出抗氧化、抗炎、降血糖、调血脂、抑制血小板、抗微生物、抗肿瘤等生物活性[92],具体作用机制见表3,无论是在医疗还是食品领域均具有良好的利用价值与发展前景。江西江中制药与中国军事医学科学院共同研制的抗艾滋病新药1,5-DCQA,经过严格的动物药效学和安全性试验后,目前已进入临床试验。

表3 二咖啡酰奎宁酸类化合物的药理作用及机制
续表3
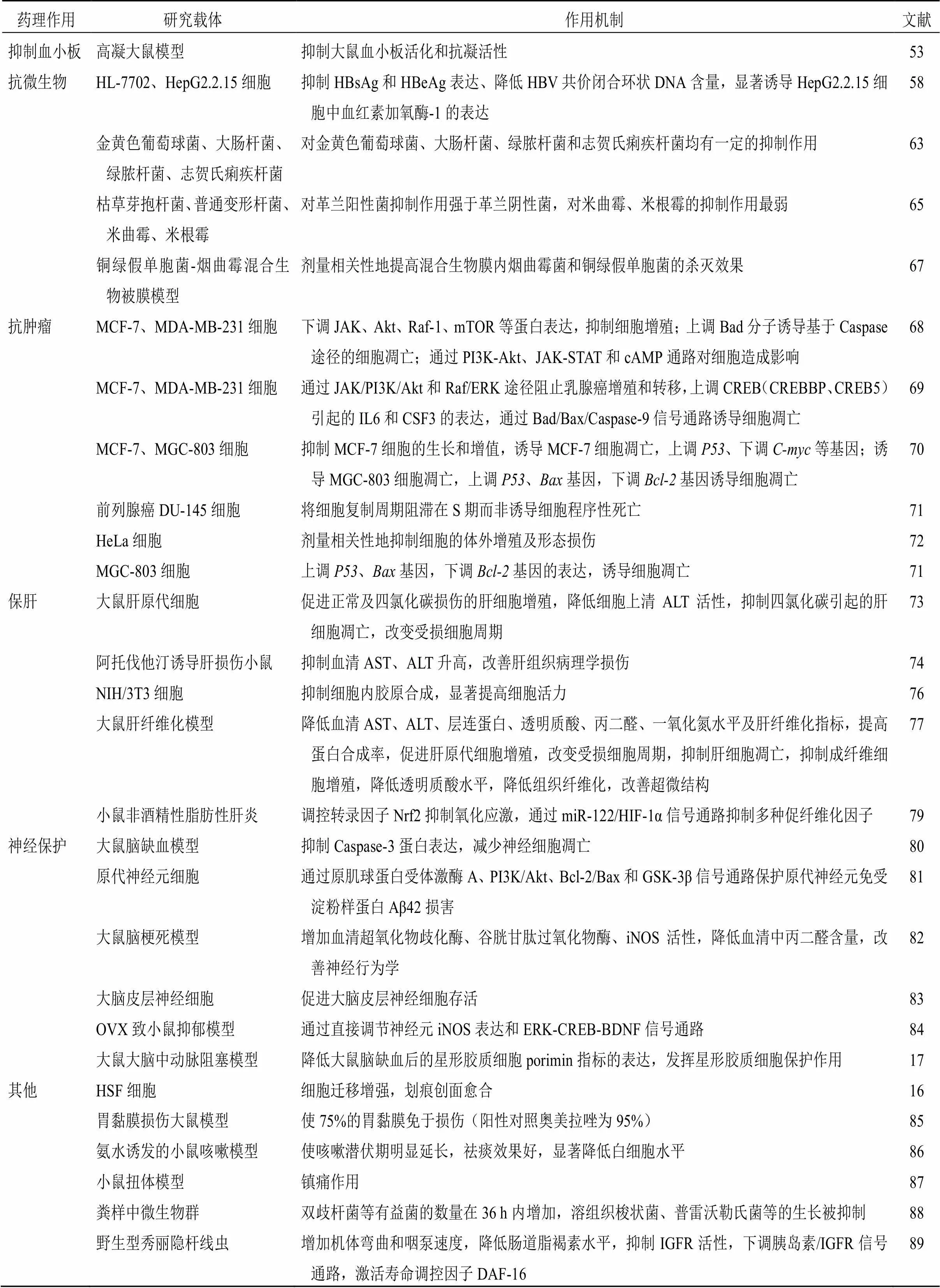
药理作用研究载体作用机制文献 抑制血小板高凝大鼠模型抑制大鼠血小板活化和抗凝活性53 抗微生物HL-7702、HepG2.2.15细胞抑制HBsAg和HBeAg表达、降低HBV共价闭合环状DNA含量,显著诱导HepG2.2.15细胞中血红素加氧酶-1的表达58 金黄色葡萄球菌、大肠杆菌、绿脓杆菌、志贺氏痢疾杆菌对金黄色葡萄球菌、大肠杆菌、绿脓杆菌和志贺氏痢疾杆菌均有一定的抑制作用63 枯草芽抱杆菌、普通变形杆菌、米曲霉、米根霉对革兰阳性菌抑制作用强于革兰阴性菌,对米曲霉、米根霉的抑制作用最弱65 铜绿假单胞菌-烟曲霉混合生物被膜模型剂量相关性地提高混合生物膜内烟曲霉菌和铜绿假单胞菌的杀灭效果67 抗肿瘤MCF-7、MDA-MB-231细胞下调JAK、Akt、Raf-1、mTOR等蛋白表达,抑制细胞增殖;上调Bad分子诱导基于Caspase途径的细胞凋亡;通过PI3K-Akt、JAK-STAT和cAMP通路对细胞造成影响68 MCF-7、MDA-MB-231细胞通过JAK/PI3K/Akt和Raf/ERK途径阻止乳腺癌增殖和转移,上调CREB(CREBBP、CREB5)引起的IL6和CSF3的表达,通过Bad/Bax/Caspase-9信号通路诱导细胞凋亡69 MCF-7、MGC-803细胞抑制MCF-7细胞的生长和增值,诱导MCF-7细胞凋亡,上调P53、下调C-myc等基因;诱导MGC-803细胞凋亡,上调P53、Bax基因,下调Bcl-2基因诱导细胞凋亡70 前列腺癌DU-145细胞将细胞复制周期阻滞在S期而非诱导细胞程序性死亡71 HeLa细胞剂量相关性地抑制细胞的体外增殖及形态损伤72 MGC-803细胞上调P53、Bax基因,下调Bcl-2基因的表达,诱导细胞凋亡71 保肝大鼠肝原代细胞促进正常及四氯化碳损伤的肝细胞增殖,降低细胞上清ALT活性,抑制四氯化碳引起的肝细胞凋亡,改变受损细胞周期73 阿托伐他汀诱导肝损伤小鼠抑制血清AST、ALT升高,改善肝组织病理学损伤74 NIH/3T3细胞抑制细胞内胶原合成,显著提高细胞活力76 大鼠肝纤维化模型降低血清AST、ALT、层连蛋白、透明质酸、丙二醛、一氧化氮水平及肝纤维化指标,提高蛋白合成率,促进肝原代细胞增殖,改变受损细胞周期,抑制肝细胞凋亡,抑制成纤维细胞增殖,降低透明质酸水平,降低组织纤维化,改善超微结构77 小鼠非酒精性脂肪性肝炎调控转录因子Nrf2抑制氧化应激,通过miR-122/HIF-1α信号通路抑制多种促纤维化因子79 神经保护大鼠脑缺血模型抑制Caspase-3蛋白表达,减少神经细胞凋亡80 原代神经元细胞通过原肌球蛋白受体激酶A、PI3K/Akt、Bcl-2/Bax和GSK-3β信号通路保护原代神经元免受淀粉样蛋白Aβ42损害81 大鼠脑梗死模型增加血清超氧化物歧化酶、谷胱甘肽过氧化物酶、iNOS活性,降低血清中丙二醛含量,改善神经行为学82 大脑皮层神经细胞促进大脑皮层神经细胞存活83 OVX致小鼠抑郁模型通过直接调节神经元iNOS表达和ERK-CREB-BDNF信号通路84 大鼠大脑中动脉阻塞模型降低大鼠脑缺血后的星形胶质细胞porimin指标的表达,发挥星形胶质细胞保护作用17 其他HSF细胞细胞迁移增强,划痕创面愈合16 胃黏膜损伤大鼠模型使75%的胃黏膜免于损伤(阳性对照奥美拉唑为95%)85 氨水诱发的小鼠咳嗽模型使咳嗽潜伏期明显延长,祛痰效果好,显著降低白细胞水平86 小鼠扭体模型镇痛作用87 粪样中微生物群双歧杆菌等有益菌的数量在36 h内增加,溶组织梭状菌、普雷沃勒氏菌等的生长被抑制88 野生型秀丽隐杆线虫增加机体弯曲和咽泵速度,降低肠道脂褐素水平,抑制IGFR活性,下调胰岛素/IGFR信号通路,激活寿命调控因子DAF-1689
DCQAs具有多种生物活性,通过探究该类化合物作用机制结合临床试验进行开发应用具有深远意义。尽管DCQAs临床应用价值很大,但因脂溶性差、稳定性差、溶解性差等因素影响了其生物利用度,从而降低了其功效的发挥。尽管通过纳米颗粒、乳制剂、脂质体制剂、环糊精包合物、磷脂复合物等新型封装技术有望改善其生物利用度,如何提高DCQAs的利用效率仍需进一步的探索。
DCQAs药动学、药效学及毒理学评价仍有不足,化合物的作用靶标和分子机制仍不清楚。通过系统深入挖掘DCQAs的功能特性,并将其应用到创新药物的开发中,对于进一步提高DCQAs产品附加值,拓展其应用领域具有重要意义。未来可从6种DCQAs中寻找更具生物活性的先导化合物,再对其进行结构修饰,以提高其生物活性或改善其理化性能以提高其成药性,同时获得有益的构效关系,以便对DCQAs进行更加合理的修饰和改造。此外,还需扩大DCQAs及其衍生物的生物活性筛选类型,并对其作用机制和靶点进行更深入的研究。本文对DCQAs的植物来源、药动学及生物活性进行了归纳、总结,以期能对DCQAs相关新药的研发提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 吴利平. 氧化应激与心血管疾病关系的研究进展 [J]. 中国处方药, 2017, 15(7): 9-10.
[2] 吴琪珍. 咖啡酰奎宁酸类化合物研究进展 [J]. 中国野生植物资源, 2020, 39(4): 48-53.
[3] Obach R S, Baxter J G, Liston T E,. The prediction of human pharmacokinetic parameters from preclinical andmetabolism data [J]., 1997, 283(1): 46-58.
[4] 杨波. 1,5-二咖啡酰奎宁酸的体内外代谢及药代动力学研究 [D]. 沈阳: 沈阳药科大学, 2005.
[5] Yang B, Meng Z Y, Dong J X,. Metabolic profile of 1,5-dicaffeoylquinic acid in rats, anandstudy [J]., 2005, 33(7): 930-936.
[6] Yang B, Meng Z Y, Yan L P,. Pharmacokinetics and metabolism of 1,5-dicaffeoylquinic acid in rats following a single intravenous administration [J]., 2006, 40(2): 417-422.
[7] 杨波, 闫亮平, 孟志云, 等. 1,5-二咖啡酰奎宁酸对大鼠肝微粒体细胞色素P450含量的影响 [J]. 军事医学科学院院刊, 2005, 29(5): 101-102.
[8] Takenaka M, Nagata T, Yoshida M. Stability and bioavailability of antioxidants in garland (L.) [J]., 2000, 64(12): 2689-2691.
[9] 何双凤, 孙勇兵, 徐兰, 等. 杏香兔耳风提取物的小肠吸收机制 [J]. 沈阳药科大学学报, 2012, 29(7): 546-550.
[10] 王璨, 王保和, 黄宇虹, 等. UPLC-MS/MS同时测定大鼠血浆中热毒宁注射液13个潜在质量标志物及其药动学研究 [J]. 中草药, 2021, 52(9): 2653-2664.
[11] 詹美榕, 贾益群, 陈龙, 等. 基于LC-MS分析4,5-二咖啡酰奎宁酸在大鼠血浆和尿液中的代谢产物 [J]. 中国中药杂志, 2020, 45(2): 391-397.
[12] 吴婷, 张军, 李长印, 等. 脉络宁注射液中5种酚酸类成分血药浓度的LC-MS/MS测定及大鼠体内药代动力学研究 [J]. 中国中药杂志, 2014, 39(10): 1928-1932.
[13] 刘江林. 1,5-二咖啡酰奎宁酸临床药代动力学研究 [D]. 沈阳: 沈阳药科大学, 2009.
[14] 刘江林, 袁丹, 丁建刚, 等. 液相色谱-电喷雾离子阱质谱法研究人尿中1,5-二咖啡酰奎宁酸的代谢产物 [J]. 中国临床药理学杂志, 2010, 26(3): 217-220.
[15] Kamarauskaite J, Baniene R, Raudone L,. Antioxidant and mitochondria-targeted activity of caffeoylquinic-acid-rich fractions of wormwood (L.) and silver wormwood (Nutt.) [J]., 2021, 10(9): 1405.
[16] El-Askary H, Salem H H, Abdel Motaal A. Potential mechanisms involved in the protective effect of dicaffeoylquinic acids fromL. leaves against diabetes and its complications [J]., 2022, 27(3): 857.
[17] 付学军, 黄巧英, 黄莹, 等. 二咖啡酰奎宁酸对脑缺血后星形胶质细胞Porimin指标的影响观察 [J]. 中风与神经疾病杂志, 2015, 32(5): 419-422.
[18] Hyun Y J, Piao M J, Kang K A,. 3,4-dicaffeoylquinic acid protects human keratinocytes against environmental oxidative damage [J]., 2019, 52: 430-441.
[19] 曹旭, 肖海兵, 李慧, 等. 1,5-二咖啡酰奎宁酸对MPP+所致PC12细胞损伤的保护作用 [J]. 华中科技大学学报: 医学版, 2010, 39(4): 435-438.
[20] 吴吉, 喻叶楠, 张心怡, 等. 3,5--二咖啡酰基奎宁酸的稳定性和抗氧化活性研究 [J]. 中国现代应用药学, 2017, 34(10): 1397-1400.
[21] Liu G L, Liang Y, Xu M,. Protective mechanism ofinjection on blood-brain barrier injury induced by cerebral ischemia in rats [J]., 2021, 11(1): 18451.
[22] Wan Y, Qian J, Li Y Z,. Inhibitory mechanism of xanthine oxidase activity by caffeoylquinic acids[J]., 2021, 184: 843-856.
[23] 曹伟伟, 吴婷, 方雅静, 等. 藜蒿叶中1,4-双咖啡酰奎宁酸的鉴定及双咖啡酰奎宁酸类化合物体外抑制黄嘌呤氧化酶和抑制尿酸钠诱导IL-1β的构效关系 [J]. 中国食品学报, 2020, 20(2): 1-8.
[24] Lim D W, Park J, Jung J,. Dicaffeoylquinic acids alleviate memory loss via reduction of oxidative stress in stress-hormone-induced depressive mice [J]., 2020, 161: 105252.
[25] 田星. 牛蒡根提取物及二咖啡酰基奎宁酸MQA对神经损伤的保护作用及机制研究 [D]. 沈阳: 沈阳药科大学, 2015.
[26] Könczöl Á, Béni Z, Sipos M M,. Antioxidant activity-guided phytochemical investigation ofWebb. ex Stechm.: Isolation and spectroscopic challenges of 3,5--dicaffeoyl (epi?) quinic acid and its ethyl ester [J]., 2012, 59: 83-89.
[27] Xu J G, Hu Q P, Liu Y. Antioxidant and DNA-protective activities of chlorogenic acid isomers [J]., 2012, 60(46): 11625-11630.
[28] Marksa M, Zymone K, Ivanauskas L,. Antioxidant profiles of leaves and inflorescences of native, invasive and hybridspecies [J]., 2020, 145: 112123.
[29] Bi Y M, Wu Y T, Chen L,. 3,5-dicaffeoylquinic acid protects H9C2 cells against oxidative stress-induced apoptosis via activation of the PI3K/Akt signaling pathway [J]., 2018, 62: 10.29219.
[30] Hong S, Joo T, Jhoo J W. Antioxidant and anti-inflammatory activities of 3,5-dicaffeoylquinic acid isolated fromleaves [J]., 2015, 24(1): 257-263.
[31] 李玉凤, 张谦华, 林雀跃, 等. 玉叶金花中咖啡酰奎宁酸类成分抗炎活性研究 [J]. 长春中医药大学学报, 2022, 38(2): 161-164.
[32] 李碧晟, 陶倩. 栀子抗炎活性成分的初步考察 [J]. 中国药师, 2021, 24(7): 387-392.
[33] Wang X B, Wu J H, Ni B K. Protective effects of 4,5--dicaffeoylquinic acid against mouse sepsis via down-regulation of TNF-α, IL-6 and IL-8 [J]., 2020, 19(4): 715-720.
[34] 万鹏, 陈贵杰, 彭宇佳, 等. 冬青苦丁茶中二咖啡酰奎宁酸降低炎症水平并调节小鼠肠道菌群 [A] // 中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集 [C]. 北京: 中国食品科学技术学会, 2019: 2.
[35] 唐思琪, 罗姣, 黄浩, 等. 糙叶五加正丁醇萃取部位抗炎活性成分研究 [J]. 天然产物研究与开发, 2021, 33(4): 598-606.
[36] Roh K B, Jang Y, Cho E,. Chlorogenic acid isomers isolated fromexhibit anti-effects[J]., 2022, 10(2): 463.
[37] de Campos Facchin B M, da Rosa J S, Luz A B G,. Systemic administration ofinhibits inflammation induced by carrageenan in a murine model of pulmonary neutrophilia [J]., 2020, 2020: 4620251.
[38] 刘杨, 段学清, 严福林, 等. 异绿原酸A抑制NLRP3炎性复合体/NF-κB活化减轻胶原诱导型关节炎大鼠炎症反应 [J]. 中国药理学通报, 2019, 35(10): 1415-1419.
[39] Chen Y L, Hwang T L, Yu H P,.and its bioactive component 3,5-dicaffeoylquinic acid protected mice from lipopolysaccharide-induced acute lung injury [J]., 2016, 6(1): 34243.
[40] Wang Q, Xiao L. Isochlorogenic acid A attenuates acute lung injury induced by LPS via Nf-κB/NLRP3 signaling pathway [J]., 2019, 11(11): 7018-7026.
[41] 邓颖颖, 胡宗苗, 周园里, 等. 双黄连注射剂中1,3-二咖啡酰奎宁酸致敏家兔后血清中特异性抗体的测定 [J]. 中国药师, 2017, 20(8): 1337-1339.
[42] 牛艺璇, 赵庆春, 李永明, 等. 基于实验筛选和网络药理学研究二咖啡酰奎宁酸抗过敏性鼻炎的作用机制 [J]. 中国现代应用药学, 2021, 38(17): 2070-2078.
[43] 颜欢, 邱琛, 钟凯, 等. 金银花花蕾中3,5-二咖啡酰奎宁酸对α-葡萄糖苷酶抑制作用的研究 [J]. 现代食品科技, 2015, 31(7): 44-49.
[44] Tong J, Ma B X, Ge L L,. Dicaffeoylquinic acid-enriched fraction ofseeds attenuates experimental type 1 diabetes via multipathway protection [J]., 2015, 63(50): 10791-10802.
[45] Etemadi-Tajbakhsh N, Faramarzi M A, Delnavazi M R. 1,5-dicaffeoylquinic acid, an α-glucosidase inhibitor from the root ofD. Don [J]., 2020, 15(5): 429-436.
[46] 张华婷, 王源, 阮克锋, 等. 中药牛蒡子中的α-葡萄糖苷酶抑制剂研究 [J]. 中药新药与临床药理, 2020, 31(2): 163-168.
[47] 卢桃, 尹忠平, 彭大勇, 等. 甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用 [J]. 食品工业科技, 2017, 38(8): 161-166.
[48] 朱晓琳, 刘跃钧, 陆敏, 等. 马兰中酚类的分离纯化及其抑制蛋白糖基化的研究 [J]. 食品科学, 2015, 36(5): 61-66.
[49] 吴崇明, 栾红, 王帅, 等. 露兜簕来源咖啡酰奎宁酸抑制HepG2肝细胞脂质积聚并调节脂代谢相关基因的表达 [J]. 药学学报, 2015, 50(3): 278-283.
[50] Raineri A, Campagnari R, Dal Toso R,. 3,5-dicaffeoylquinic acid lowers 3T3-L1 mitotic clonal expansion and adipocyte differentiation by enhancing heme oxygenase-1 expression [J]., 2021, 26(16): 5027.
[51] 戴国梁, 马世堂, 刘史佳, 等. 二咖啡酰奎宁酸与人血浆阿司匹林酯酶的分子对接 [J]. 中成药, 2014, 36(9): 1901-1905.
[52] Chang W C, Hsu F L. Inhibition of platelet activation and endothelial cell injury by polyphenolic compounds isolated fromThunb [J]., 1992, 45(4): 307-312.
[53] Satake T, Kamiya K, An Y,. The anti-thrombotic active constituents from[J]., 2007, 30(5): 935-940.
[54] King P J, Ma G, Miao W,. Structure-activity relationships: Analogues of the dicaffeoylquinic and dicaffeoyltartaric acids as potent inhibitors of human immunodeficiency virus type 1 integrase and replication [J]., 1999, 42(3): 497-509.
[55] Hu Z J, Chen D G, Dong L X,. Prediction of the interaction of HIV-1 integrase and its dicaffeoylquinic acid inhibitor through molecular modeling approach [J]., 2010, 20(1 Suppl 1): S1-S45-9.
[56] 董俊兴, 汤仲明, 米志宝, 等. 二咖啡酰奎宁酸在治疗乙型肝炎及与逆转录病毒有关疾病中的用途及新咖啡酰奎宁酸衍生物: 中国, CN1175411 [P]. 2002-07-17.
[57] 杨岸奇, 李朝晖, 张善文. 异绿原酸在畜牧生产的应用前景 [J]. 湖南饲料, 2017(4): 46-48.
[58] Hao B J, Wu Y H, Wang J G,. Hepatoprotective and antiviral properties of isochlorogenic acid A fromagainst hepatitis B virus infection [J]., 2012, 144(1): 190-194.
[59] Ma J N, Bolraa S, Ji M,. Quantification and antioxidant and anti-HCV activities of the constituents from the inflorescences ofand[J]., 2016, 30(5): 590-594.
[60] Shah S, Chaple D, Arora S,. Prospecting forto treat COVID-19 via in silico molecular docking models of the SARS-CoV-2 [J]., 2022, 40(12): 5643-5652.
[61] Singh R, Bhardwaj V K, Sharma J,. Identification of potential plant bioactive as SARS-CoV-2 Spike protein and human ACE2 fusion inhibitors [J]., 2021, 136: 104631.
[62] Bharadwaj S, El-Kafrawy S A, Alandijany T A,. Structure-based identification of natural products as SARS-CoV-2 Mproantagonist fromusing computational approaches [J]., 2021, 13(2): 305.
[63] 陶鑫, 张婷婷, 曹美娇, 等. 苍耳草的酚酸成分及其抗菌作用研究 [J]. 中药材, 2017, 40(6): 1326-1330.
[64] 朱文卿, 李玲玉, 张利, 等. 咖啡酰奎宁酸类化合物抑菌活性的网络药理学研究 [J]. 食品工业科技, 2021, 42(13): 11-20.
[65] 霍锦双, 隋伟策, 孙红男, 等. 甘薯茎叶多酚类物质的组分构成及抑菌活性 [J]. 新疆农业科学, 2021, 58(3): 556-564.
[66] Han J, Lv Q Y, Jin S Y,. Comparison of anti-bacterial activity of three types of di--caffeoylquinic acids inflowers based on microcalorimetry [J]., 2014, 12(2): 108-113.
[67] 李更森, 涂荣祖, 洪训宇, 等. 异绿原酸联合抗生素对铜绿假单胞菌-烟曲霉混合生物被膜的体外协同抑菌作用 [J]. 中华微生物学和免疫学杂志, 2020, 40(10): 763-767.
[68] 周煜航. 1,3-二咖啡酰奎宁酸对乳腺癌细胞增殖、转移抑制作用分子机制的研究 [D]. 合肥: 安徽大学, 2020.
[69] Zhou Y H, Fu X, Guan Y Q,. 1,3-dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway [J]., 2020, 172: 113752.
[70] 王明彦. 苦丁茶中二咖啡酰基奎宁酸对人肿瘤细胞的体外抑制作用及其机制研究 [D]. 武汉: 湖北中医药大学, 2014.
[71] Lodise O, Patil K, Karshenboym I,. Inhibition of prostate cancer cells by 4, 5-dicaffeoylquinic acid through cell cycle arrest [J]., 2019, 2019: 4520645.
[72] 施琦渊, 吴家琪, 於佳露, 等. 3,5--二咖啡酰基奎宁酸的制备及其对HeLa细胞的抗增殖活性研究 [J]. 中国现代应用药学, 2019, 36(14): 1738-1742.
[73] 孙燕荣, 董俊兴, 吕秋军, 等. 二咖啡酰奎宁酸对大鼠肝原代细胞保护作用的研究 [J]. 解放军药学学报, 2004, 20(2): 81-84.
[74] 刘鑫, 牛子冉, 梅丹, 等. 异绿原酸B对肝损伤小鼠的保护作用及其机制 [J]. 医药导报, 2020, 39(7): 895-899.
[75] 韩盟帝. 蒙药蓝盆花血清药理学、血清指纹图谱和主要成分药代动力学研究 [D]. 呼和浩特: 内蒙古医科大学, 2019.
[76] 孙燕荣, 董俊兴, 吴曙光. 二咖啡酰奎宁酸对成纤维细胞增殖与功能的影响 [J]. 生命科学研究, 2001, 5(4): 355-357.
[77] 孙燕荣, 董俊兴, 吕秋军, 等. 二咖啡酰奎宁酸抗肝纤维化及脂质过氧化作用的实验研究 [J]. 军事医学科学院院刊, 2002, 26(1): 39-42.
[78] 孙燕荣. 二咖啡酰奎宁酸抗实验性肝损伤及肝纤维化的研究 [D]. 广州: 第一军医大学, 2001.
[79] Liu X, Huang K, Niu Z R,. Protective effect of isochlorogenic acid B on liver fibrosis in non-alcoholic steatohepatitis of mice [J]., 2019, 124(2): 144-153.
[80] 褚晓凡, 亓传洁, 付学军. 二咖啡酰奎宁酸对大鼠脑缺血神经行为学和海马神经细胞凋亡的影响 [A] // 第九次全国神经病学学术大会论文汇编 [C]. 广州: 中华医学会, 2006: 1.
[81] Xiao H B, Cao X, Wang L,. 1, 5-dicaffeoylquinic acid protects primary neurons from amyloid β 1-42-induced apoptosis via PI3K/Akt signaling pathway [J]., 2011, 124(17): 2628-2635.
[82] 盛艳梅, 唐绍微, 张静, 等. 3,5-二咖啡酰奎宁酸体外透血脑屏障能力及抗大鼠脑缺血再灌注损伤作用研究 [J]. 中药药理与临床, 2016, 32(6): 26-29.
[83] 张静, 王毓杰, 盛艳梅, 等. 灯盏细辛保护脑神经活性成分的研究 [J]. 华西药学杂志, 2011, 26(3): 208-211.
[84] Lim D W, Kim M, Yoon M,. 1, 3-dicaffeoylquinic acid as an active compound ofroot extract ameliorates depressive-like behavior by regulating hippocampal nitric oxide synthesis in ovariectomized mice [J]., 2021, 10(8): 1281.
[85] Carlotto J, da Silva L M, Dartora N,. Identification of a dicaffeoylquinic acid isomer fromwith a potent anti-ulcer activity [J]., 2015, 135: 50-57.
[86] Wu Q Z, Zhao D X, Xiang J,. Antitussive, expectorant, and anti-inflammatory activities of four caffeoylquinic acids isolated from[J]., 2016, 54(7): 1117-1124.
[87] dos Santos M D, Gobbo-Neto L, Albarella L,. Analgesic activity of di-caffeoylquinic acids from roots of(da serra) [J]., 2005, 96(3): 545-549.
[88] 谢旻皓, 王晴川, 徐冬兰, 等. 苦丁茶冬青苦丁茶提取物与3,5-双咖啡酰奎尼酸对肠道微生物体外发酵的影响 [J]. 食品科学, 2015, 36(17): 124-129.
[89] Li R, Tao M F, Wu T,. A promising strategy for investigating the anti-aging effect of natural compounds: A case study of caffeoylquinic acids [J]., 2021, 12(18): 8583-8593.
[90] Shirzad M, Hamedi J, Motevaseli E,. Anti-elastase and anti-collagenase potential of Lactobacilli exopolysaccharides on human fibroblast [J]., 2018, 46(Suppl1): 1051-1061.
[91] Teramachi F, Koyano T, Kowithayakorn T,. Collagenase inhibitory quinic acid esters from-caprae [J]., 2005, 68(5): 794-796.
[92] 柯细彤, 章瑜芳, 朱兆云, 等. 灯盏细辛中咖啡酰奎宁酸防治缺血性脑卒中的研究进展[J]. 中草药, 2017, 48(3): 609-615.
Research progress on plant origins, pharmacokinetics, and biological activities of natural dicaffeoylquinic acids
HAN Ya-ru1, MA Guo-li1, HAN Ya-long2, GAO Jia-min1, SHE Zhan-fei1, FENG Yu-bao1, XIAO Bin1
1. Laboratory of Clinical Pharmacy, Ordos School of Clinical Medicine, Inner Mongolia Medical University, Ordos 017000, China 2. The Affiliated Tumor Hospital of Harbin Medical University, Harbin 150040, China
With the continuous improvement of the living standard, high-fat and high-protein diet leading to cancer, cardiovascular and cerebrovascular diseases, and allergic diseases have become the main causes of threats to human health, of which antioxidant and free radical scavenging is one of the important prevention and treatment methods. Dicaffeoylquinic acids are widely distributed in nature, with polyphenol structure and various physiological functions including antioxidant, anti-inflammatory, hypoglycemic, lipid-lowering, platelet inhibitory, antimicrobial and anti-tumor, etc., which have attracted extensive attention from many scholars at home and abroad. Due to the influence of physicochemical properties and pharmacokinetics, its drug development is not perfect. In this paper, the plant origins, pharmacokinetics, and biological activities of natural dicaffeoylquinic acids were reviewed to provide basis for their development and utilization.
dicaffeoylquinic acids; cardiovascular and cerebrovascular diseases; plant origin; pharmacokinetics; antioxidation; development and utilization
R285
A
0253 - 2670(2023)04 - 1285 - 14
10.7501/j.issn.0253-2670.2023.04.030
2022-09-12
国家自然科学基金地区基金项目(82260822);中央引导地方科技发展资金项目(2020ZY0036);中国科学院“西部之光”青年学者资助项目(人字[2020] 82号);内蒙古自治区自然科学基金面上项目(2022MS08034);内蒙古自治区卫生健康委员会医疗卫生科技计划项目(202202379);鄂尔多斯市科技计划项目(鄂财教指[2019] 501号)
韩亚如(1997—),女,硕士研究生,研究方向为心血管内科学。E-mail: hyr1358545397@163.com
冯玉宝,男,主任医师,教授,硕士生导师,从事心血管内科学研究。E-mail: xnkfyb@sina.com
肖 斌,男,主任中药师,理学博士,硕士生导师,从事临床药学研究。E-mail: michael-bin@163.com
[责任编辑 赵慧亮]
