条斑紫菜SOD基因家族的全基因组分析及温度和失水胁迫下表达研究❋
2023-02-21管晓伟王冬梅曲伟华
管晓伟, 王冬梅, 陈 睿, 曲伟华
(中国海洋大学海洋生命学院, 海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003)
紫菜作为一种典型的红藻品种,是世界上最重要的海藻经济作物之一,在东亚国家中被广泛养殖[1]。条斑紫菜主要分布在潮间带,由于潮汐作用和大风的影响,周期性地经历潮汐变化引起渗透压、温度和光照的胁迫[2-3],这些胁迫通常会使条斑紫菜产生活性氧(Reactive oxygen species, ROS)。过量的活性氧,比如超氧阴离子(O2·—)、过氧化氢(H2O2)和单线态氧(1O2),会导致膜损伤、蛋白质氧化和DNA损伤,甚至导致无法修复的代谢功能障碍和细胞死亡,并对植物的生长产生不利影响[4]。植物体内存在着活跃的酶促防御系统,其中超氧化物歧化酶(SOD)是最重要的酶,可以将有毒的超氧阴离子歧化为O2和H2O2,过氧化物酶和氧化物酶可以进一步催化H2O2变成H2O[5-6]。
SOD广泛存在于真核与原核生物中,根据其活性中心结合的金属辅因子,可分为4类:Cu/Zn-SOD、Fe-SOD、Mn-SOD和Ni-SOD[7]。Fe-SOD是最原始的SOD,与Mn-SOD有较高的同源性,存在于原生生物和少数植物的叶绿体中,而Mn-SOD分布在线粒体和细胞质中;植物中,Cu/Zn-SOD主要定位在高等植物细胞质和叶绿体;Ni-SOD发现较晚,目前仅在链霉菌和蓝藻中发现,与其他蛋白的重复序列较少[8-11]。
在一些藻类受到胁迫时,SOD的活性将发生变化。赤潮异弯藻中SOD活性在响应紫外辐射增强时变化明显;在重金属胁迫下,巴夫藻中SOD活性增加[12]。在条斑紫菜赤腐病的免疫过程中SOD的表达量上调[13]。本文基于本实验室前期获得的条斑紫菜基因组数据库,对条斑紫菜中SOD基因家族进行全基因组鉴定和分析,进一步研究SOD基因在温度和失水胁迫下的转录表达变化,并对表达丰度高的SOD基因进行qPCR验证,为探究条斑紫菜SOD基因家族的生物学特性和抗逆特性提供了有价值的信息,同时为分子育种工作提供理论依据。
1 材料与方法
1.1 实验材料
实验室培养的纯系条斑紫菜(Pyropiayezoensis)RZ。
1.2 方法
1.2.1 条斑紫菜中SOD基因的鉴定 从Pfam数据库(https://pfam.xfam.org/)下载Cu/Zn-SOD(PF00080)和Fe-SOD(PF02777和PF00081)的隐马尔可夫模型(Hindden Markov Model,HMM)[14],通过hmmsearch在本实验室建立的条斑紫菜基因组本地数据库中检索条斑紫菜中SOD蛋白序列(阈值E<1×10-20);根据检索到的SOD蛋白序列构建条斑紫菜特异性的HMM模型,利用该模型在数据库中再次检索并提取条斑紫菜SOD蛋白序列。将2次检索到的蛋白序列合并,手动去除重复序列,并将这些序列上传到NCBI-CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),确认提取出的蛋白含有SOD结构域。使用SnapGene分析条斑紫菜SOD蛋白的等电点(pI)及分子量(Mw),并通过在线网站WoLF PSORT tool(https://wolfpsort.hgc.jp/)、CELLO v2.5 ( http://cello.life.nctu.edu.tw/ )和PredAlgo ( https://giavap-genomes.ibpc.fr/cgi-bin/predalgodb.perl?page=main )共同预测条斑紫菜中SOD基因的亚细胞定位。若在2种以上网站中显示同一预测结果,则该结果为正确预测结果。
1.2.2 条斑紫菜SOD家族系统进化分析 系统进化分析中条斑紫菜(P.yezoensis)的相关序列来自本实验室测序获得的基因组,拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)和大叶藻(Zosteramarina)的SOD相关序列来自文献[15]。使用Mega7构建条斑紫菜和以上物种的SOD蛋白序列构建系统进化树,建树方法为最大似然法,迭代1 000次。
1.2.3 条斑紫菜SOD蛋白结构分析 使用在线网站MEME(http://meme-suite.org/index.html)对SOD蛋白保守结构域进行分析和预测,设置分布模型为anr、预测保守基序数量为10、最短motif设置为6 aa、最长motif设置为50 aa。根据条斑紫菜SOD家族成员的蛋白序列,通过在线网站Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对SOD蛋白的二级结构进行分析,并使用SWISS-MODEL(https://swissmodel.expasy.org/ )预测SOD蛋白的三级结构。
1.2.4 染色体定位和基因复制分析 利用TBtools对基因家族成员进行染色体定位分析及可视化。为探究PySOD家族的基因复制情况,本研究进一步利用McScanX进行基因组复制事件分析,并利用DnaSP6计算Ka/Ks值。根据条斑紫菜SOD基因家族的基因组信息和转录组ID进行基因结构注释,使用TBtools对条斑紫菜GFF注释文件中获得的SOD基因家族的基因位置信息进行分析,获取基因内含子-外显子分布的信息。
1.2.5 条斑紫菜SOD基因启动子区域顺式作用元件预测 调取条斑紫菜中的SOD基因起始密码子上游序列(2 000 bp)并上传至PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测条斑紫菜启动子区域的顺式作用元件,并通过TBtools将预测结果可视化。
1.2.6 条斑紫菜SOD基因在环境胁迫下的表达模式分析 基于实验室前期所获得的条斑紫菜在温度[16]和失水胁迫下的转录组数据,探究条斑紫菜SOD基因在不同胁迫下的表达模式。使用BWKCloud平台(http://www.biomarker.com.cn/biocloud)对不同温度胁迫条件下SOD基因的log2(差异倍数)值绘制热图(在不同胁迫条件下FPKM值均小于5的SOD基因不参与热图的绘制),其中温度胁迫和失水胁迫差异倍数是实验组与对照组的比值,复水组的差异倍数是复水组同80%失水组的比值。
1.2.7 环境胁迫材料处理及定量验证 其他培养条件不变,分别收集0、8、10和24 ℃条件下培养6 h的条斑紫菜叶状体材料;在10 ℃培养箱中恒温条件下,收集失水0%、30%、50%、80%和失水80%后复水30 min的条斑紫菜叶状体材料。条斑紫菜的失水率按以下公式计算:
式中:WL为藻体失水率;FW为藻体鲜质量;TW为失水后藻体质量;DW为60 ℃下将新鲜藻体烘干至藻体质量不再变化时测得的质量[17]。
提取RNA后进行反转录,得到相关样品的cDNA。选取条斑紫菜SOD家族中表达丰度较高的成员(PySOD4、PySOD7和PySOD8)验证PySOD在不同环境胁迫下的表达模式。以10 ℃培养的未失水材料为对照组,温度胁迫或失水胁迫的材料为实验组,通过qPCR技术检测目的基因在不同环境胁迫下的表达变化,引物序列如表1所示。选用PyUBC作为内参基因,用△CT法计算目的基因在不同环境胁迫下的相对表达量[18]。

表1 qPCR引物序列
2 结果
2.1 条斑紫菜SOD基因家族成员的鉴定
通过HMM搜索,最终在条斑紫菜(P.yezoensis,Py)基因组中鉴定出12个SOD基因,依次命名为PySOD1~PySOD12(见表2)。这些基因的cDNA序列长度在294~1 132 bp之间,编码的氨基酸长度在97~307 aa之间;所编码的蛋白质分子量为10.77~29.17 kDa,PI为3.53~11.87。根据不同网站的亚细胞定位预测结果, 有5个蛋白定位于叶绿体; 1个定位于线粒体;1个属于分泌途径;4个蛋白的定位在不同预测网站中未获得一致结果。
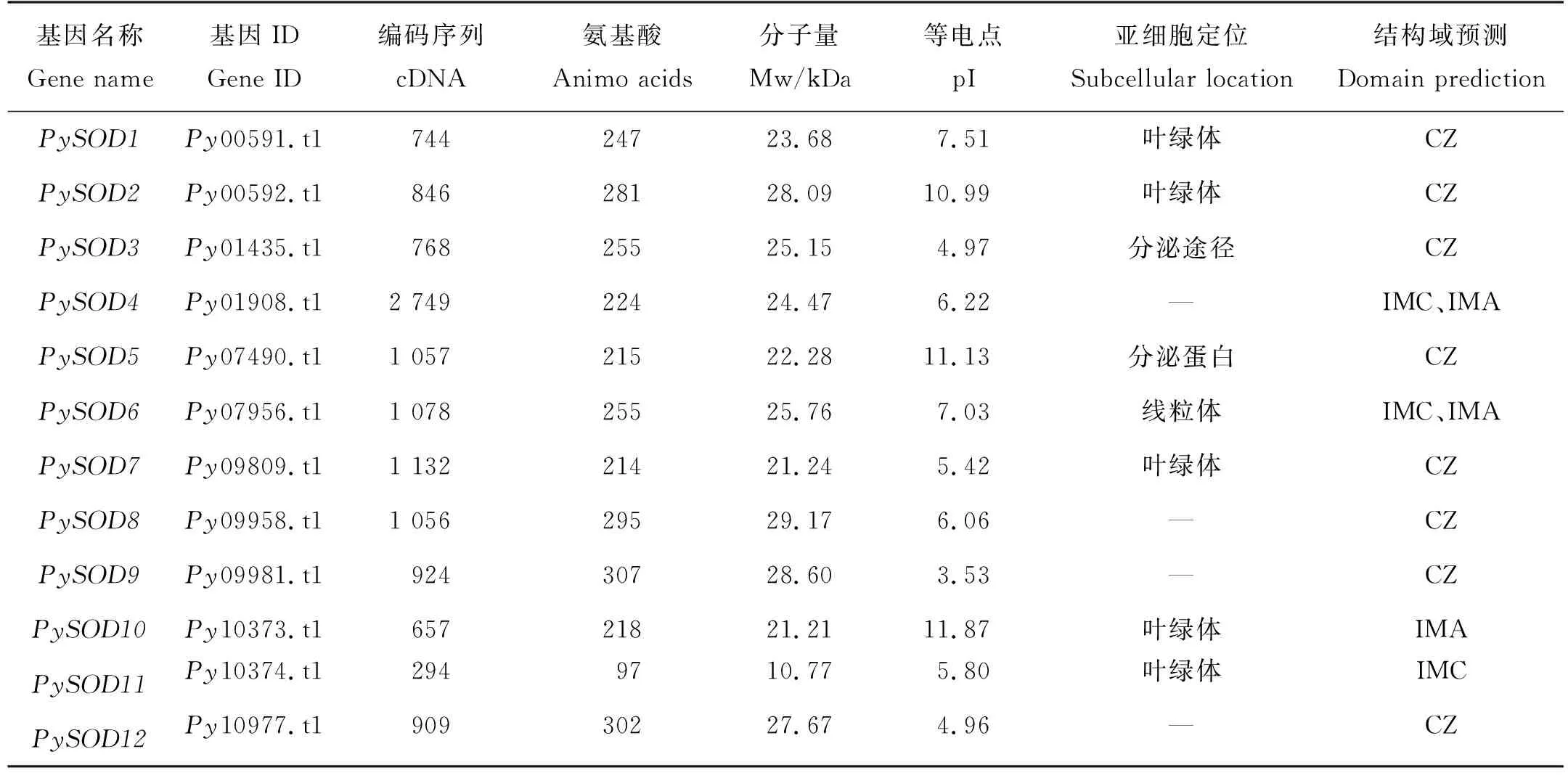
表2 条斑紫菜SOD基因和所编码蛋白的特征
2.2 条斑紫菜SOD家族系统进化分析
将条斑紫菜中的SOD蛋白质序列与来自拟南芥(A.thaliana,At)、水稻(O.sativa,Os)和大叶藻(Z.marina,Zm)中的22条SOD蛋白序列一起进行进化分析,根据聚类结果可将其分为3类(见图1)。PySOD1、PySOD2、PySOD3、PySOD5、PySOD7、PySOD8、PySOD9、PySOD12和其他物种中的Cu/Zn-SOD类蛋白聚在一起,并且具有Cu/Zn-SOD结构域,属于条斑紫菜中的Cu/Zn-SOD;PySOD4、PySOD6、PySOD11和其他物种中的Mn-SOD类蛋白聚在一起,并且具有Fe-Mn SOD α-折叠结构域和碳端结构域,属于条斑紫菜中的Mn-SOD;PySOD10和其他物种中的Fe-SOD类蛋白聚在一起,并且具有Fe-Mn SOD碳端结构域,属于条斑紫菜中的Fe-SOD。
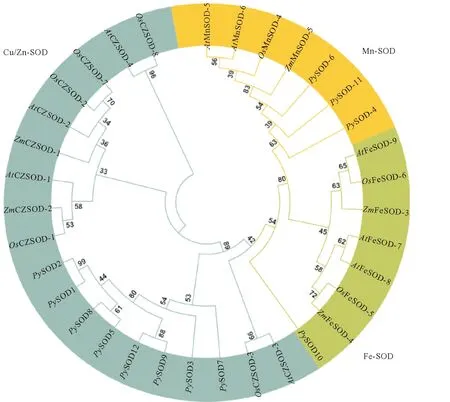
图1 条斑紫菜SOD家族系统进化分析
2.3 条斑紫菜SOD蛋白结构预测
条斑紫菜保守基序分析显示(见图2),Cu/Zn-SOD成员蛋白保守基序均包含motif1、motif2、motif3、motif9和motif10,这5个motif在Cu/Zn-SOD中高度保守。此外,除PySOD3和PySOD7外其他Cu/Zn-SOD中均含有motif8,保守性较高。Fe-SOD和Mn-SOD成员中,Mn-SOD成员中都存在motif4和9,Fe-SOD成员PySOD10和Mn-SOD成员PySOD4、PySOD6都包含motif5。
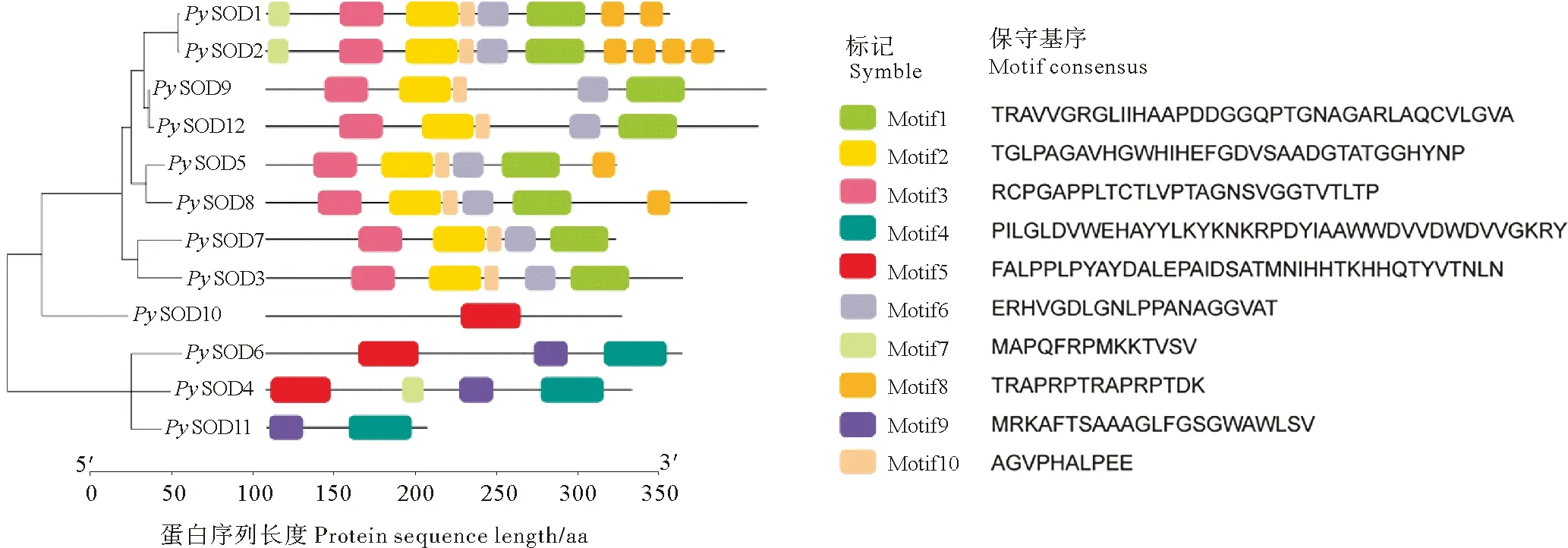
图2 条斑紫菜SOD家族保守基序分析
在对条斑紫菜SOD蛋白的二级结构预测中(见表3),Fe-SOD和Mn-SOD成员中α螺旋占比为44%~68%,而Cu/Zn-SOD成员中α螺旋占比均未超过13%;Fe和Mn-SOD成员中,除PySOD11中β折叠占比22%,其余成员占比均未超过10%;Cu/Zn-SOD成员中β折叠最低占比为16%。在对PySOD蛋白的三级结构预测中(见图3),PySOD1、PySOD2、PySOD3、PySOD7和PySOD8具有一个铜离子结合位点;PySOD4和PySOD6具有一个锰离子结合位点;PySOD5具有1个铜离子和1个锌离子结合位点;PySOD9具有2个锌离子结合位点;PySOD12具有一个锌离子结合位点。
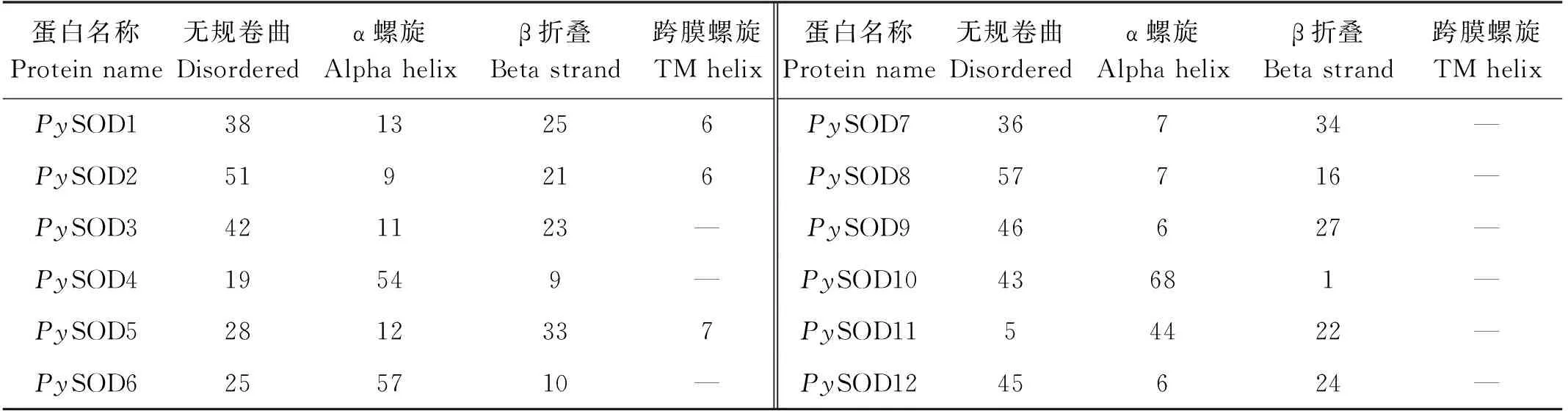
表3 条斑紫菜SOD蛋白二级结构预测
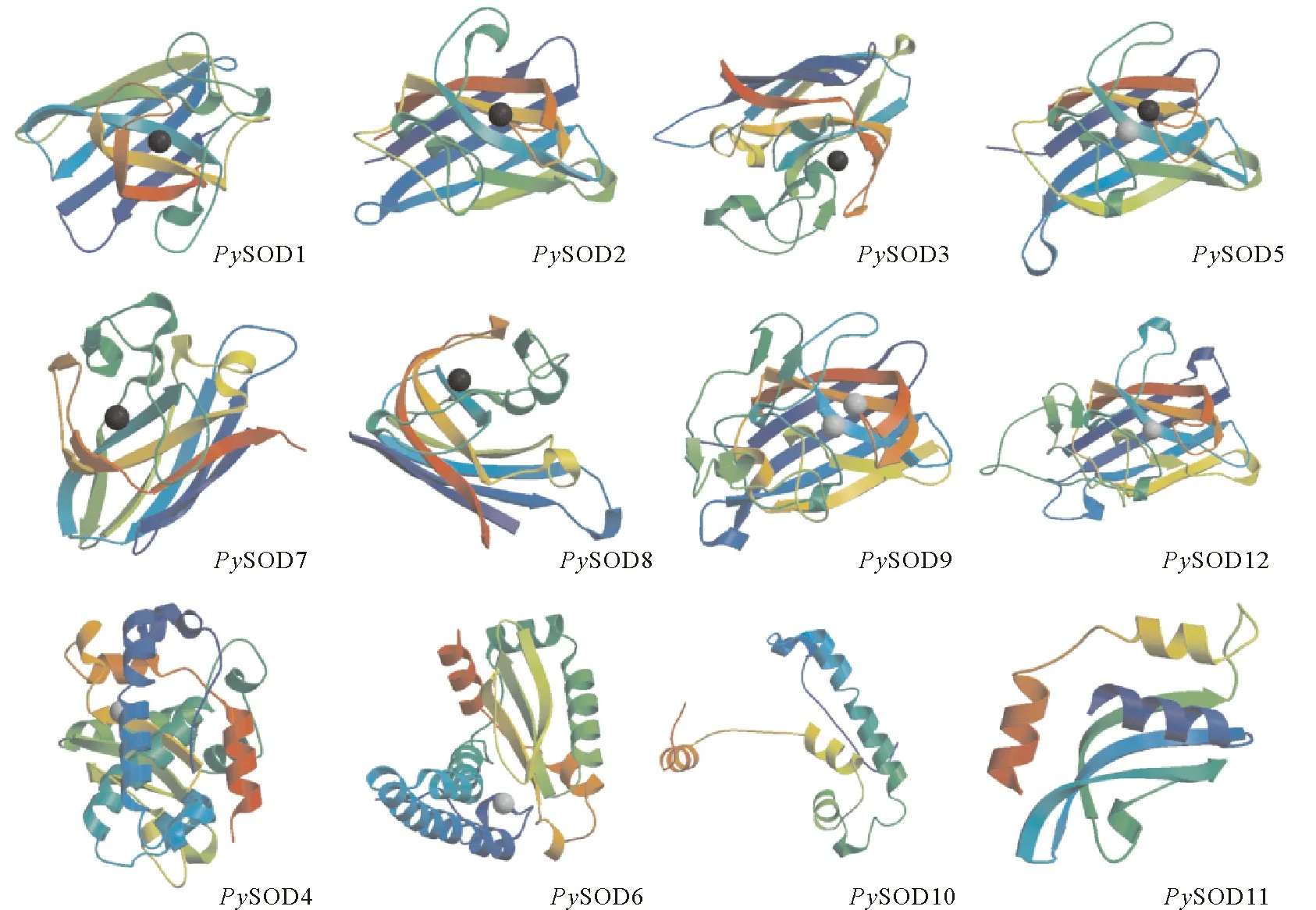
图3 条斑紫菜SOD蛋白家族三级结构预测
2.4 条斑紫菜SOD基因染色体定位和基因复制分析
基因在染色体上的分布与其生物学功能有一定的相关性。染色体定位结果(见图4)表明,PySOD4、PySOD7和PySOD12定位于条斑紫菜1号染色体;PySOD1、PySOD2、PySOD3、PySOD5、PySOD10和PySOD11定位于2号染色体;PySOD6、PySOD8和PySOD9定位在3号染色体。基因复制分析结果表明,PySOD1和PySOD2是串联重复基因,其非同义替换位点替换率Ka=0.069 2、同义替换位点替换率Ks=0.078 3,所以Ka/Ks=0.883 7,Ka/Ks<1。这表明PySOD1和PySOD2基因在进化中受纯化选择。如图5所示,条斑紫菜SOD基因结构说明,Cu/Zn-SOD成员基因结构简单,8个基因均无内含子, Fe-SOD和Mn-SOD成员中,PySOD4、PySOD10和PySOD11具有3个外显子和2个内含子;PySOD6含有2个外显子和1个内含子。
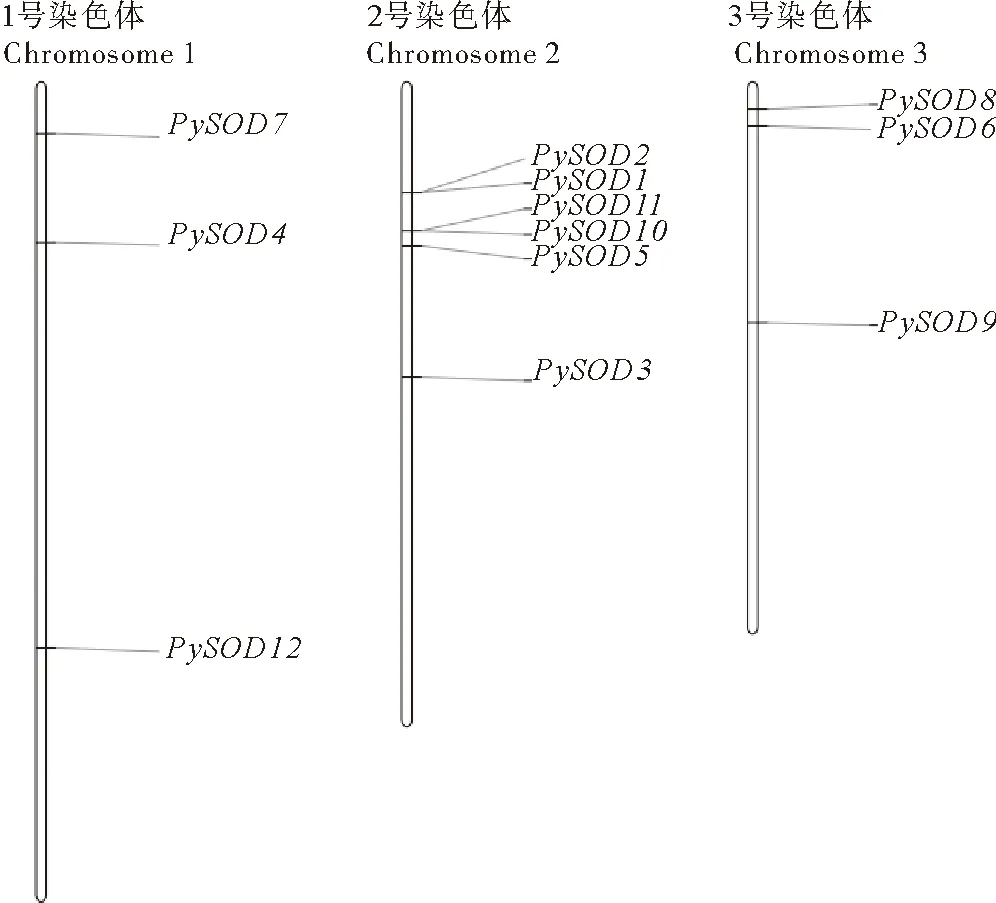
图4 条斑紫菜SOD基因家族染色体定位
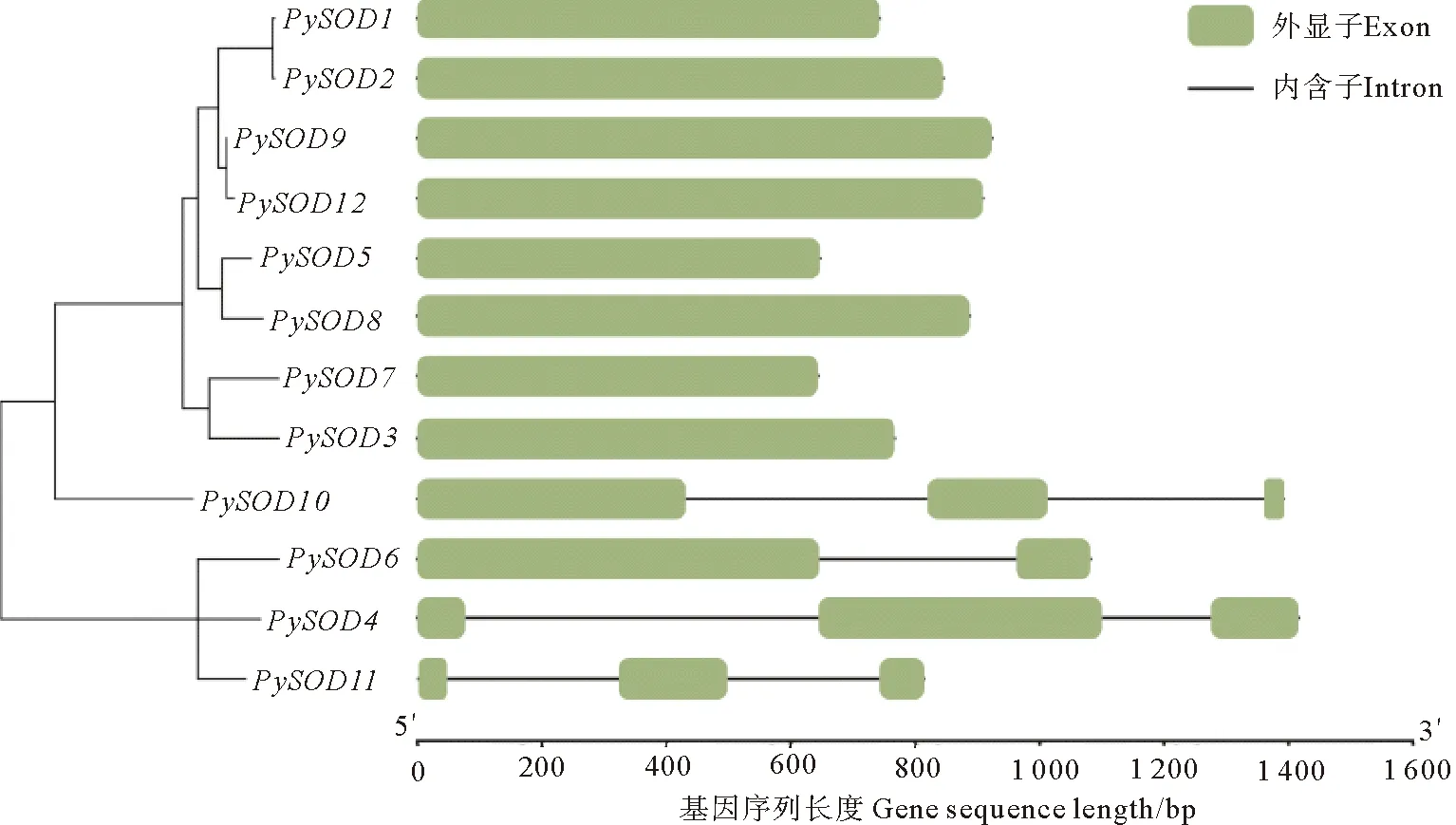
图5 条斑紫菜SOD基因结构示意图
2.5 条斑紫菜SOD基因顺式作用元件分析
为进一步探索条斑紫菜中SOD基因的转录调控机制,调取SOD基因家族成员起始密码子上游2 000 bp的序列来预测启动子区域顺式作用元件(见图6)。条斑紫菜SOD基因家族成员有大量与激素响应相关的顺式作用元件,包括脱落酸响应元件(ABRE)、生长素响应元件(TGA-box)、茉莉酸甲酯响应元件(CGTCA-motif)、赤霉素响应元件(GARE-motif)和水杨酸响应元件(TCA-element);与逆境响应相关的顺
式作用元件包括光响应元件(Sp1、G-box和ACE等)、MYBHv1 结合位点相关元件(CCAAT-box)、低温响应元件(LTR)、干旱诱导作用相关元件(MBS)和缺氧性诱导作用相关元件(GC-motif)。此外,还有一些与生长发育相关的顺式作用元件,包括玉米醇溶蛋白代谢调节相关元件(O2-site)、分生组织表达相关元件(CAT-box)、胚乳表达相关元件(GCN4_motif)和分化相关元件(HD-Zip1)。

图6 条斑紫菜SOD基因家族顺式作用元件分布
2.6 条斑紫菜SOD基因在温度胁迫下的表达模式分析
如图7所示,在受到不同的胁迫时,PySOD会有不同的表达模式。在受到高温胁迫时,PySOD4、PySOD5和PySOD9表达量上调,PySOD6和PySOD11表达量变化不大,其他3个PySOD表达量下调;受到0 ℃低温胁迫时,PySOD7表达量上调,PySOD5和PySOD6表达量变化不大,其他5个PySOD表达下调;受到-8 ℃的低温胁迫时,PySOD7表达量上调,PySOD5、PySOD8和PySOD9表达量变化不大,其他4个PySOD表达下调。在受到失水胁迫时,PySOD5、PySOD7和PySOD9在不同失水程度的条斑紫菜中表达量均上调;PySOD8在中、高度失水(失水50%、80%)时表达量上调;PySOD4在中度失水时表达下调,其他失水程度变化量不大;PySOD6在轻度失水(30%)时变化量不大,在中、高度失水时表达下调;PySOD10在不同失水程度时表达量变化均不大;PySOD11在不同失水程度的表达量均下调。条斑紫菜在失水80%后复水30 min时,PySOD5、PySOD6和PySOD11表达量变化不大,其他5个PySOD表达量下调,不存在表达量上调的PySOD,推测这可能与失水胁迫的解除相关。PySOD1、PySOD2、PySOD3和PySOD12在温度和失水胁迫下FPKM值均小于5,不参与热图绘制。
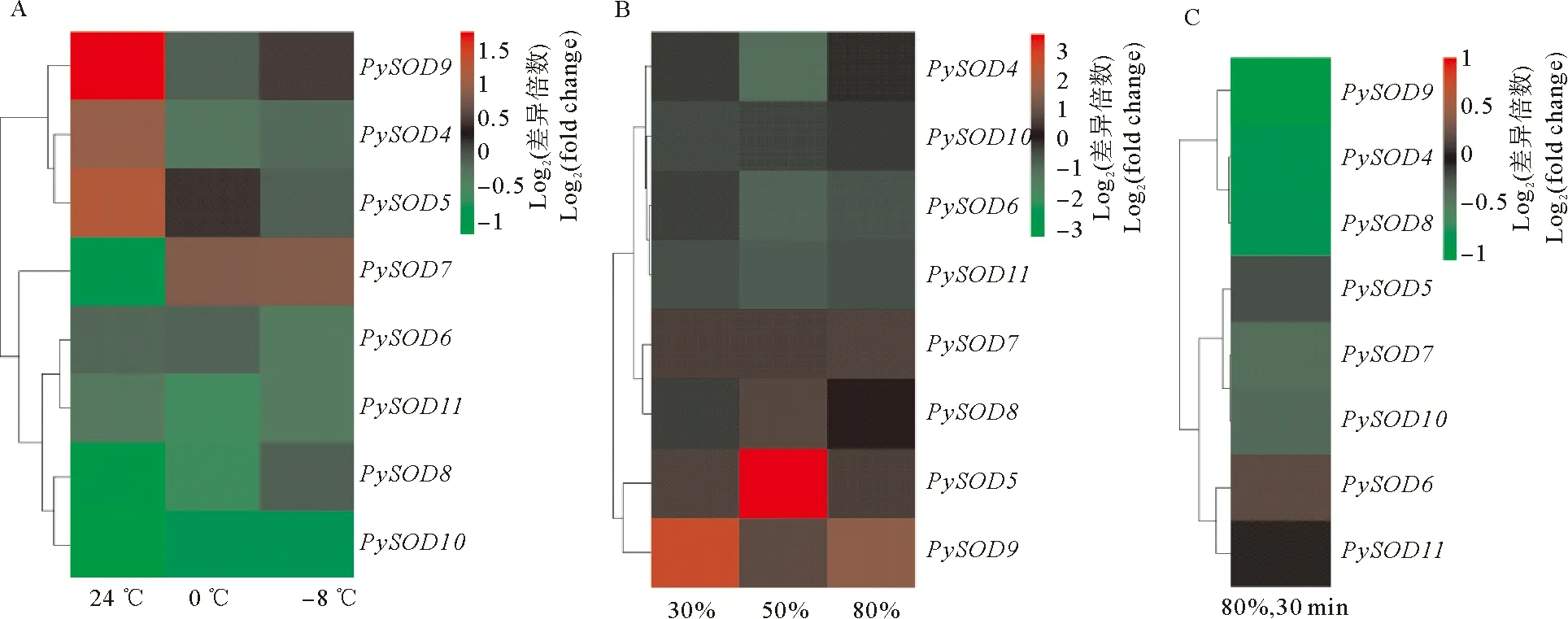
(A:不同温度胁迫;B:不同失水胁迫;C:失水80%后复水30 min。A: different temperature stresses; B:different dehydration stress; C: rehydrate for 30 min after 80% dehydration.)
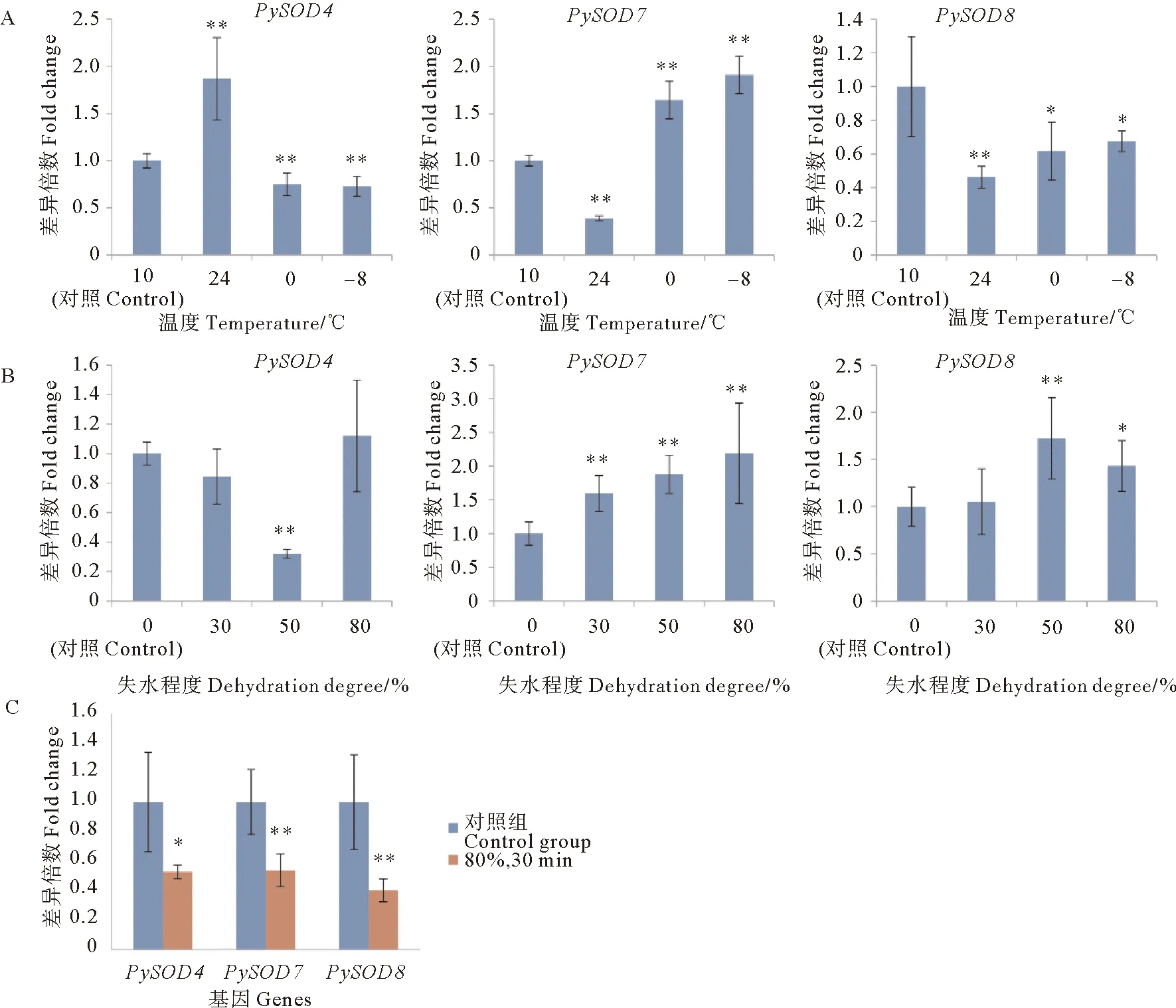
本研究对表达丰度高的PySOD4、PySOD7和PySOD8采用qPCR方法,对其在温度和失水胁迫下的转录动态进行验证。结果显示,这3个基因与本研究在转录组数据中观察到的转录表达变化一致。PySOD4在24 ℃高温胁迫时表达量极显著上调,但在0 ℃和-8 ℃时表达量极显著下调;在中度失水胁迫时,表达量极显著下调,轻度和高度失水胁迫时表达量无显著变化。PySOD7在24 ℃高温胁迫时表达量极显著下调,但在0 和-8 ℃时表达量极显著上调,并且随温度降低,表达量增加;在不同程度的失水胁迫下,PySOD7的表达量随失水程度的增加而增加,且表达量均呈极显著上调。PySOD8在受到不同温度胁迫时相对表达量均显著下调;在受到轻度失水胁迫时,表达量变化无显著差异,在失水50%时表达量极显著上调,失水80%时表达量显著上调。当条斑紫菜失水率达到80%后复水30 min,PySOD4表达量显著下调,PySOD7和PySOD8表达量极显著下调(见图8)。
(:0.01 许多研究表明,ROS对细胞有毒害作用,其浓度增加会引起DNA链断裂、蛋白降解,并破坏细胞结构和功能[19]。生物在长期进化过程中形成了可以清除活性氧的酶类和非酶类物质,以此完善抗氧化系统,使活性氧维持在较低水平,保障生物体正常生长代谢[20]。植物细胞中ROS的产生和清除是动态平衡的,但植物在受到高温、盐碱和重金属等非生物胁迫时,细胞内会产生大量的ROS[19],而SOD酶是清除活性氧过程中第一个起作用的抗氧化酶[21]。 条斑紫菜作为一种潮间带藻类,在生长过程中会受到很多胁迫,包括温度或者失水胁迫。温度胁迫会影响植物中的ROS平衡,在大叶藻中,温度过高或过低都会引起H2O2的增加,从而导致膜脂过氧化[15]。本研究观察到条斑紫菜受到温度胁迫时会提高SOD基因的转录表达,其中在高温胁迫下有3个SOD基因的转录呈现上调,低温下有1个SOD基因转录上调,高温胁迫下转录表达的SOD基因要多于低温胁迫,这与在角叉菜中的研究一致[22]。在高温胁迫下表达的PySOD包括Cu/Zn-SOD和Mn-SOD,低温胁迫下只有Cu/Zn-SOD表达,不同胁迫条件下表达的SOD基因也不同,说明在不同的温度胁迫条件下,PySOD响应调控的模式存在差异。 在低温胁迫和失水胁迫下表达量上调的SOD都属于Cu/Zn-SOD,条斑紫菜复水过程中所有的Cu/Zn-SOD表达下调,并且在高温胁迫中表达量上调的3种SOD,也有2种属于Cu/Zn-SOD。这些结果共同表明了,Cu/Zn-SOD在条斑紫菜的抗逆过程中发挥着更重要的作用。从内含子数量上看,Cu/Zn-SOD不含内含子,这很大程度上缩短了基因表达的过程,使条斑紫菜在面对胁迫时能快速表达SOD,减少胁迫带来的损害。Cu/Zn-SOD的三级结构也为其快速响应胁迫提供便利,Cu/Zn-SOD二级结构以β折叠为主,其活性位点位于β折叠外,这与其疏水界面一同保障Cu/Zn-SOD结构稳定性,从而可以快速进行催化功能[23]。 近期在玉米中发现,低温胁迫会促使脱落酸积累;而茉莉酸甲酯处理可以明显提高小麦幼苗细胞中的SOD酶活性[24-25]。在0和-8 ℃种低温胁迫下均上调表达的PySOD7被预测到有5种顺式作用元件,其中脱落酸和茉莉酸甲酯的响应元件可能在条斑紫菜低温胁迫响应时发挥重要作用。PySOD5、PySOD8和PySOD10被预测到含有低温响应的顺式作用元件,但在0 和-8 ℃低温胁迫过程中,这些基因表达量变化不大甚至下调。鉴于所使用的plantCARE是植物顺式作用元件的预测网站,这暗示条斑紫菜和植物的低温胁迫受到不同的转录调控。PySOD4、PySOD5和PySOD9响应高温胁迫表达,PySOD5和PySOD9的顺式作用元件种类基本相同,并且在低温胁迫下表达量变化不大,是响应高温胁迫的主要的Cu/Zn-SOD。同样,在失水条件下Cu/Zn-SOD表达量上调,其8种SOD基因顺式作用元件类型基本相同,这可能是因为受相同的分子机制调控。PySOD4是本文设置胁迫环境下唯一上调表达的Mn-SOD(高温胁迫下表达),并且PySOD4表达量的差异倍数小于PySOD9,说明Mn-SOD和Fe-SOD也能够响应环境胁迫,但不是主要发挥作用的SOD。 本研究首次对条斑紫菜SOD基因家族进行生物信息学分析,解析了条斑紫菜SOD基因家族的组成、分类、基因结构蛋白结构和进化特点,并进一步探究了PySOD基因在温度或失水胁迫下的表达变化,为进一步研究SOD基因潜在的生物学功能以及改良条斑紫菜育种提供了参考。3 讨论
4 结语
