STING受体在布鲁氏菌感染固有免疫中的作用机制研究进展
2023-02-20赵若楠赵世刚
赵若楠,赵世刚
1 布鲁氏菌及布鲁氏菌病
布鲁氏菌是一种革兰氏阴性球状杆菌,可感染哺乳动物并引起布鲁氏菌病。布鲁氏菌病是危害最大的人兽共患传染病之一,对人类健康和畜牧业发展造成了严重危害。目前,基于细菌学、致病性和宿主偏好,结合分子分型与全基因组测序,世界各地发现的布鲁氏菌共鉴定出12个生物种,包括6种“经典”和6种“新发现”布鲁氏菌[1]。在已知的布鲁氏菌生物种中,对人类最具致病性的包括羊种、牛种、猪种和犬种布鲁氏菌。该菌通过直接或间接接触受感染动物、食用生肉和未经煮沸或巴氏灭菌法处理的乳制品传播给人类。主要传播途径是消化道、皮肤、黏膜、呼吸道与血液和气溶胶之间的接触。布鲁氏菌的人际传播极为罕见。农民、牧民、屠宰场工人和兽医等畜牧业相关工作者感染率较高,呈现出职业相关性[2]。自21世纪以来,人类布鲁氏菌病发病率呈现急剧上升趋势。
布鲁氏菌病是一种多系统多脏器损伤性疾病,临床表现常不典型且比较复杂。主要症状为发热、乏力、多汗、食欲不振、体重减轻、肝脾及淋巴结肿大、肌肉疼痛、骨关节炎等器质性病变,其中发热和关节痛最为常见。该病的并发症也较多,常见的有神经血管、肌肉、骨关节、内分泌系统、泌尿生殖系统等病变,还可伴发一些罕见并发症,比如合并心内膜炎致脑栓塞、急性心肌梗死、热性惊厥、甲状腺危象及脑梗死,或者骨髓损伤、运动功能障碍等,严重影响了患者的身心健康和生活质量[3]。
人类布鲁氏菌病的发病机制复杂,目前尚无确切定论,多数学者将其归咎于自身免疫、免疫抑制、变态反应、内分泌紊乱以及免疫耐受等多因素的共同作用。目前已有的研究发现布鲁氏菌首先侵入吞噬细胞,如巨噬细胞、树突状细胞等[4],当细菌在淋巴结中繁殖生长,形成感染灶时,增殖到一定数量便会突破淋巴结屏障进入血液循环,人体将出现以发热为主要表现的菌血症、毒血症等[5]。研究表明,该菌能逃脱吞噬细胞的吞噬、杀伤功能,也可以抑制细胞凋亡和细胞免疫机制,如果它在吞噬细胞中存活并生长繁殖,将会导致长期的慢性感染[6]。
2 固有免疫
哺乳动物的免疫由固有免疫和适应性免疫两种主要的免疫系统控制,这两种免疫系统是对抗病原体入侵和维持宿主稳态的必要条件。布鲁氏菌入侵机体时,在宿主中首先激活固有免疫,产生多种炎症因子以清除细菌并控制感染,这在人体免疫防御中起到重要作用。固有免疫首先会利用一种受体来激活,这些受体可以识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular pattern,DAMPs)[7],最常见的PAMPs是脂多糖(lipopolysaccharide,LPS)、肽聚糖(peptidoglycan,PGN)、细菌脂蛋白、鞭毛蛋白和来自病毒、细菌、真菌和哺乳动物的核酸。宿主固有免疫系统可以通过多种病原模式识别受体(pattern recognition receptor,PRR)与这些PAMPs相互作用。目前,在布鲁氏菌中发现的PRR包括Toll样受体(Toll-like receptors,TLRs)、维甲酸诱导基因1样受体(RIG-I-like receptors ,RLRs)、核苷酸寡聚化结构域NOD样受体(NOD-like receptors,NLRs)和DNA受体[8],DNA受体又包括黑色素瘤缺乏因子2(Absent in melanoma 2,AIM2)和干扰素基因刺激因子(stimulator of interferon genes,STING)[9]。一个完整的微生物病原体显示一组PAMPs,激活宿主细胞中的多个PRR。这被认为是激活多个细胞内信号通路的第一步。因此,PAMPs与特定PRR相互作用后启动的信号转导通常介导转录因子的激活。被激活的转录因子转位到细胞核,最终导致炎症因子、I型干扰素(Interferon ,IFN)、趋化因子和其他化合物的表达,从而产生对抗感染的有效作用[10]。
在本文中,我们讨论布鲁氏菌感染的固有免疫机制中STING模式识别受体、传感通路、信号级联的调节及受体所发挥的作用,将有助于理解宿主对病原体感染中STING参与的固有免疫应答机制,为进一步探索布鲁氏菌感染的免疫机制及治疗布鲁氏菌病提供基础。
3 干扰素基因刺激因子
干扰素基因刺激因子(STING)是一种内质网(ER)驻留的跨膜蛋白,它调节I型干扰素(Interferon,IFN)依赖的固有免疫反应,当它暴露于细胞质DNA时,会易位到某些核周位点,进而促进炎症因子的表达[11]。它在巨噬细胞、树突状细胞、T淋巴细胞、内皮细胞、上皮细胞和选择性成纤维细胞中表达[12]。STING作为一个二聚体,包含4个跨膜螺旋和一个突出到细胞质中的球状羧基末端结构域(Carboxyl-Terminal Domain,CTD),该区域的C端尾(very C-terminal tail,CTT)使STING处于自抑制状态[13]。目前研究发现在布鲁氏菌感染后,STING参与固有免疫的激活及调节机制如下。
3.1 DNA释放 在布鲁氏菌感染后固有免疫应答过程中,细菌dsDNA必须进入细胞质以激活STING,细胞内细菌激活STING需要分解细菌、脱离BCV并随后将细菌DNA释放到胞质中。第二信使环二鸟苷酸(cyclic diguanylate ,c-di-GMP)是一种重要的细菌代谢调节剂,它可以根据环境信号(如磷酸盐、氧和一氧化氮水平以及光照)改变细菌代谢和毒性。它在使布鲁氏菌成功感染细胞过程中发挥了重要作用[14]。布鲁氏菌c-di-GMP诱导接头分子STING的激活,触发I型IFN和重组人干扰素调节因子1(Interferon Regulatory Factor 1,IRF-1),导致鸟苷酸结合蛋白(Guanylate Binding Protein,GBPs)的表达[15]。I型IFN信号通路在细菌感染期间促进细菌裂解,细胞释放的I型IFN也可以自分泌或旁分泌的方式结合I型IFN受体亚单位IFNAR1和IFNAR2,通过IFN刺激基因因子3(Interferon Regulatory Factor 3,IRF3)促进信号转导,上调数百个IFN诱导基因的产生。在这些基因家族中,编码GBP成员GBP2、GBP5和免疫相关GTP酶(immunity-related gtpase,IRG)成员IRGB10的基因通过I型IFN通路的转录因子IRF1上调[16]。GBPs与含有布鲁氏菌的囊泡相互作用,它的溶菌作用导致囊泡的裂解和细菌及其成分逃逸到细胞质中,并被细胞质传感器识别。最近,其他研究表明GBPs的机制中IRGB10直接靶向细胞质细菌,破坏了细菌结构的完整性,并介导了配体的胞质释放,以STING识别[17]。
3.2 STING激活 布鲁氏菌DNA释放到胞质后,STING不仅作为一种受体直接参与DNA传感,还可以作为一种适配器。因此,STING的激活可以通过两种不同的机制完成。首先,STING可以直接识别细菌DNA,从而作为主要的模式识别受体[18]。另外,通过环GMP-AMP合成酶(cGAS)的DNA传感触发cGAMP的合成,然后让STING作为二级受体参与[19]。cGAS包含2个主要的DNA结合结构域和1个核苷酸转移酶结构域。在DNA缺失时,cGAS以自抑制状态存在。布鲁氏菌感染后胞质DNA与cGAS结合后触发STING激活,产生第二信使环GMP-AMP (cGAMP)。cGAMP与内质网中的STING结合,诱导分子的构象改变,导致STING和TANK 结合激酶1(TANK-binding kinase 1,TBK1)重新定位到细胞的核周区域,从而激活[17]。在激活后,STING由内质网易位到高尔基体,招募胞内信号转导分子TBK1进而磷酸化干扰素调节因子3 (Interferon Regulatory Factor 3,IRF3),磷酸化的IRF3二聚,然后进入细胞核。STING还激活 IkB激酶(Inhibitor of kappa B kinase ,IKK),使转录因子NF-kB16的抑制剂IkB家族磷酸化。磷酸化的IkB蛋白通过泛素-蛋白酶体途径降解,核因子κB (nuclear factor kappa-B,NF-kB)进入细胞核,与IRF3和其他转录因子一起作用,诱导干扰素IFN和炎症细胞因子如TNF-α、IL-1b和IL-6的表达。见图1。
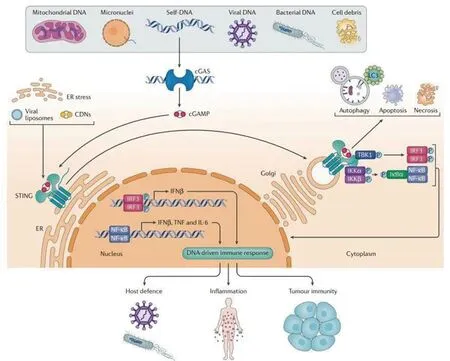
图1 gGAS-STING信号通路[20]Fig.1 The gGAS-STING pathway[20]
3.3 通路调节
3.3.1 RNA pol III RNA聚合酶III(RNA polymerase III,RNA pol III)检测到布鲁氏菌DNA的某些片段并转录为RNA配体,可能通过RIG-I途径诱导IFN-b。抑制RNA pol III的酶活性可消除部分布鲁氏菌DNA诱导的IFN-b的表达。这些结果表明,RNA pol III在检测布鲁氏菌感染期间的细菌DNA中发挥关键作用。细菌DNA可被RNA聚合酶III和STING途径感知,以协调I型IFN的产生[21],但两种途径相互协调关系及具体作用尚不明确。
3.3.2 MAVS STING也被报道是一种与线粒体抗病毒信号受体(mitochondria antiviral signaling protein,MAVS)相互作用的蛋白[22],虽然STING针对内质网,但它与转体MAVS相互作用,进而可能激活TRAF3/TBK1/IKKi和IRF3/IRF7,导致I型IFN的表达,并导致NF-kB通路的激活。MAVS通过RNA聚合酶III (RNA pol III)活性,通过RIG-I途径参与DNA传感,它作用于RIG-I的下游,IkB和IRF3的磷酸化的上游[23]。MAVS最初被描述为一种参与病毒双链RNA传感的细胞内分子。研究者研究了该分子在不同病毒感染中的作用[24]。然而,但关于其在细菌核酸识别中的作用鲜有报道,结果存在争议。Campos等研究结果表明,在布鲁氏菌的核酸识别中存在适配分子MAVS[23]。然而,需要进一步的研究来确定布鲁氏菌感染期间MAVS的功能。
3.3.3 UPR 有研究表明布鲁氏菌增殖导致内质网(ER)破坏和未折叠蛋白反应(unfolded protein response,UPR)启动[25]。内质网通过加工和折叠分泌蛋白和膜蛋白,在维持细胞稳态方面起着关键作用。错误折叠蛋白的积累可诱发内质网应激并激活保守内质网应激反应,导致内质网稳态的破坏,称为未折叠蛋白反应(UPR)。在哺乳动物细胞中,可通过一系列内质网膜应激传感器控制UPR,保持细胞稳态。在布鲁氏菌感染的背景下,内质网应激在诱发炎症反应方面起着关键作用[26]。布鲁氏菌诱导的UPR是由细菌c-di-GMP以STING依赖的方式触发的,这种响应支持细菌复制。布鲁氏菌DNA与STING结合后可动员内质网应激反应,UPR调控几种促炎介质的诱导,包括IL-6、IL-1b和 GBPs。UPR的诱导同样直接刺激IFN-b的表达[27]。
3.3.4 Omp25 Li等的研究首次描述布鲁氏菌外膜蛋白(Outer membrane protein 25,Omp25)通过靶向cGAS降解抑制IFN-β的表达。Omp25通过泛素蛋白酶体促进cGAS的降解,抑制了STING和IRF3的磷酸化,以及磷酸化IRF3在人巨噬细胞中的核易位,因此干扰cGAS/STING信号通路的激活,最终抑制IFN-β的产生,使表达Omp25的细胞更容易被其他病原体感染[28]。这揭示了Omp25在调节IFN-β产生中的作用,这可能为布鲁氏菌病的预防提供了新的见解。
3.3.5 HIF-1α 稳定缺氧诱导因子-1α((hypoxia inducible factor-1,HIF-1α)是细胞代谢和固有免疫细胞功能的全局调节器,稳定的HIF-1α可促进caspase-1的激活和IL-1β的释放,驱动病原体清除[29]。STING激活驱动线粒体活性氧(mROS)的产生,这有助于HIF-1α的稳定。因此,STING通过激活HIF-1α途径可能有助于控制布鲁氏菌感染[30]。
3.4 STING的作用 布鲁氏菌DNA是诱导I型IFN和IL-1b的主要细菌成分,STING在其中发挥了重要作用。STING是外源性DNA配体诱导IFN-b的必要条件,也是各种DNA病原体在感染后诱导IFN-b的必要条件[23]。STING缺失对依赖NF-kB的细胞因子如TNF-α和IL-6的产生有部分影响[31]。
STING和cGAS对参与I型IFN通路很重要,但只有STING才能诱导IL-1b分泌、caspase-1激活以及GBP2和GBP3表达。并且,在巨噬细胞和体内,STING而不是cGAS在控制细菌感染中发挥主要作用,缺乏cGAS仍可观察到与布鲁氏菌保护性免疫相关的先天免疫效应机制的激活。此外,STING激活导致GBPs表达和炎症小体激活,GBPs在AIM2激活、诱导炎性小体激活和IL-1b分泌中也起关键作用。并且,GBP蛋白在控制布鲁氏菌过程中发挥协同作用,GBPs对宿主保护比GBP2更重要[17]。
虽然STING可以保护细胞不受布鲁氏菌感染,但感染早期,布鲁氏菌下调了STING mRNA和蛋白的表达,这种显著抑制表明,布鲁氏菌会主动破坏这种固有免疫传感器,从而在巨噬细胞内得以存活。通过上调miR-24的STING抑制发生在转录后,并且miR-24的诱导和STING的抑制需要活菌,而完全抑制则需要VirB操纵子编码的IV型分泌系统(T4SS),这表明这是一个活跃的细菌驱动过程,而不是简单的宿主对布鲁氏菌PAMPs的反应。总之,细胞内布鲁氏菌通过miR-24介导的STING表达抑制在感染期间逃避了完全的STING激活[32]。这里阐明了布鲁氏菌免疫逃逸的一个关键机制,布鲁氏菌通过主动破坏固有免疫传感器STING的细胞质监测来建立其细胞内生态位。
4 STING信号通路与布鲁氏菌病相关症状
目前对布鲁氏菌感染中与STING信号通路相关的免疫机制与临床表现的研究有限,以下推测以炎症因子作为连接免疫机制与临床表现的桥梁,根据信号通路所激活的炎症因子及布鲁氏菌病的主要症状做出相关推断,但炎症因子可通过多种途径产生,与STING信号通路之间并不存在特异性,所以STING受体的激活与临床表现的相关性仍处于推测阶段,其是否具有相关性及其密切程度仍有复杂的作用机制需要进一步探索。
4.1 中枢型神经布鲁氏菌病 如上文所述,布鲁氏菌诱导STING的激活,触发I型IFN和IRF-1导致GBPs表达。GBPs与含有布鲁氏菌的囊泡相互作用,导致囊泡的裂解并将其内DNA释放到细胞质并激活AIM2[33]。此外,细菌诱导的线粒体活性氧(Reactive oxygen species,ROS)介导NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)激活。NLRP3和AIM2活化触发含有ASC和半胱天冬酶-1的炎症小体的组装,导致IL-1β加工和成熟IL-1β的分泌[34]。同时,STING受体激活后信号通路的一系列作用也可产生IL-1β。IL-1β可以激活血脑屏障的微血管内皮,并导致白细胞募集到中枢神经系统,这在神经布鲁氏菌病发病机制中起到重要作用[35]。
4.2 布鲁氏菌病关节炎 布鲁氏菌感染引起的骨损伤的机制尚不完全清楚。骨损伤可归因于细菌的直接作用或由先天免疫引发的炎症所致的免疫病理学过程。感染布鲁氏菌后,巨噬细胞可引起 TNF-α、IL-1β 和 IL-6 等炎症因子的释放,这些炎症因子能够诱导未分化的骨髓细胞形成破骨细胞。TNF-α是骨吸收的有效诱导剂,它是通过激活成熟破骨细胞参与病理改变的主要促炎因子[36]。STING信号通路激活后可通过一系列反应释放上述相关炎症因子,再次推测STING信号通路可能参与了布鲁氏菌病关节炎的免疫机制。
4.3 早期感染控制 IL-6是STING受体激活后产生的重要的炎症因子之一,研究表明IL-6是感染布鲁氏菌病后免疫过程中的重要调节因子,一般被认为是急性期炎症反应的激活剂,并且是控制感染早期体内布鲁氏菌复制所必需的,有助于宿主抵抗感染[37]。因此,IL-6可能成为一个有希望的治疗靶点。
5 意义及展望
在感染初期或急性期,机体能否及时控制布鲁氏菌的复制并成功消灭感染,固有免疫是关键所在。细胞内DNA传感器在诱导固有免疫反应对抗病原体感染的潜在机制正在被广大学者研究。然而,其在布鲁氏菌病中的作用机制并不十分明确,还有待进一步研究,比如布鲁氏菌DNA在胞质中与DNA受体的识别途径以及各信号级联如何调控、布鲁氏菌DNA的识别过程中GBP的靶向是如何调节的等等。此外,在布鲁氏菌感染过程中,多种受体同时参与了固有免疫激活,各种受体传感器之间是否存在相互影响、是否互相调节尚不明确。目前,STING作为肿瘤治疗相关靶点的研究较多,是否可作为布鲁氏菌病等感染型疾病的治疗靶点以及在疫苗中的应用还有待继续探索。STING在布鲁氏菌对固有免疫机制调控方面仍有很多环节尚不明了,因此有待我们做更深入的研究和探讨,以期对布鲁氏菌病的预防和早期治疗提供有用的线索。
利益冲突:无
