贵州省2株牛种布鲁氏菌分子流行病学特征分析
2023-02-20谭勤琴杨幸贵李世军
谭勤琴,王 月,刘 英,营 夏,杨幸贵,马 青,胡 勇,李世军
布鲁氏菌病(Brucellosis,简称布病)是由布鲁氏菌属(Brucella)的细菌侵入机体,引起的人兽共患传染-变态反应性疾病,已被我国《职业病分类和目录》列为生物因素所致的职业病。人患布病以不规则发热、关节炎为主要症状,雌性动物患布病以流产为主要特征,可造成巨大的经济损失。疫畜是布鲁氏菌病的主要传染源,疫牛使得牛种布鲁氏菌在牛群中传播,可引起牛群发生暴发性流产或不孕,严重影响畜牧业发展[1]。近年来随着贵州省畜牧业的发展,散发或聚集性布病疫情在贵州省时有发生,特别是在贵州省大力发展奶牛、肉牛养殖之际,及时鉴定及分析牛种布鲁氏菌株的分子流行病学特征,可为从事相关职业人群在布病防控方面提供科学依据。
布鲁氏菌的生物型主要根据其宿主动物及病原体生化特征进行鉴定[2],无法进行感染菌株的溯源分析。布鲁氏菌基因组高度保守,单核苷酸多态性(SNP)是各种(型)菌的主要差异来源,rpoB基因在布鲁氏菌各个种和生物型中均具有较高多态性,且分型结果明确[3]。多位点可变数目串联重复序列分析(MLVA)分型技术分辨率高、重复性好,且已实现分型数据共享,可用于布鲁氏菌的分子流行病学溯源分析[4-6]。而多位点序列分型(MLST)技术基于管家基因分型,且分辨力良好、比对方便,主要用于细菌进化关系及种群结构研究[5]。本研究采用rpoB、MLVA-16及MLST分型技术,对贵州省牛种布鲁氏菌的遗传特性及分子流行病学特征进行分析。
1 材料与方法
1.1 试验菌株 2株分离株及动物用疫苗株(M5、S2及A19)。贵州省自2009年开始出现布病疫情以来,共计分离出2株牛种布鲁氏菌,此2株分离株系2013年由刘英等[7]分离,依据其培养特性及传统生化分型技术鉴定其为牛种3型布鲁氏菌。布氏菌病活疫苗株系天康生物股份有限公司生产,贮藏于2~8 ℃,牛种布鲁氏菌A19、羊种布鲁氏菌M5及猪种布鲁氏菌S2分别作为牛种、羊种及猪种布鲁氏菌研究实验的阳性对照菌株。
1.2 主要仪器与试剂 主要仪器有CO2培养箱(美国Thermo公司)、PCR扩增仪(美国Thermo公司)、凝胶成像仪(美国Bio-Rad公司)等。试剂主要为布鲁氏菌琼脂培养基(美国BD公司)、PCR试剂(New England Biolabs,Inc)和引物(由北京天一辉远生物科技有限公司合成)。
1.3 分析工具 DNANAN和BioNumerics(Version 8.0)软件及在线分析工具(http://mlva.i2bc.paris-saclay.fr、https://pubmlst.org/bigsdb?db=pubmlst_brucella_seqdef&page)。
1.4 研究方法
1.4.1 细菌培养及核酸提取 将保存菌株复苏于布鲁氏菌琼脂平板上,根据细菌的生长情况于37 ℃培养24~48 h。按照《布鲁氏菌病诊断》(WS 269-2019)中煮沸裂解法提取布鲁氏菌基因组DNA,同时提取疫苗株M5、A19和S2的核酸作实验用阳性对照。
1.4.2 BCSP31-PCR鉴定布鲁氏菌属 采用《布鲁氏菌病诊断》(WS 269-2019)中提供的B4、B5引物序列、反应体系及扩增参数对2株分离株、3株疫苗株及阴性对照进行扩增,产物经1.5%的琼脂糖凝胶电泳后成像检测。
1.4.3 AMOS-PCR鉴定布鲁氏菌的种/型 参照《布鲁氏菌病诊断》(WS 269-2019)中使用的引物序列、反应体系及扩增参数对2株分离株、3株疫苗株及阴性对照进行扩增,产物经1.5%的琼脂糖凝胶电泳后成像检测。
1.4.4rpoB基因的多态性分型 运用文献[8]使用的rpoB基因序列引物、反应体系及扩增参数对菌株核酸进行PCR扩增,1.0%琼脂糖凝胶电泳检测扩增产物,有目标条带的产物送公司进行双向测序。下载NCBI在线网站中布鲁氏菌16MrpoB基因序列(Gene ID:29593532),以其基因序列为标尺,大多数布鲁氏菌分子分型分析是基于布鲁氏菌(16M)的全基因组测序而进一步研究[9-10]。运用DNAMAN软件比对测序序列及参考序列,明确2株分离株的单核苷酸多态性位点,确定其rpoB基因型。
1.4.5 MLVA-16对菌株分型 采用文献[11]使用的MLVA-16的16个重复序列位点引物序列、反应体系及扩增参数对菌株核酸进行扩增,1.2%琼脂糖凝胶电泳检测扩增产物,Panel 1各位点扩增产物挑取差异序列送公司测序,测得序列去除侧翼序列得出该位点重复序列的长度,Panel 2各位点扩增产物进行毛细管电泳,直接测得位点基因片段长度。下载MLVA在线数据库(http://mlva.i2bc.paris-saclay.fr)里的中国各地牛种布鲁氏菌代表株的MLVA型,用BioNumerics version 8 软件经非加权配对算术平均法进行聚类分析。
1.4.6 MLST对菌株分型 采用针对布鲁氏菌7个管家基因(gap、dnaK、aroA、trpE、cobQ、gyrB和glk)和2个非管家基因(Omp25、int-hyp)为靶标基因的MLST分型技术。参照文献[12]设计的引物序列、扩增体系及扩增参数进行扩增,产物经1.2%的琼脂糖凝胶电泳检测,将有目标条带大小的产物送公司进行测序。将序列结果运用BioEdit软件将序列截短与参考序列长度一致,输入https://pubmlst.org/bigsdb?db=pubmlst_brucella在线数据库明确其定义值。若出现新序列,核对测序峰图以确认该位点的碱基判定,核对无误,进行再次扩增送样检测,如若两次测得结果一致,则定义为一个新的等位基因。下载MLST在线数据库(https://pubmlst.org/bigsdb?db=pubmlst_brucella)里的中国各地牛种布鲁氏菌代表株的MLST型,用BioNumerics version 8 软件经非加权配对算术平均法进行聚类分析。
2 结 果
2.1 菌株培养结果 2株布鲁氏菌分离株在布鲁氏菌琼脂平板上均呈现圆形、边缘整齐、表面光滑湿润、稍隆起、均质透明的菌落形态。
2.2 BSCP31-PCR鉴定结果 2株分离株及阳性对照菌株DNA的扩增产物均出现223 bp的特异性DNA扩增条带,而阴性对照未出现扩增条带,判定为布鲁氏菌属细菌。
2.3 AMOS-PCR鉴定结果 2株分离株无特异性条带出现,M5出现分子量731 bp的特异条带,A19出现大小为498 bp的特异条带,S2出现285 bp的特异条带;阴性对照无特异条带出现,排除分离株为羊种、猪种1型、绵羊附睾种及牛种1、2、4型菌的可能。
2.4rpoB基因的多态性分型鉴定结果 2株分离株的rpoB序列经与16MrpoB基因序列比对后发现有5个位点出现了碱基的改变,2株分离株均存在核酸序列729位点T→C(Condon 243 GAC)、804位点G→T(Condon 268 ACT)、1020位点G→A(Condon 340 GAA)、2211位点T→C(Condon 737 GTC)、2907位点C→T(Condon 969 CGT)的突变,如图1(截取突变位点所在的序列),位点变异模式与文献[3,13]研究鉴定的牛种rpoBⅥ型(生物型为B.abortus7)相符合。

图1 2株分离株与16M的rpoB基因序列比对图Fig.1 Sequence comparison of the rpoB gene of the two isolate strains with 16M
2.5 MLVA-16分型鉴定结果 贵州省2株分离株的MLVA-8分型为36型,MLVA-11分型为72型,MLVA-16基因型为4-5-3-12-2-2-3-1-6-43-8-5-5-5-3-3。
2.6 MLVA聚类分析结果 基于MLVA-16分型分析数据,2株分离株与布鲁氏菌标准株及国内各地的牛种布鲁氏菌代表株聚类分析显示,贵州省牛种布鲁氏菌与新疆布鲁氏菌共享同一MLVA-16型,且与河北省、内蒙古自治区的牛种布鲁氏菌的相似性在92.2%以上,如图2。

图2 2株分离株与布鲁氏菌标准株及国内各地的牛种布鲁氏菌代表株聚类分析树状图Fig.2 Dendrogram based on MLVA genotyping analysis (UPGMA method),showing the correlation of two isolate stains with Brucella standard strains and representative strains of B. abortus throughout China
2.7 MLST分型鉴定结果 贵州省2株牛种布鲁氏菌分离株的MLST基因谱相同,均为gap(2)、aroA(1)、glk(2)、dnaK(2)、gyrB(1)、trpE(3)、cobQ(1)、omp25(1)、Int-hyp(1),符合ST2型各等位基因型特征,鉴定为ST2型。
2.8 MLST聚类分析结果 基于MLST分型分析数据,2株分离株与布鲁氏菌标准株及国内各地的牛种布鲁氏菌代表株以位点距离≤2构建的最小间距图显示2株分离株与布鲁氏菌属内的牛种布鲁氏菌遗传距离最近,属同一个遗传复合体,如图3。17种ST 型等位基因谱及其对应布鲁氏菌种见表1。
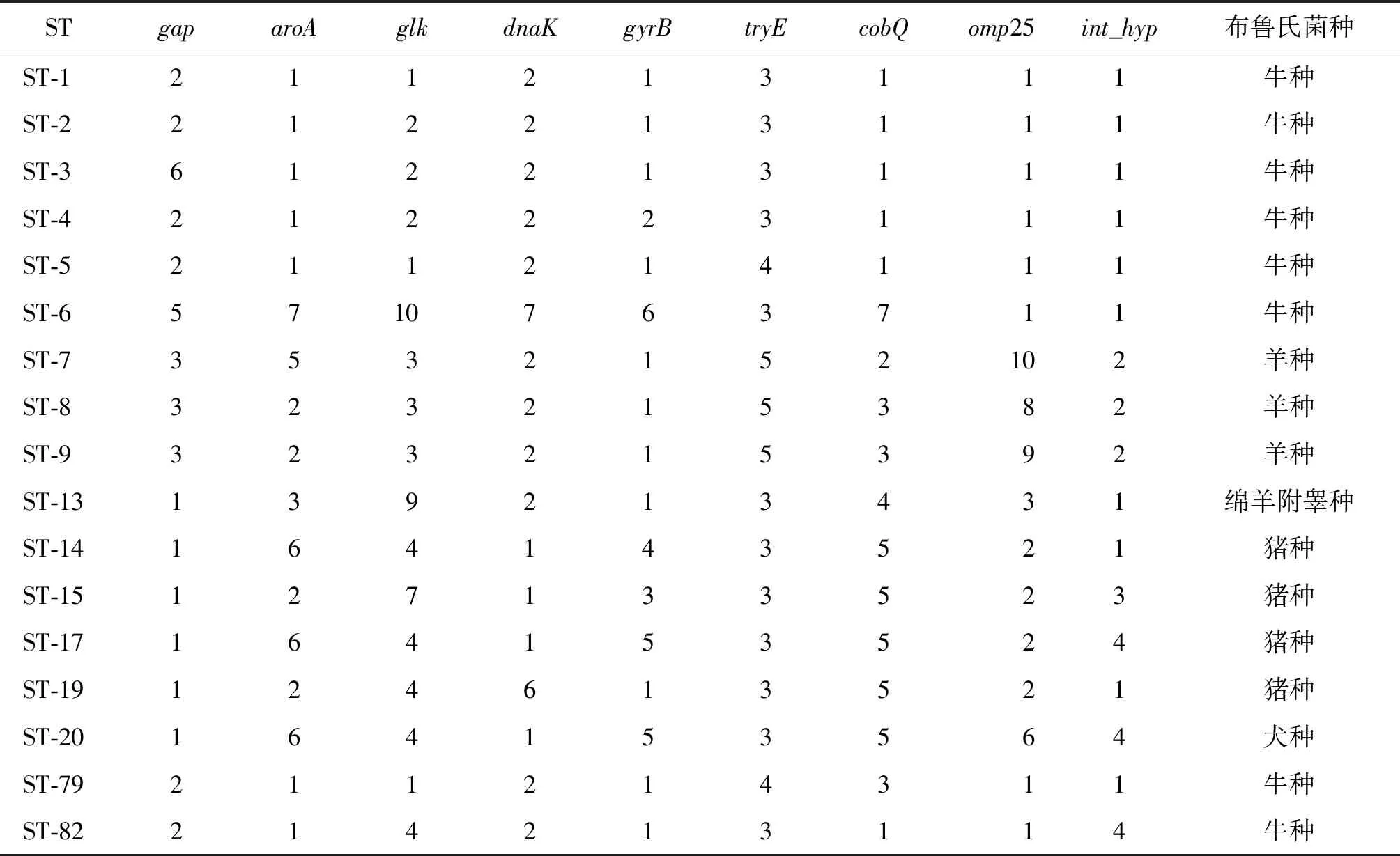
表1 17种ST型的等位基因谱及其对应的布鲁氏菌种Tab.1 Allele profiles of 17 ST types and the corresponding Brucella species for each ST type

注:每个圆圈代表一种基因型,数字代表ST型别,圆圈大小对应该ST型分布的地区数量。图3 2株分离株与布鲁氏菌标准株及国内各地的牛种布鲁氏菌代表株聚类分析最小间距图Fig.3 Clustering analysis minimum spanning tree (MST) mapping based on MLST genotype data of two isolate stains with Brucella standard strains and representative strains of B. abortus throughout China
3 讨 论
布病对人类健康构成较大威胁,对畜牧业发展构成严重阻碍,近年来贵州省布病疫情呈现出不断扩大的趋势[15],布鲁氏菌分子流行病学特征分析对了解其遗传变异、流行株的亲缘关系等具有重要意义,分析贵州省牛种布鲁氏菌菌株的分子流行病学特征,可为其防控工作提供科学依据。
本研究中,BCSP31-PCR技术鉴定2株分离菌为布鲁氏菌属细菌,结合AMOS-PCR检测,该结果与先前报道为牛种3型布鲁氏菌的结果相符[7]。进一步采用rpoB、MLVA及MLST技术对2株分离株分型,均证明了二者间的rpoB、MLVA及MLST型别一致,rpoB分型为rpoB牛种Ⅵ型,基于MLVA和MLST的聚类分析均显示其与牛种布鲁氏菌聚类最近,提示在布鲁氏菌种的鉴定上,生物分型与子分型技术具有一致性。2株牛种分离株rpoB基因型与Marianelli等[3]研究的生物型为牛种7型的布鲁氏菌rpoB基因型型别一致,提示布鲁氏菌的生物型和rpoB基因型无明显关联性,与李明慧等[10]研究结果一致。有研究表明布鲁氏菌rpoB基因序列出现变异可致利福平不能结合到RNA聚合酶β亚基,导致细菌对利福平耐药[16-17],但rpoB基因用于布鲁氏菌分型的SNP位点与耐药SNP位点是不一致的,分析2株分离株的rpoB基因序列,除了实现分型以外,同时也显示2株菌可能为非耐药菌株[17-19],该结果可利于临床用药参考。大量研究表明[4-5,20-22],MLVA技术分辨率高、重复性好且数据共享,可用于布鲁氏菌的流行病学追踪调查及确定菌株间的亲缘关系,而MLST技术主要基于保守性高的管家基因分型,可用于分析布鲁氏菌的种群结构和进化关系。MLVA聚类分析显示,2株分离株与新疆牛种布鲁氏菌共享同一MLVA-16型,且与河北省、内蒙古自治区的牛种布鲁氏菌的相似性在92.2%以上,提示分离株导致的布病感染疫情可能为有关联的外省输入性疫情,MLST聚类分析也得到同样结果。
人间布病疫情是畜间布病疫情的风向标,根据流行病学调查资料显示,2名奶牛场的养殖人员因出现发热、乏力等不适反应先后前往医院就诊,经检测其布病抗体阳性,且经血培养分离出牛种布鲁氏菌,提示该养殖场可能存在牛种布鲁氏菌的感染,2名患者可能因接触感染牛种布鲁氏菌的牛而感染布病。尽管牛种布鲁氏菌的毒力弱,但其仍可对人致病并导致明显的临床症状,故必须引起重视。从基因型角度分析,2株牛种布鲁氏菌间的亲缘关系近,且与国内各地牛种布鲁氏菌代表株的遗传距离较近,可能为输入性布鲁氏菌导致的疫情,提示贵州省的布病疫情防控须重点关注省内外牲畜交易、配种等活动,执行严格的检验检疫,以保护本地畜牧业的健康发展。
利益冲突:无
