五味子素通过调控FOXC1基因对结直肠癌细胞恶性生物学行为的作用机制
2023-02-20许亚坡罗金键吴慧丽
许亚坡 罗金键 夏 超 吴慧丽
全球范围内结直肠癌(colorectal cancer,CRC)每年新发病例数约180万,死亡人数约88万[1],而近年我国CRC患病率及死亡率呈上升趋势,患病率居恶性肿瘤第三位,死亡率居第五位[2],严重威胁国民生命健康。手术是治疗早期CRC的有效手段,但进展、转移等阶段的CRC患者,生存情况不容乐观,分子靶向机制是现阶段临床研究重点[3],故而探寻有效的基因治疗靶点药物对患者生存有积极意义。五味子素来源于五味子中分离的木脂素类活性成分,具有抗炎、神经保护、调节细胞代谢等多种药理作用[4],近年研究表明其在肿瘤抑制方面显示出确切效果[5]。另有研究发现,叉头框转录因子C1(Forkhead boxC1,FOXC1)作为插头框转录因子家族重要一员,与癌细胞分化、发育等过程密切相关,上调其水平可促进CRC癌细胞增殖[6]。但目前关于五味子素对CRC细胞增殖、侵袭及调控FOXC1基因的机制尚未明确,本研究以CRC HCT116细胞为研究对象,探讨五味子素对HCT116细胞的影响,并进一步分析其作用机制,为临床CRC治疗提供参考依据。报告如下。
1 材料与方法
1.1 材料
1.1.1 细胞系 人CRC HCT116细胞,购自上海匹拓生物科技有限公司。
1.1.2 试剂与仪器 RPMI-1640培养基购自上海微科生物技术有限公司,Opti-MEM培养基购自赛默飞世尔科技(中国)有限公司;细胞计数试剂盒-8(CCK-8)购自上海泽叶生物科技有限公司,LipofectamineTM 2000试剂盒及Trizol溶液来自北京索莱宝科技有限公司,Transwell chamber购自广州赛哲科技有限公司;五味子素、DEPC购自Sigma-Aldrich(上海)贸易有限公司,Binding Buffer缓冲液购自上海君瑞生物技术有限公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)购自北京冬歌博业生物科技有限公司,碘化丙啶(PI)及0.1%结晶紫购自上海麦克林生化科技有限公司,十二烷基硫酸钠-聚丙烯酰氨凝胶(SDS-PAGE)购自上海群己生物科技有限公司;FOXC1、FOXC1-NC(模拟物阴性对照)均购自美国Sigma-aldrich公司;FOXC1(ab227977)、E-cadherin(ab16663)、MMP2(ab92536)、Vimentin(ab92547)抗体购自美国Abcam公司;Varioskan LUX型酶标仪购自赛默飞世尔科技(中国)有限公司,流式细胞仪(美国BD公司,FACSCalibur型),Avanti J-E离心机购自美国贝克曼库尔特有限公司,Powerpac Universal型电泳仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 细胞培养 人CRC HCT116细胞,生长于含10%灭活胎牛血清、100 U/ml链霉素及青霉素的RPMI-1640培养基,将培养基置于5% CO2、37 ℃的饱和温度培养箱中,每2~3 d使用0.25%胰蛋白酶消化及传代细胞1次,采用10% DMSO+90%血清冻存液来冻存细胞,用于后续实验操作。
1.2.2 CCK-8检测CRC HCT116细胞增殖 取对数生长期HCT116细胞,接种于96孔板(每孔2×104个),分别添加0、12.5、25、50 μmol/L浓度的五味子素(甲醇溶解),每个浓度设置5个复孔,将HCT116细胞在培养箱(5% CO2、37%)中分别培养12 h、24 h、48 h,细胞贴壁丢弃培养基,再添加10 μl CCK-8与200 μl培养基,37 ℃孵育2 h,490 nm波长下使用酶标仪测定吸光度值,计算不同浓度下细胞存活率,明确细胞增殖情况,重复3次,取平均值。并选择细胞存活率接近50%的五味子素浓度进行后续实验研究。
1.2.3 细胞转染与分组 随机分层法分为5组:对照组、FOXC1-NC组、FOXC1组、五味子素组、FOXC1+五味子素组。转染前24 h,取长势良好对数生长期HCT116细胞,倒置显微镜,观察细胞增殖至60%~70%时,进行胰蛋白酶消化,收集CRC HCT116细胞,PBS重悬,调整细胞密度,以1×106个/ml接种到24孔板,每组设置5个复孔,每个复孔重复3次,之后进行细胞转染:使用相关基因序列质粒(2.4 μl的FOXC1-NC及FOXC1)与5 μl的LipofectamineTM2000分别添加至245 μl的Opti-MEM培养基中,制成溶液备用,静置5 min后,混匀,静置30 min,37 ℃继续培养(48 h),荧光显微镜下观察转染率,转染成功标准为转染率>85%,以便用于后续实验。对照组不做任何处理,FOXC1-NC组转染FOXC1-NC,FOXC1组转染FOXC1,五味子素组HCT116细胞内加入50 μmol/L五味子素,FOXC1+五味子素组稳定转染FOXC1 24 h后加入五味子素50 μmol/L。
1.2.4 流式细胞仪测定HCT116细胞凋亡情况 取HCT116细胞,添加预冷PBS缓冲液,离心6 min(4 ℃,1000 r/min,离心半径10 cm),弃上清液,再次加入预冷PBS缓冲液,离心(离心条件同上),弃上清液,加入500 μl 1×Binding Buffer缓冲液来重悬细胞,之后依次加入5 μl Annexin V-FITC、10 μl PI,室温下振荡孵育,使用流式细胞仪测定细胞凋亡情况,CELL QUEST 3.0分析实验数据。
1.2.5 Transwell实验检测细胞侵袭能力 预冷培养液,以1∶8比例稀释Matrigel基质胶与培养基,加入Transwell chamber上室(40 μl/孔),培养箱孵育(37 ℃,5 h),选取对数期HCT116细胞,加入Transwell chamber上室,每孔3×104个,将100 g/L胎牛血清培养液加入Transwell chamber下室,每孔600 μl,培养箱培养24 h(37 ℃),PBS缓冲液洗涤,棉签擦去微孔膜内层磁暴,多聚甲醛固定(20 min),PBS清洗,0.1%结晶紫染色(10 min),洗去表面结晶紫,选10个视野,显微镜下计算侵袭至微孔膜下层的细胞数,重复3次实验,取平均数。
1.2.6 Realtime-PCR测定FOXC1、E-cadherin、MMP2、Vimentin mRNA表达 收集各组培养48 h的HCT116细胞,PBS缓冲液冲洗2次,吸尽PBS溶液后,予以Trizol溶液1 ml震荡混匀(4 ℃,5 min),加入0.2 ml氯仿振荡15 s,静置(4 ℃,3 min),离心(4 ℃,12000 rpm,15 min),取上层水相至离心管,加入等体积异丙醇,-20 ℃静置20 min,离心(4 ℃,12000 rpm,15 min),弃上清,1 ml DEPC处理后洗涤沉淀,离心机离心(4 ℃,8000 rpm,185 min),加入dd H2O水30 μl,溶解RNA;RNA逆转录合成cDNA,以逆转录cDNA为模板,进行PCR扩增,引物序列如表1,反应体系如下:总反应体系10 μl,2 μL模板cDNA ,各1 μl上下游引物,扩增条件(98 ℃反应5 min,95 ℃变性15 s,72 ℃延伸30 s,熔解曲线55 ℃~95 ℃,40个循环);以β-actin为内参,目的基因相对定量采用2-△△CT法计算。

表1 引物序列
1.2.7 Western blot检测FOXC1、MMP2、E-cadherin、Vimentin蛋白表达 取各组细胞,加入蛋白裂解液,混匀,充分裂解20~30 min,提取蛋白质,之后予以离心(12000 r/min,离心半径10 cm,5 min),取上清液,SDS-PAGE电泳,电转缓冲液转膜(50 min),转移蛋白至硝酸纤维素膜上,将其放入50 g/L脱脂奶粉中,孵育2 h,TBST洗膜5 min,在加入稀释(1∶1000)的FOXC1、MMP2、E-cadherin、Vimentin一抗与稀释(1∶2000)的β-actin一抗中孵育过夜(4 ℃),次日洗膜,加入稀释(1∶2000)二抗孵育(室温,1 h),洗膜,暗室中曝光显影,凝胶成像系统扫描,Image J 软件分析灰度值,计算相对表达量:目的蛋白/内参β-actin灰度值。
1.3 统计学方法
2 结果
2.1 不同浓度五味子素对HCT116细胞存活率的影响
使用不同浓度五味子素作用于HCT116细胞,检测不同时间点细胞存活率,结果发现,与0 μmol/L五味子素处理HCT116细胞比较,在12 h、24 h、48 h时采用12.5、25、50 μmol/L五味子素处理的细胞存活率逐渐降低(P<0.05),其中采用50 μmol/L五味子素处理48 h时,细胞存活率最接近50%,后续实验均选取此条件细胞。见图1。
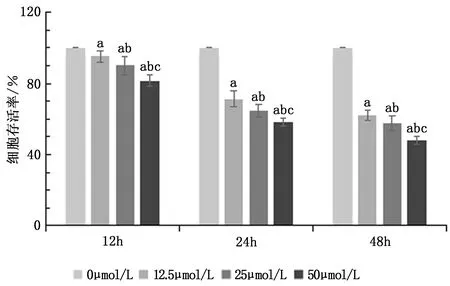
图1 不同浓度五味子素处理不同时间的HCT116细胞存活率
2.2 各组细胞凋亡率比较
5组细胞凋亡率比较,差异有统计学意义(P<0.05);两两比较结果显示,与对照组、FOXC1-NC组比较,FOXC1组细胞凋亡率降低(P<0.05);与对照组比较,五味子素组细胞凋亡率升高(P<0.05);FOXC1+五味子素组细胞凋亡率高于FOXC1组,低于五味子素组(P<0.05)。见表2。
表2 各组HCT116细胞凋亡率比较
2.3 各组细胞侵袭能力比较
5组侵袭细胞数比较,差异有统计学意义(P<0.05);与对照组、FOXC1-NC组比较,FOXC1组侵袭细胞数升高(P<0.05);与对照组比较,五味子素组侵袭细胞数下降(P<0.05);且FOXC1+五味子素组侵袭细胞数低于FOXC1组,高于五味子素组(P<0.05)。见表3、图2。
表3 各组HCT116细胞侵袭细胞数比较
2.4 FOXC1、E-cadherin、MMP2、Vimentin mRNA表达水平
5组HCT116细胞FOXC1、E-cadherin、MMP2、Vimentin mRNA表达比较,差异有统计学意义(P<0.05);与对照组、FOXC1-NC组比较,FOXC1组FOXC1、MMP2、Vimentin mRNA表达水平升高,E-cad-herin mRNA表达水平下降(P<0.05);与对照组比较,五味子素组FOXC1、MMP2、Vimentin mRNA表达水平降低,E-cadherin mRNA表达水平升高(P<0.05);FOXC1+五味子素组FOXC1、MMP2、Vimentin mRNA表达水平低于FOXC1组,高于五味子素组,且E-cadherin mRNA表达水平高于FOXC1组,低于五味子素组(P<0.05)。见表4。
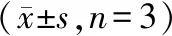
表4 各组HCT116细胞FOXC1、E-cadherin、MMP2、Vimentin mRNA表达水平
注:×200,A:对照组;B:FOXC1-NC组;C:FOXC1组;D:五味子素组;E:FOXC1+五味子素组
2.5 FOXC1、E-cadherin、MMP2、Vimentin蛋白表达水平
5组HCT116细胞FOXC1、E-cadherin、MMP2、Vimentin 蛋白表达比较,差异有统计学意义(P<0.05);与对照组、FOXC1-NC组比较,FOXC1组FOXC1、MMP2、Vimentin蛋白表达水平升高,E-cadherin蛋白表达水平下降(P<0.05);与对照组比较,五味子素组FOXC1、MMP2、Vimentin蛋白表达水平降低,E-cadherin蛋白表达水平升高(P<0.05);FOXC1+五味子素组FOXC1、MMP2、Vimentin蛋白表达水平低于FOXC1组,高于五味子素组,且E-cadherin蛋白表达水平高于FOXC1组,低于五味子素组(P<0.05)。见表5、图3。
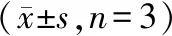
表5 各组HCT116细胞FOXC1、MMP2、Vimentin、E-cadherin蛋白表达水平
3 讨论
目前研究认为CRC是环境、遗传、饮食习惯、生活方式等多因素协同作用的结果,mi RNA基因突变或扩增,致使致癌信号激活,细胞发生恶变,产生大量利于自身生长的趋化因子,不加干预会不断恶化、转移,手术、化疗虽可延长患者生存时间,但手术存在肿瘤分期限制,化疗存在耐药性及毒副作用,整体生存率仍有待提高[7],因此深入探索其他CRC治疗机制十分必要。
注:A:对照组;B:FOXC1-NC组;C:FOXC1组;D:五味子素组;E:FOXC1+五味子素组
五味子素来源于木兰科植物五味子,前期学者研究发现其具有广泛的生物活性,如有学者[8]发现,五味子素B可转导TLR4信号,减少神经元凋亡,以保护神经;另有学者发现[9]五味子素B可增强多西他赛的抗肿瘤作用,促进细胞凋亡。随着临床的应用逐渐发现,五味子素系列在肿瘤方面显示出独特优势,研究表明[10]五味子素A可下调miR-155水平,抑制乳腺癌细胞增殖,且有研究发现[11]五味子素B能诱导人前列腺癌细胞凋亡,具有潜在药理作用。而五味子素对CRC细胞的凋亡、侵袭能力影响尚不清楚。本研究采用不同浓度五味子素处理CRC HCT116细胞发现,不同浓度五味子素可不同程度降低细胞存活率,提示五味子素可降低HCT116细胞活性。为进一步评估五味子素对各组HCT116细胞的凋亡、侵袭影响,本研究采用流式细胞仪测定HCT116细胞凋亡情况,Transwell实验测定细胞侵袭能力,结果显示,经转染FOXC1后,细胞凋亡率低于对照组、FOXC1-NC组,侵袭细胞数高于对照组、FOXC1-NC组,提示过表达FOXC1可抑制细胞凋亡,增强细胞侵袭力;在过表达FOXC1后使用五味子素干预,发现FOXC1+五味子素组细胞凋亡率低于五味子素组,而侵袭细胞数高于五味子素组,提示五味子素抑制促进细胞凋亡及抑制细胞侵袭,可能与降低FOXC1表达有关。
FOXC1定位于染色体6p25上,是FOX家族重要一员,已被证实在肝癌、肺腺癌等多种恶性肿瘤中高表达,参与癌细胞生物学行为,与细胞迁移、侵袭、耐药性密切相关[12-14]。Seong-Hoon Yun等[15]国外学者发现,OUP-TFII敲低可上调FOXC1表达,促进大肠癌细胞增殖与侵袭;而刘健等[16]学者研究显示,FOXC1可直接与靶基因整联蛋白α7、成纤维细胞生长因子受体4结合,激活其表达,促进直肠癌转移。上述表述提示FOXC1与CRC发展进程相关,本研究进一步进行Realtime-PCR及Western blot检测,分析各组细胞FOXC1及其下游基因mRNA、蛋白表达变化,结果发现,FOXC1组FOXC1、MMP2、Vimentin mRNA及蛋白表达水平高于对照组、FOXC1-NC组,E-cadherin mRNA及蛋白表达水平低于对照组、FOXC1-NC组,而五味子素组上述表达水平相反,而FOXC1+五味子素组则可部分逆转五味子素对FOXC1及其下游E-cadherin、MMP2、Vimentin mRNA及蛋白表达水平,以此验证五味子素可下调FOXC1表达,调节相关mRNA、蛋白水平,进而抑制细胞侵袭能力,促进HCT116细胞凋亡。
综上,FOXC1在CRC HCT116细胞中高表达,促进细胞增殖,而五味子素可降低细胞活力,抑制其侵袭,可能与五味子素下调FOXC1表达及调节相关mRNA、蛋白表达有关,可为临床基因靶向治疗提供实验依据,但本研究尚存一定局限性,需动物体实验来验证上述结论。
